首个TIL疗法Lifileucel疾病控制率高达79.3%,获FDA加速审批资格
首个TIL疗法Lifileucel疾病控制率高达79.3%,获FDA加速审批资格
用免疫系统来抵抗肿瘤,这是免疫学家的梦想。2013年,美国科学杂志正式把免疫治疗列为除手术、放疗、化疗以外的第四种正式治疗治疗癌症的手段。
美国癌症研究中心的Steven A. Rosenberg博士是探索免疫细胞治疗癌症的先行者,他发现肿瘤组织里面有大量的肿瘤浸润淋巴细胞(TILs),他把这类T细胞拿到体外来扩增,然后回输给患者,发现有比较好的效果。
放眼整个行业,“基于TILs细胞的创新型疗法LN-144(Lifileucel)预计在2023年获批”的呼声尤其大,TILs疗法作为“古老”的细胞疗法有望迎来首款获批产品,其在治疗实体瘤方面的巨大潜力不可小觑,实力强劲,较为“出圈”。
Lovance作为目前TILs细胞治疗领域领头羊,早些时候已向FDA启动递交创新型疗法LN-144(Lifileucel)滚动上市申请,用于治疗PD-1/PD-L1治疗后进展的晚期黑色素瘤。
5月26日,Iovance Biotherapeutics公司宣布FDA已经受理了其用于晚期黑色素瘤患者治疗的Lifileucel 生物制品许可申请(BLA)。FDA授予lifileucel优先审评资格并指定2023年11月25日作为根据《处方药用户收费法案》(PDUFA)作出决定的目标行动日期。
FDA目前未计划召开咨询委员会会议来讨论此申请,在初步审查后,目前尚未发现任何潜在的审查问题。全球首款实体肿瘤细胞治疗药物上市,只差最后一步。

图源Iovance Biotherapeutics官网
Lifileucel是一种TIL疗法,适用于在先前的抗PD-1/L1治疗和靶向治疗进展的晚期黑色素瘤患者。这些患者尚无FDA已批准的其他疗法。根据FDA的政策,基于优先评审程序,该疗法从BLA受理之日起将接受为期六个月的审查,如果获得批准,这将比标准护理疗法更安全或更有效。FDA此前还授予了Lifileucel 在晚期黑色素瘤中的再生医学先进疗法(RMAT)认证。
疾病控制率高达79.3%!首个TILs疗法获加速审评资格
本次BLA的申请是基于C-144-01临床试验数据,试验对象是在之前的抗PD-1/L1治疗和靶向治疗(如适用)期间或之后发生进展的晚期黑色素瘤患者。
在2023年3月,该公司官网在外科肿瘤学会公布的C-144-01试验的最新临床试验报告,包括153例晚期黑色素瘤患者的疗效数据。这些患者被纳入队列2(n=66)和队列4(n=87)。所有患者在免疫检查点抑制剂(ICI)治疗和BRAF/MEK抑制剂治疗中或治疗后均有进展。
入组患者的既往治疗中位数为3,其中100%的患者接受了抗PD-1治疗,81.7%的患者接受了抗CTLA-4治疗,53.6%的患者接受了抗PD-1联合抗CTLA-4治疗。
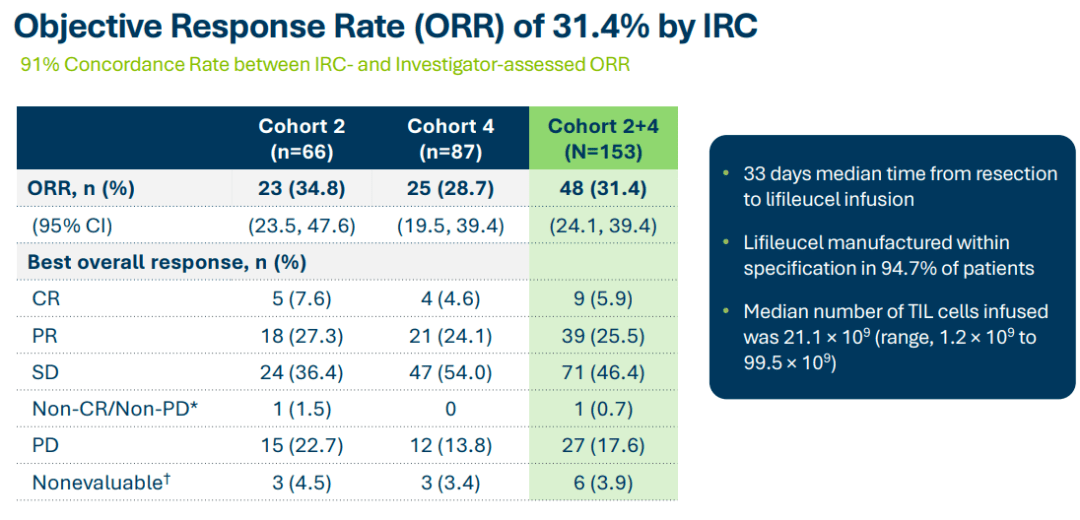
数据截止到2022年7月15日,中位随访时间为36.5个月。在所有患者中,独立评审委员会(IRC)根据RECIST v1.1标准评估的客观缓解率(ORR)为31.4%,其中,9例获得完全缓解(CR),39例部分缓解(PR),71例疾病稳定(SD),27例疾病进展(PD)。在中位随访27.6个月的研究中,中位DOR未达到,41.7%的缓解持续时间≥18个月。中位总生存期 (OS)和无进展生存期分别为13.9个月和4.1个月。
图源官网
在队列2(n=66)患者中,ORR为34.8%,5例患者达到CR,18例达到PR,24例达到SD,15例PD;中位随访时间为36.6个月时,中位DOR尚未达到。
在队列4(n=87)患者中,ORR达到28.7%,4例患者达到CR,21例达到PR,47例达到SD,12例PD;中位随访时间为23.5个月时,该队列的中位DOR为10.4个月。
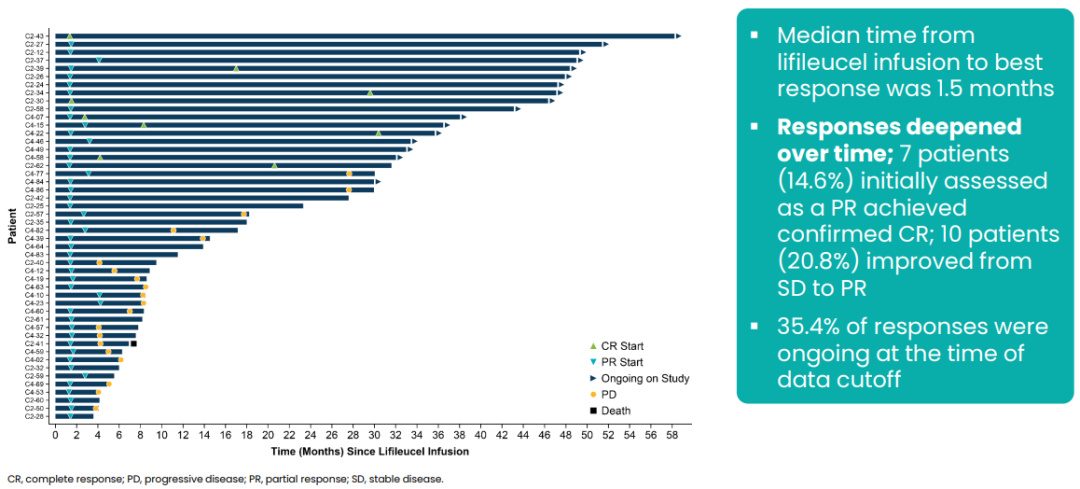
Lifileucel的疾病控制率达到了惊人的79.3%(111/140)。从注射lifileucel到最佳疗效的中位时间为1.5个月,随着时间的推移疗效加深。7例PR患者转化为CR,其中1例患者在最初数据分析后约10个月内转化为CR。
图源官网
如果Lifileucel获得加速批准,一线治疗晚期黑色素瘤的随机3期试验TILVANCE-301可以作为支持完全批准的验证性研究。TILVANCE-301预计将在获得批准期间顺利开展。
目前无癌家园有两款TILs免疫细胞临床试验正在招募中,主要治疗恶性实体肿瘤(包括非小细胞肺癌、食道癌、乳腺癌、卵巢癌、宫颈癌、胆管癌)等癌种。
【其中一款TILs临床试验招募非小细胞肺癌、乳腺癌、宫颈癌患者,仅限山东省内患者】
若想参加请咨询无癌家园医学部,详细评估病情。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
里程碑!mRNA-4157联合派姆单抗让
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

刚刚!"双免王炸"纳
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

2025肺癌生存新希望:六大"
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




