无癌生存超3年!最新研究发现:早期注射癌症疫苗,将阻断癌症进展、肿瘤长期"熄火"
最新研究发现:癌症早期注射抗癌疫苗,能够有效遏制肿瘤的进一步发展,可让肿瘤长期"静默"
近日,《癌症免疫治疗杂志》发表的一项最新临床前研究表明,在病变早期阶段注射癌症疫苗,能够有效遏制肿瘤的进一步发展。研究深入剖析后明确指出,接种疫苗的时机在整个治疗环节中起到了决定性作用,精准把握这一时机对治疗效果影响深远。这一研究成果意义非凡,为后续深入开展癌症疫苗研究提供了有力支持,有望帮助更多癌症患者实现长期无进展生存!
▲截图源自“Medical press”
《癌症免疫治疗杂志》重磅:癌症疫苗成功阻击早期肿瘤进展,实现长期控制
近日,《癌症免疫治疗杂志》发表了一项极具突破性的研究。研究团队构建了遗传性肝癌自发转化小鼠模型,该模型的肝细胞携带致癌基因TAG,其患癌风险近乎100%。令人瞩目的是,研究发现,在恰当的时间进行单次免疫接种,便可以为其提供终身保护,这一发现十分引人注目。早期病变的小鼠体内存在肿瘤特异性T细胞群,通过接种疫苗能够对其进行有效治疗;而晚期肿瘤小鼠体内则不再保留这些细胞。这一发现揭示了肿瘤免疫编辑过程中存在关键的治疗窗口期,基于精准时间节点的疫苗干预,能够有效阻断肿瘤的发展。
▲截图源自“BMJ”
进一步研究显示,早期病变小鼠体内持续存在一种表型为TCF1+PD1+TOX-的肿瘤特异性CD8+T细胞(TST)祖细胞群。该细胞群不仅具备自我更新能力,还能分泌IFNγ。疫苗接种能够显著扩增这类前体细胞,并促使其分化为效应细胞,从而形成长期的免疫监视机制。与之形成鲜明对比的是,晚期肿瘤小鼠的TST细胞呈现出TCF1lo/-PD1+TOX+的耗竭表型,几乎完全丧失了抗肿瘤功能。
此次研究采用了单核细胞增生李斯特菌载体疫苗(LM-TAG),这种疫苗经过基因工程改造,可表达肿瘤相关抗原表位。前期临床试验已证实,它能够诱导强效的CD4+/CD8+T细胞反应。实验数据表明,接受LMTAG免疫的小鼠展现出显著的生存优势,所有小鼠均未出现肿瘤(详见下图)。相反,未接受治疗(Φ)以及接受单剂量空LM(LMΦ,LM是一种革兰氏阳性细胞内细菌,可诱导强烈的CD4和CD8T细胞反应)的小鼠,在实验终点时出现了多个大型肝脏肿瘤,肝脏重量也明显增加(详见下图)。
▼Kaplan-Meier曲线显示每组的生存率
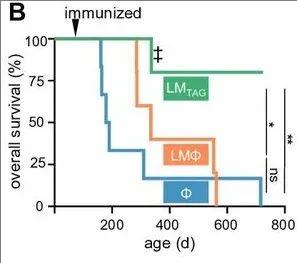
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
研究还表明,当免疫检查点阻断(ICB)疗法无效时,采用癌症疫苗进行早期治疗,能够有效阻止肿瘤进展。ICB疗法虽然是晚期癌症患者的重要治疗手段,但只有一小部分特定类型癌症患者能够从中实现病情的持久缓解。正如研究者所言:ICB的作用机制是解除T细胞的“刹车”,但如果T细胞从未被正确激活,就如同汽车没有汽油,ICB便无法发挥作用。而疫苗接种则可以促进T细胞进入功能状态,相当于为免疫系统提供精准导航和持续动力,进而消灭早期癌细胞。
与同种型对照抗体(iso)相比,接种表达减毒TAG表位的单核细胞增生李斯特菌(LMTAG)、接受LMTAG/ICB治疗的小鼠,在400天的观察期内均未出现肿瘤进展迹象。而单独使用ICB治疗则未见任何益处,所有小鼠都出现了大的肝肿瘤(详见下图)。
▼Kaplan-Meier曲线显示每组的生存率
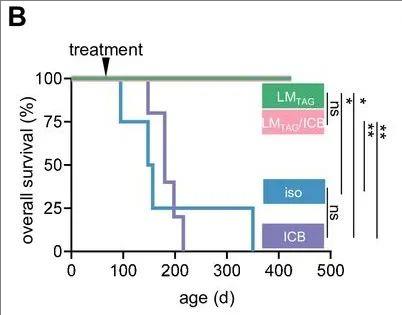
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上所述,该研究首次从分子层面阐明了三个关键要点:其一,TCF1+TST祖细胞群的存在是疫苗起效的必要条件;其二,肿瘤进展伴随着T细胞功能谱系的不可逆转变;其三,早期免疫干预可重塑肿瘤微环境,实现“癌症化”过程的免疫重编程。
这些发现为临床转化带来了重要启示:对于具有明确遗传风险或癌前病变的患者,预防性疫苗接种或许会成为最具成本效益的干预策略;而对于晚期患者,开发联合治疗方案以重建T细胞功能则至关重要。
研究团队特别强调,虽然该疫苗在晚期患者中的疗效有限,在高风险人群的癌症预防以及术后防复发等方面展现出独特价值。目前,研究者正在优化疫苗载体系统,并计划开展针对遗传性癌症综合征患者的Ⅰ期临床试验,有望为癌症防治领域带来新的突破。
颠覆传统抗癌模式,癌症疫苗有望成为攻克癌症的"终极密钥"
恶性肿瘤是威胁人类生命的首要疾病,据统计,2020年全球新增癌症病例约达1930万例,这一数字凸显了攻克癌症的紧迫性。传统的癌症治疗手段,如手术、放疗和化疗等,存在明显弊端。这些方法不仅毒性较大,对患者身体造成严重负担,而且适用范围有限,难以满足多样化的临床需求。因此,开发更为高效、安全的癌症治疗方法,成为当下医学领域亟待解决的关键问题。
当前研究表明,癌症的发展进程与“癌症免疫编辑”密切相关。免疫系统与癌细胞之间存在着动态的相互作用,它既能识别突变的致癌基因,从而消灭新生的癌细胞;也可能营造出有利于肿瘤细胞增殖的免疫抑制微环境。由此可见,癌细胞的发展态势取决于免疫系统内部的微妙平衡。
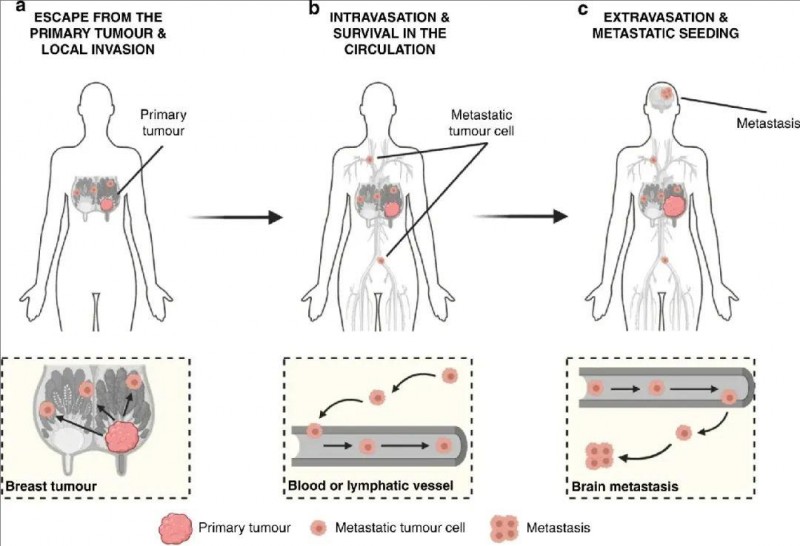
近年来,免疫疗法成为癌症治疗领域的研究热点。其中,癌症疫苗凭借其增强抗原特异性免疫反应的能力备受关注,成为一种极具潜力的癌症治疗手段。肿瘤疫苗在体内的作用机制如下:肿瘤抗原以多种形式进入人体后,会被特化的抗原呈递细胞(APC)吞噬,进而在细胞内表达并得到高效加工。树突状细胞的主要组织相容性复合体(MHC)将处理后的抗原呈递到细胞表面,MHC复合体与T细胞表面的T细胞受体(TCR)结合,激活抗原特异性T细胞。这些被激活的T细胞能够安全、持久且特异性地破坏肿瘤细胞,从而有效抑制肿瘤生长(详见下图)。
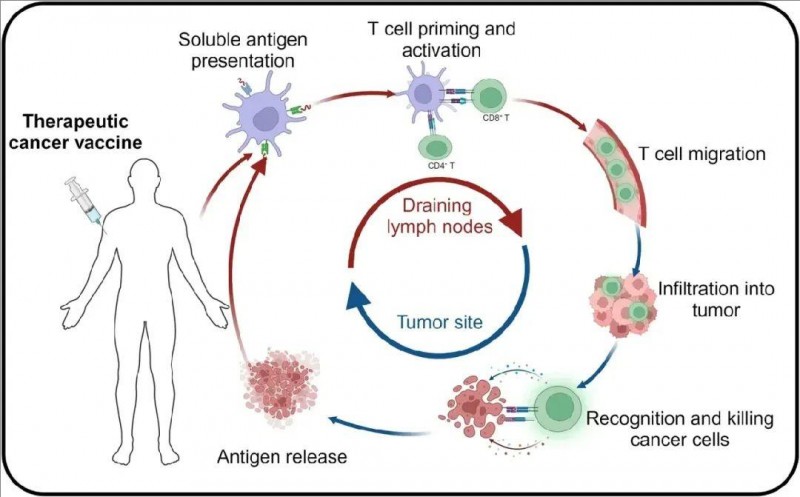
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
新抗原疫苗助EGFR突变的非小细胞肺癌患者,达完全缓解
非小细胞肺癌(NSCLC)约占所有肺癌病例的85%,通常在晚期才被诊断出来,因此预后不良,采用已获批准的标准治疗后5年生存率仅为15%–20%。尽管几乎所有患者最初都对EGFRi有反应,但由于获得性耐药,大多数患者在1-2年内会出现疾病复发。而个性化癌症疫苗的出现,为这类患者带来了新的希望。
近期,一项应用个性化NeoAg肽疫苗接种(PPV),治疗之前接受过多种标准疗法(包括EGFRi)治疗的晚期非小细胞肺癌(NSCLC)患者的I期临床试验结果引起了广泛关注。本次研究共纳入24例24名III/IV期非小细胞肺癌(NSCLC)患者,平均每个肿瘤检测到6.1个编码突变(范围:1-20),这些患者之前曾接受过多种常规疗法,包括手术、放疗、化疗和酪氨酸激酶抑制剂(TKI)后,出现病情进展,遂入组接受个性化NeoAg肽疫苗接种(PPV)。中位随访时间为7.1个月(范围:1.2-23.9个月),结果显示如下:
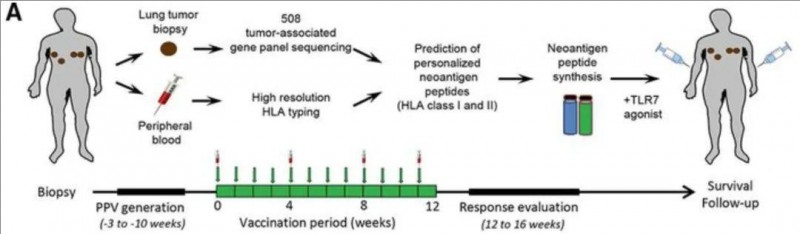
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
1、客观反应:在接受免疫接种的24名患者中,根据实体肿瘤疗效评价标准(RECIST)V.1.1标准,有7例患者出现客观临床反应,包括6例部分缓解(PR)、1例完全缓解(CR)。其中,在第1组的8名EGFR-WT患者中,PPV后CT扫描显示4名患者病情稳定(SD)。在第2组的7名患者中3名观察到了客观临床反应,其中2名患者达到PR(患者11和14)、1名患者达到完全缓解(CR)(患者17),治疗后活检显示没有残留存活的肿瘤细胞(详见下图)。据悉,这是首次报道一种新抗原肽疫苗,可在多名癌症患者中诱导客观临床反应。
值得一提的是,1例癌症疫苗治疗后,达到完全缓解(CR)的患者(17号患者),治疗后CT扫描显示:两个肺病变消退(详见图A)。通过T2加权MRI评估的患者17的骨转移在开始新抗原疫苗接种后18周消失(黄色箭头)。根据RECIST(V.1,骨病变可测量性),该骨转移被视为非靶向病变(详见图B)。
▼患者17的CT(图A)、T2加权MRI(图C)对比
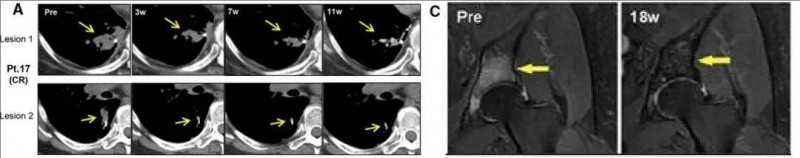
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:图A的CT扫描显示:两个肺病变消退
此外,第2组中的另外两名患者对PPV有客观的临床反应。患者11在开始PPV24周后出现肺肿瘤消退,阻塞性肺不张也消退(黄色箭头和红色圆圈),而气胸没有变化(绿色箭头)。患者14的皮下颈部转移在开始PPV治疗后12周出现显著消退(黄色箭头)。
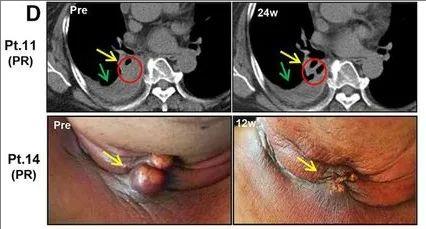
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
最后,在第3组中,3例患者(患者5、8、12和22),在接受PPV治疗后均出现部分临床反应,CT扫描显示这些患者的肺肿瘤消退。
▼这些患者在接受PPV治疗后均出现部分临床反应
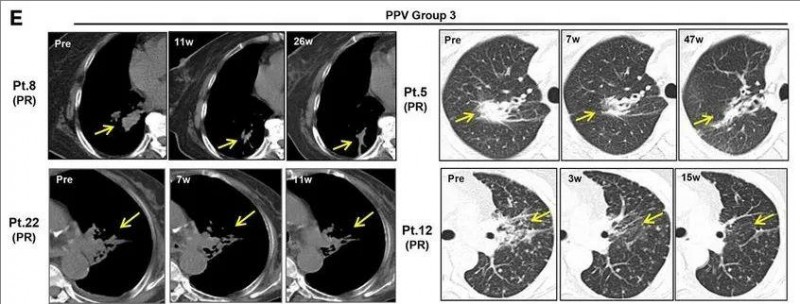
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、中位无进展生存期(PFS):24名接种疫苗的患者的中位无进展生存期(PFS)为6.0个月(详见下图)。其中,第1、2和3组患者的无进展生存期(PFS)分别为3.7、4.2、13.8个月。
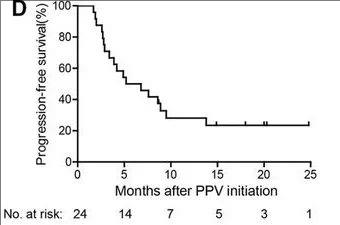
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、中位总生存期(OS):24名接种疫苗患者的中位总生存期(OS)为8.9个月。其中,第1、2和3组患者的总生存期(OS)分别为6.0、7.6、13.8个月。
4、安全性可控:除了3名患者出现短暂性皮疹、疲劳和/或发烧外,未观察到其他与治疗相关的不良事件。
总之,上述研究显示,PPV是可行的、安全的,并且可能在携带共同和免疫原性EGFR突变的NSCLC患者亚群中诱导肿瘤消退,即使在先前EGFRi失败的情况下也是如此。
新抗原mRNA疫苗cevumeran凭实力出圈,横扫直肠癌、肾癌、乳腺癌、肺癌、尿路上皮癌等多癌种,最长存活超3年
自基因cevumeran(BNT122、RO7198457)是一款极具创新性的个体化新抗原mRNA疫苗,它能够编码20余种特异性新抗原。该疗法的独特之处在于,依据从每位患者肿瘤组织中获取的肿瘤特异性体细胞突变数据进行针对性设计,以此刺激机体产生针对多达20种新抗原的T细胞反应,最终达到降低肿瘤复发风险、延长患者生存时间的治疗目的。该疫苗治疗晚期实体瘤的1期GO39733临床研究(NCT03289962),近期终于公布了!
此次研究共纳入213例局部晚期、转移性或复发性且无法治愈的恶性实体瘤患者,涵盖乳腺癌、黑色素瘤、肾细胞癌、尿路上皮癌、非小细胞肺癌、直肠癌等多种癌症类型。所有入组患者均在接受至少一种现有标准疗法后,病情依然出现进展。这些患者被分为两组接受治疗,一组接受自基因cevumeran疫苗单药治疗(n=30),另一组则接受自基因cevumeran疫苗+阿替利珠单抗联合治疗(n=183)。在试验过程中,自体基因cevumeran的剂量采用标准的3+3设计逐步递增,在1a期从25μg递增至100μg,1b期则从25μg递增至50μg。
研究结果显示,在检查点抑制剂(CPI)初治的患者群体中,各癌种扩展队列的客观缓解率(ORR)如下:黑色素瘤(n=9)的ORR为33.3%,肾细胞癌(RCC,n=12)的ORR为33.3%,尿路上皮癌(UC;n=11)的ORR为18.2%,非小细胞肺癌(NSCLC,n=10)的ORR为10.0%。此外,在剂量递增队列中,部分患者展现出持久的临床获益:在50µg自体基因cevumeran单药治疗队列里,一位胃癌患者的最佳总体反应(BOR)达到完全缓解(CR);在38µg组合队列中,一位乳腺癌患者和一位直肠癌患者分别达到部分缓解(PR)和完全缓解(CR)(详见下图)。
▼自基因cevumeran单药治疗对靶病变的影响
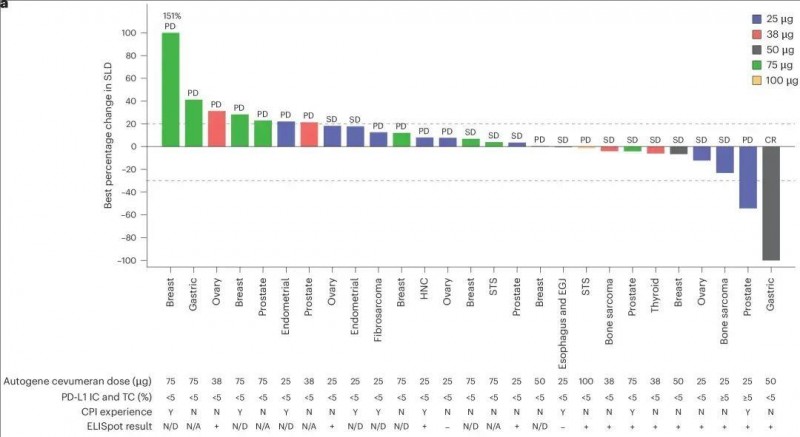
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
▼自基因cevumeran+阿替利珠单抗联合治疗对靶病变的影响
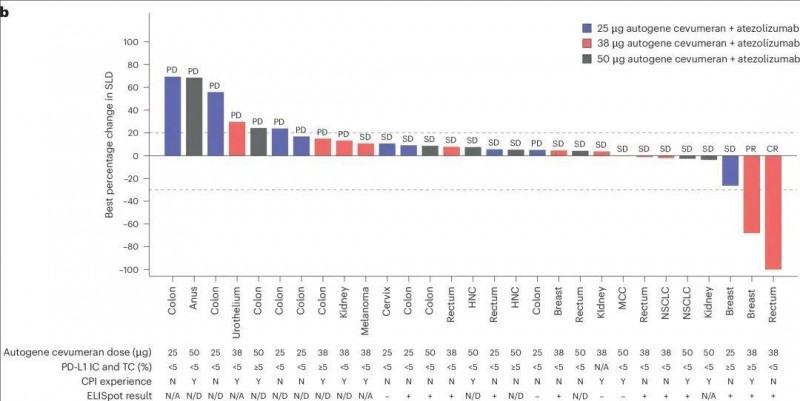
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
特别值得关注的是21号患者,其患有微卫星稳定且PD-L1低表达的直肠癌,在接受两线治疗后,肺部存在1.1cm的靶病灶和非靶病灶。令人惊叹的是,该患者在接受9剂38µg的阿替利珠单抗联合治疗后,奇迹般地实现了完全缓解(CR),且缓解持续时间长达8.2个月。截至临床数据统计时,该患者已存活超过3年(40.7个月)(详见下图)。
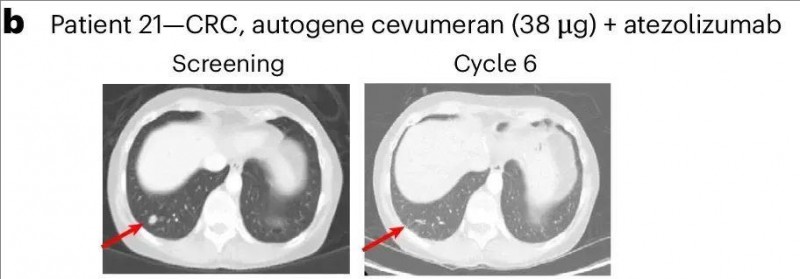
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
另一例肾癌患者(患者38),入组前已接受包括纳武单抗在内的4种全身治疗,研究初期病情出现进展,后续却达到了部分缓解(PR)。该患者胸膜靶病变的最长直径总和(基线肿瘤)(SLD)原本为108mm,癌症疫苗治疗13个月后缩小至10mm(详见下图),肿瘤竟显著缩小近10倍!
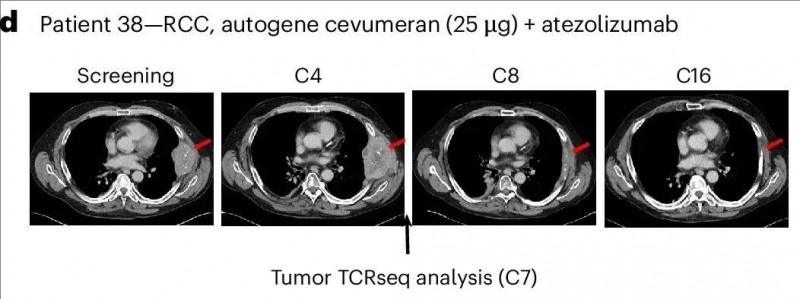
▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
DCVax-L树突状细胞疫苗暴击新诊断和复发性脑胶质瘤,5年生存率翻倍,死亡风险降42%
“DCVax-L疫苗”,全称“自体肿瘤裂解物负载树突状细胞疫苗”,由美国NorthwestBiotherapeutics生物科技公司精心研发。这款疫苗的独特之处在于,它利用患者自身的肿瘤标本,制造出专门针对脑胶质瘤的树突状细胞疫苗,在提升新诊断和复发性脑胶质瘤患者的长期存活率方面,展现出显著效果。如今这款疫苗持续长达15年的Ⅲ期临床研究(NCT00045968)结果,终于收获了令人满意的成果,其显著延长脑胶质瘤患者生存期的疗效,给无数深受脑瘤折磨的患者带来了新的曙光。值得一提的是,这是近20年来首个针对全身性治疗开展的Ⅲ期研究,具有里程碑式的意义。
本次研究共入组331例患者,其中包括 232 例新诊断的脑胶质瘤(nGBM)患者、64例复发性脑胶质瘤(rGBM)患者,这些患者的中位年龄为56(范围:19-73)岁,所有患者在入组前均接受了手术切除、白细胞去除术、为期6周的术后标准治疗(SOC)放化疗。结果显示如下:
1、对于新诊断的脑胶质瘤(nGBM)患者:中位总生存期(OS)19.3个月(DCVax-L组)vs 对照组16.5个月(详见下图)。4年的总生存(OS)率分别为15.7%(DCVax-L组)vs 9.9%(对照组);5年的总生存(OS)率则为13.0%(DCVax-L组) vs 5.7%(对照组)。这意味着,相较于安慰剂组而言,DCVax-L组的5年生存率翻了一倍多!
▼新诊断胶质母细胞瘤患者的总生存期
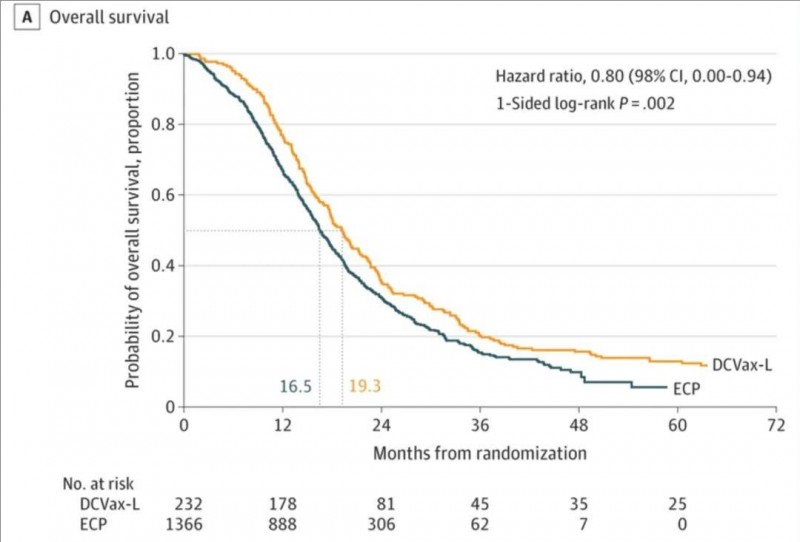
▲图源“JAMA Network”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、对于复发性脑胶质瘤(rGBM)患者:中位总生存期(OS)分别为13.2个月(DCVax-L组) vs 7.8个月(对照组)。这意味着,首次复发时接受DCVax-L治疗的患者,其死亡风险降低了42%(详见下图)。此外,复发后2年的总生存率为20.7%(DCVax-L组) vs 9.6%(对照组);复发后30个月的总生存率则为11.1%(DCVax-L组)vs 5.1%(对照组)。这意味着,随时间推移,存活率持续升高。
▼复发性胶质母细胞瘤患者的总生存期
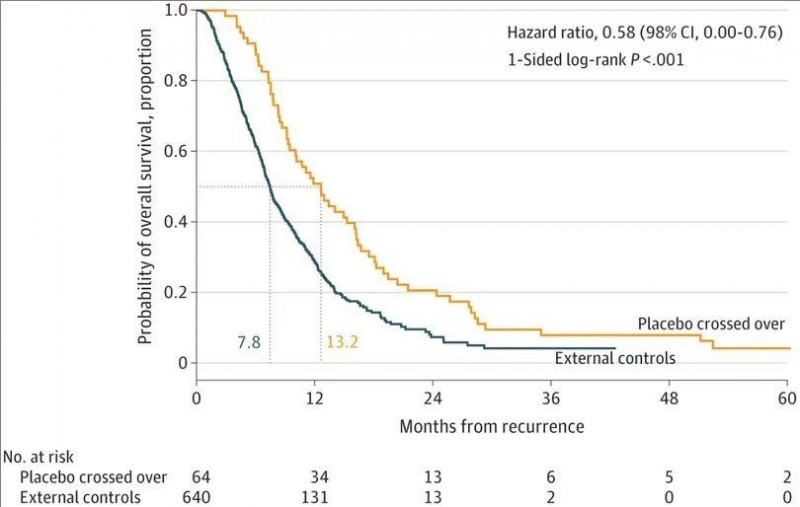
▲图源“JAMA Network”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
癌症作为一种高度突变的复杂疾病,很难仅靠单一治疗手段,达到理想的治疗效果。目前比较理想的治疗手段是在权威医院(手术、放化疗等)传统治疗的基础上,结合患者病情、个体情况,突变靶点、经济状况等,辅助靶向药、免疫细胞治疗(如CAR-T、TCR-T、TIL细胞疗法、癌症疫苗)、质子治疗、电场疗法等新型治疗手段,以达到巩固传统治疗效果、降低肿瘤复发风险、提高患者生存质量、延长生存期等目的。
其中,癌症疫苗历经数十年的发展,逐渐从基础研究转向了临床研究阶段,近年来更是取得了突破性进展。NHS国家癌症临床主任Peter Johnson教授曾说过:“我们知道,即使手术成功,癌症有时也会复发。这可能与体内仍残留少量癌细胞有关,但使用针对这些残留癌细胞的癌症疫苗,或许可以阻止这种情况的发生”。小编也希望终有一天能实现“打一针治疗癌症”的美好愿景!好消息是,我国现阶段正在进行多款癌症疫苗的临床研究,对此感兴趣的病友,可将治疗经历、近期病理及影像学检查结果,提交至医学部,进行初步评估。
参考资料
[1]Román C R D,et al.Vaccination generates functional progenitor tumor-specific CD8 T cells and long-term tumor control[J]. Journal for Immunotherapy of Cancer, 2024, 12(10): e009129.
https://jitc.bmj.com/content/12/10/e009129
[2]Fan T,et al.Therapeutic cancer vaccines: advancements, challenges, and prospects[J]. Signal Transduction and Targeted Therapy, 2023, 8(1): 450.
https://www.nature.com/articles/s41392-023-01674-3
[3]Li F,et al.Neoantigen vaccination induces clinical and immunologic responses in non-small cell lung cancer patients harboring EGFR mutations[J]. Journal for immunotherapy of cancer, 2021, 9(7).
https://jitc.bmj.com/content/9/7/e002531
[4]Lopez J,et al.Autogene cevumeran with or without atezolizumab in advanced solid tumors: a phase 1 trial[J]. Nature Medicine, 2025: 1-13.
https://www.nature.com/articles/s41591-024-03334-7
[5]Liau L M,et al. Association of autologous tumor lysate-loaded dendritic cell vaccination with extension of survival among patients with newly diagnosed and recurrent glioblastoma: a phase 3 prospective externally controlled cohort trial[J]. JAMA oncology, 2023, 9(1): 112-121.
https://jamanetwork.com/journals/jamaoncology/fullarticle/2798847
[6]https://medicalxpress.com/news/2024-10-cancer-vaccine-blocks-tumor-early.html
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

【BTK抑制剂】新一代靶向药奥布替尼终于
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

从轮椅到独立行走:硼中子俘获疗法以67%
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
刚刚!首个国产PD-1单抗,获批晚期黑色
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
癌症复发的"头号凶手"
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

停药4年仍无癌!TIL细胞联合伊匹单抗,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

《CAR-T三人行》第十五期|魏双教授:
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




