喜报|我国第五款CAR-T产品-泽沃基奥仑赛震撼上市!现可惠及多款血液肿瘤
我国第五款CAR-T细胞疗法(泽沃基奥仑赛/赛恺泽/CT053/zevor-cel/Zevorcabtagene Autoleucel)获批上市,我们一起来看看这些上市的CAR-T细胞产品
2024年3月1日,血液肿瘤患者又迎来了一个振奋人心的好消息,国家药品监督管理局正式下达通知,批准科济药业研发的泽沃基奥仑赛注射液的新药上市申请(“NDA”),用于治疗复发或难治性多发性骨髓瘤(批准日期为2024年2月23日)。
值得一提的是,泽沃基奥仑赛是国内上市的第五款CAR-T细胞产品,同时也是第二款靶向BCMA的CAR-T产品!
关于泽沃基奥仑赛

▲图源“NMPA官网”
泽沃基奥仑赛(赛恺泽®,Zevorcabtagene Autoleucel,zevor-cel,产品编号CT053),是一种自体BCMA靶向的CAR-T细胞产品,它是通过慢病毒转导T细胞产生的。慢病毒编码的CAR包括全人源BCMA特异性单链可变片段(scFv)、CD8α跨膜结构域、人CD8α铰链结构域、CD3ζ激活结构域、4-1 BB协同刺激结构域,具有较高的结合亲和力和稳定性。
该产品主要用于治疗既往经过至少3线治疗(至少使用过1种蛋白酶体抑制剂及免疫调节剂)后,病情进展的复发或难治性多发性骨髓瘤成年患者。
泽沃基奥仑赛于2019年获得美国FDA的再生医学先进疗法(RMAT)及孤儿药产品称号,同年还获得了欧洲药品管理局(EMA)的优先药物(PRIME)称号,并于2020年获得中国药品监督管理局(NMPA)的突破性治疗药物品种。
泽沃基奥仑赛:多发性骨髓瘤克星,ORR达100%
泽沃基奥仑赛本次获得NMPA批准上市,主要是基于一项在中国进行的开放标签、多中心Ⅰ/Ⅱ期临床试验(LUMMICAR STUDY 1,NCT03975907)结果。
自2019年7月23日开始,共有14例患有复发或难治性多发性骨髓瘤(R/R MM)的患者入组,中位年龄为54岁,ECOG评分为0或1,且之前接受过至少3种治疗方案,包括至少1种免疫调节药物和蛋白酶体抑制剂。入组后,这些患者在淋巴细胞清除开始后5~7天,接受泽沃基奥仑赛注射液(zevor-cel)单次输注治疗。经过为期37.7个月的中位随访,截至2023年7月17日,结果如下:
1、总缓解率(ORR):总缓解率(ORR)达100%(14/14),其中11例患者(78.6%)达到完全缓解(CR)或严格完全缓解(sCR);3例患者(21.4%)获得了部分缓解(PR)。
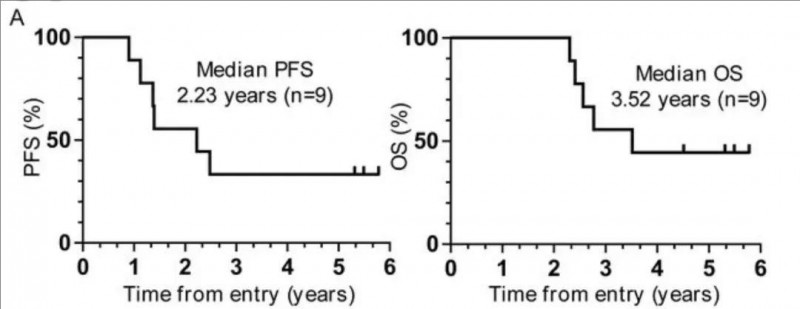
2、无进展生存期(PFS):所有患者的中位无进展生存期(PFS)为25.0个月(14.9,不可评估[NE]),sCR/CR患者的中位PFS为26.9个月(15.5,NE)(图1A)。

▲图源“ScienceDirect”
3、中位缓解持续时间(DOR):所有患者的中位缓解持续时间为24.1个月(14.0,NE),sCR/CR患者的中位缓解持续时间为26.0个月(14.6,NE)(图1B)。
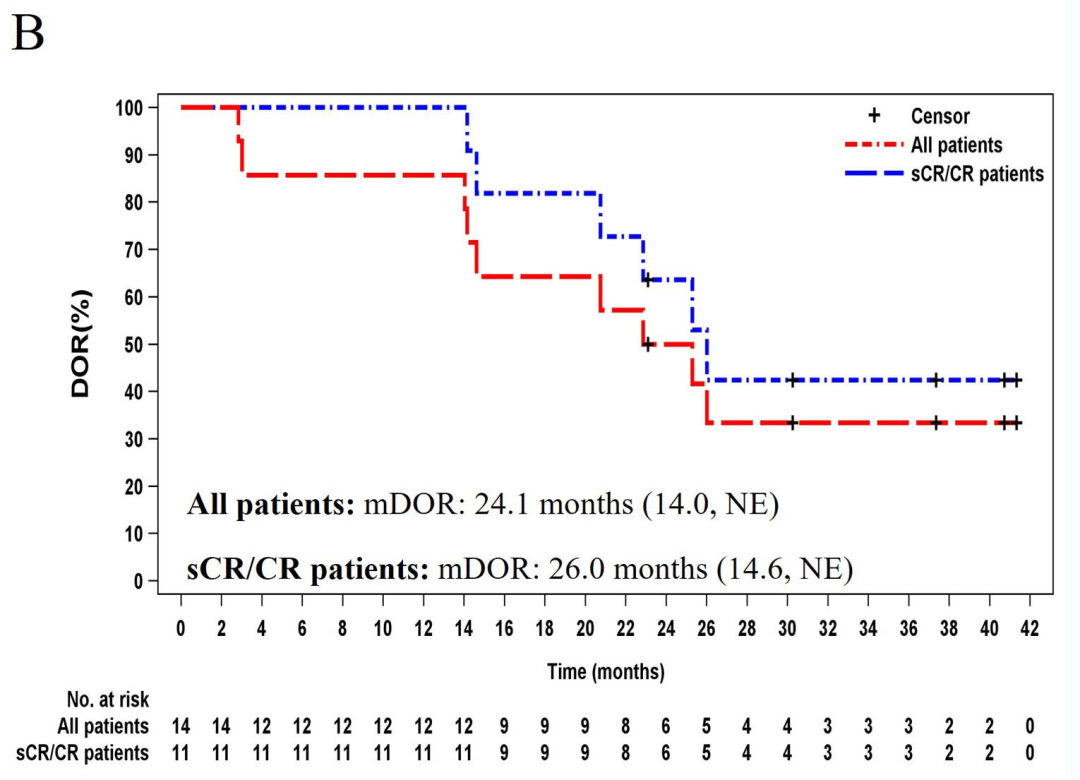
▲图源“ScienceDirect”
总之,经过大量预处理的复发或难治性多发性骨髓瘤(R/R MM)患者,接受单次zevor-cel输注治疗后,经过为期3年左右的随访发现,zevor-cel表现出了良好的安全性,而且保持了深度和持久的反应。
如何寻求CAR-T疗法帮助
目前急招T细胞淋巴瘤、B细胞淋巴瘤、非霍奇金淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、肝癌、胃癌、结直肠癌、胰腺癌、卵巢癌、间皮瘤等癌种!
想要寻求CAR-T疗法帮助的患者,可将治疗经历、出院小结、近期病理报告等资料汇总后,提交至医学部,进行初步评估。
国内已上市的另外四款CAR-T疗法,在血液肿瘤领域大放异彩

▲图源“NMPA官网”
在泽沃基奥仑赛获批前,我国已有四款CAR-T细胞产品顺利在国内获批上市,即复星凯特的阿基仑赛注射液、驯鹿生物的伊基奥仑赛注射液、药明巨诺的瑞基奥仑赛注射液、合源生物的纳基奥仑赛注射液,主要用于治疗大B细胞淋巴瘤、多发性骨髓瘤、B细胞急性淋巴细胞白血病等。
(一)阿基仑赛注射液
由复星凯特生物研发的阿基仑赛注射液(又称阿基仑赛,奕凯达®,Axicabtagene Ciloleucel Injection,FKC876),是一种靶向CD19的CAR-T细胞产品,于2021年6月22日获中国国家药监局(NMPA)批准上市,用于治疗复发或难治性大B细胞淋巴瘤成人患者。它是全球第6款获批上市的CAR-T疗法,同时也是中国首个获批上市的CAR-T疗法!
近期发布的一项多中心真实世界研究数据显示,阿基仑赛对中国复发难治性非霍奇金淋巴瘤患者的真实世界疗效与全球一致,12个月总生存率高达84.3%,最佳总缓解率达83.2%,最佳完全缓解率为58.4%,且安全性更高。
(二)瑞基奥仑赛注射液
由药明巨诺研发的瑞基奥仑赛注射液(倍诺达®,relma-cel,Relmacabtagene Autoleucel Injection),是一款靶向CD19的CAR-T细胞产品,于2021年9月1日获中国国家药监局(NMPA)批准上市,用于治疗经二线或以上系统治疗失败的成人复发或难治性大B细胞淋巴瘤(r/r LBCL)。瑞基奥仑赛是中国第二款获批的CAR-T产品,同时也是我国首款1类生物制品的CAR-T产品。
2020年美国血液学会(ASH)年会上,公布了瑞基奥仑赛的惊艳数据,在58例可评估有效性的复发或难治性大B细胞淋巴瘤中,3个月的客观缓解率(ORR)达58.6%,完全缓解率(CR)为51.7%,6个月的中位总生存期(OS)率为90.8%;6个月缓解持续时间(DOR)达60%;6个月的无进展生存率(PFS)达54.2%。
总体而言,瑞基奥仑赛注射液无论在安全性和临床疗法方面,均表现十分优秀!
(三)伊基奥仑赛注射液
由驯鹿生物和信达生物合作研发的伊基奥仑赛注射液(福可苏®,Equecabtagene Autoleucel Injection),是一种针对B细胞成熟抗原(BCMA)的CAR-T细胞疗法,于2023年6月30日获国家药品监督管理局(NMPA)批准上市,用于治疗复发/难治性多发性骨髓瘤(R/R MM)。这是中国首款获批的BCMA CAR-T疗法,同时也是全球首款全人源靶向BCMA CAR-T疗法!
一项在国内14个临床研究中心进行的关于“伊基奥仑赛注射液治疗R/R MM”的1/2期临床研究(FUMANBA-1),共纳入103例R/R MM患者,这些患者既往至少接受过3线及以上治疗(包括以免疫调节剂及蛋白酶体抑制剂为基础的化疗方案)且病情进展。入组接受伊基奥仑赛注射液回输治疗后,经过为期13.8个月的中位随访,结果显示:
在疗效可评估的101例受试者中,总体缓解率(ORR)达96.0%(97/101)。其中91.1%(92/101)的患者达到非常好的部分缓解及以上(≥VGPR),严格意义的完全缓解/完全缓解率(sCR/CR)达74.3%(75/101)。12个月的中位无进展生存期(PFS)率为78.8%(95% CI: 68.6–85.97)。
总之,伊基奥仑赛注射液展现出持久且持续加深的有效性。
(四)纳基奥仑赛注射液
由合源生物研发的纳基奥仑赛注射液(源瑞达®,CNCT19细胞注射液,Inaticabtagene Autoleucel Injection),是中国首款治疗白血病的CAR-T细胞产品,其新药上市申请(NDA)于2023年11月8日获国家药监局(NMPA)批准,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL),国内定价为99.9万元/支。
本次获批是基于第64届美国血液学年会(ASH)上,公布的一项关键性临床研究(NCT04684147)结果。本次入组的39例成人r/r B-ALL患者中,74.3%(29例)的患者既往接受过2线以上抗B-ALL标准治疗,17.9%(7例)的患者既往接受过造血干细胞移植。入组接受纳基奥仑赛回输治疗后,结果显示:
1、总体缓解率(ORR):治疗3个月内的总体缓解率(ORR)达82.1%,治疗3个月时的ORR为64.1%。
2、CR(完全缓解)率:在治疗3个月内获得ORR的32例患者中,CR率达66.7%(26/39);在治疗3个月时获得ORR的25例患者中,CR率达51.3%(20/39)。
3、微小残留病灶(MRD)阴性率:在治疗≤3个月,达“完全缓解”患者的MRD阴性率为92.0%;达“完全缓解但计数不完全恢复”(CR/CRi)的患者,其MRD阴性率为100%。

▲纳基奥仑赛有效性数据总结
国外上市的CAR-T疗法,剑指多款血液肿瘤
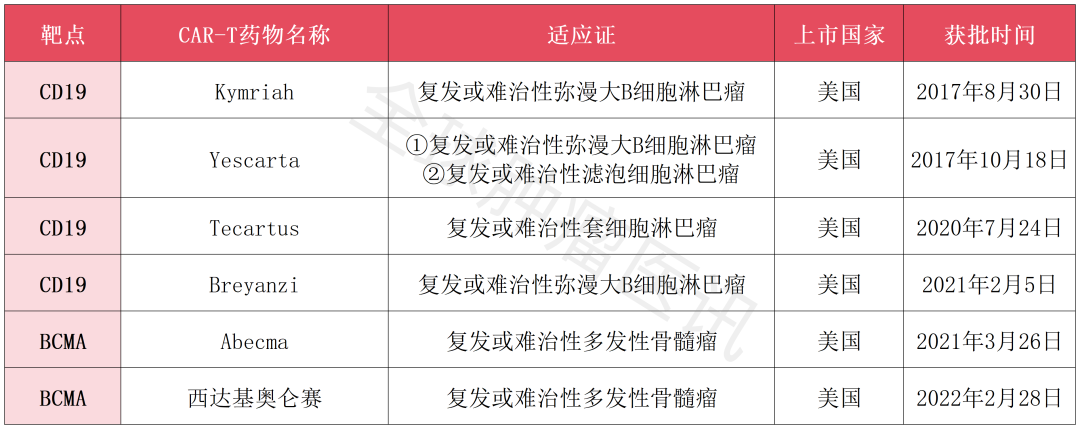
Kymriah
Kymriah(Tisagenlecleucel,Tisa-cel),为全球首款获批上市的CAR-T产品,用于治疗复发或难治性(R/R)弥漫大B细胞淋巴瘤(B-ALL)。
一项关于“Kymriah治疗R/R B-ALL”的临床研究结果显示,经过为期4.8年的中位随访,>60%的患者获得完全缓解(CR),总生存期(OS)达到10.5个月。
Yescarta
Yescarta(Axicabtagene ciloleucel,Axi-cel)是一款靶向CD19的CAR-T细胞产品,获美国FDA批准用于治疗复发或难治性(R/R)弥漫大B细胞淋巴瘤/滤泡细胞淋巴瘤。
这一批准是基于一项单臂、Ⅱ期临床研究(ZUMA-5)结果,结果显示,91%的R/R滤泡性淋巴瘤患者对Yescarta产生应答。其中在治疗18个月时,74%的患者处于持续缓解。
Tecartus
Tecartus(Brexucabtagene autoleucel,KTE-X19)是唯一获得FDA批准治疗成人复发或难治性(R/R)套细胞淋巴瘤(MCL)的CA19 CAR-T细胞疗法。
一项2期多中心研究(ZUMA-3)结果显示,Tecartus在97%的应答患者中,显示出显著的长期CR率(高达71%),中位OS超18个月,且未检测到微小残留病灶。
Breyanzi
Breyanzi(Lisocabtagene maraleucel)是一款针对CD19的转基因自体CAR-T细胞疗法,于2021年2月5日获FDA批准上市,用于治疗成人复发或难治性弥漫大B细胞淋巴瘤(LBCL)。
Abecma
Abecma(Idecabtagene vicleucel,Ide-Cel),为全球首款获批上市的BCMA CAR-T细胞疗法,在治疗复发或难治性多发性骨髓瘤方面,整体缓解率高达71%,完全缓解率达39%。
西达基奥仑赛
西达基奥仑赛(Carvykti,Cilta-Cel)是强生旗下强生创新制药和传奇生物合作研发的一种靶向BCMA的CAR-T细胞疗法。于2022年2月28日获批在美国上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM),它也是首款获得FDA批准的国产CAR-T疗法!
本次获批是基于CARTITUDE-1的临床研究结果,在入组的97例既往至少接受过三线治疗的R/R MM成年患者中,经西达基奥仑赛治疗后,结果显示,98%的患者对对治疗有反应,其中78%的患者其血液或骨髓中为出现癌症迹象,反应中位持续时间长达22个月!
小编寄语
多发性骨髓瘤是一种难治性的恶性浆细胞疾病,约占所有血液肿瘤的10%。据Frost and Sullivan统计,我国2023年多发性骨髓瘤的患病人数约为15.3万人,新发病例数为2.32万人。而且对于复发或难治性多发性骨髓瘤患者而言,传统的治疗选项较少,患者通常预后较差,随着泽沃基奥仑赛等新兴CAR-T疗法的获批,也为这部分患者带来了新的希望!
目前我国还有多款CAR-T产品处于蓄势待发的状态,据丁香园Insight数据库统计,国内共有24家企业布局CAR-T疗法,包括传奇生物、复星凯特、科济生物、驯鹿医疗、药明巨诺、信达生物、西比曼生物等。涉及领域除了多发性骨髓瘤外,还针对弥漫大B细胞淋巴瘤、套细胞淋巴瘤、B细胞急性淋巴细胞白血病等多款血液肿瘤。近年来学者们更是将研发方向对准各种实体瘤,小编也期望随着越来越多的靶点相继开发,未来会有更多的CAR-T产品获批,以造福更多的患者!
目前我国有多款CAR-T细胞疗法正在招募患者,感兴趣的癌友们可以联系医学部,了解详细的入排标准,或进行初步评估!
参考资料
[1]Fu C,et al. Three-Year Follow-up on Efficacy and Safety Results from Phase 1 Lummicar Study 1 of Zevorcabtagene Autoleucel in Chinese Patients with Relapsed or Refractory Multiple Myeloma[J]. Blood,2023, 142(Supplement 1): 4845-4845.
https://www.sciencedirect.com/science/article/abs/pii/S0006497123114467
[2]https://mp.weixin.qq.com/s/nQhw-rye0kDo88CwDt93rg
[3]https://www.nmpa.gov.cn/
[4]http://www.juventas.cn/news.php?id=624
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




