4周肿瘤消失!CAR-T横扫骨髓瘤、胃癌、胆道癌、肺癌等,柳叶刀认证一次注射长效控癌
柳叶刀:CAR-T细胞疗法一次注射长效控癌,4周肿瘤消失,横扫骨髓瘤、胃癌、胆道癌、肺癌等
一次注射即可在患者体内持久发挥抗癌功效——这个曾被视为天方夜谭的设想,正被CAR-T细胞疗法以震撼人心的方式照进现实!作为改写癌症治疗史的革命性的免疫技术,CAR-T疗法持续刷新医学认知。而今,中国科研力量更以雷霆之势刷新全球认知!
2025年4月11日,我国自主研发的抗GPRC5DCAR-T细胞疗法以2期临床试验的卓越数据荣登《柳叶刀》。研究数据显示,该疗法针对多发性骨髓瘤的总缓解率高达84%,其中35%的患者实现完全缓解或更高疗效。这不仅是中国原研抗癌技术的高光时刻,更是无数家庭重燃生命之火的曙光,为癌症精准治疗开启了崭新篇章!

▲截图源自“The Lancet”
BCMA CAR-T耐药后"生命接力"!中国原研抗GPRC5D CAR-T疗法为复发骨髓瘤患者点燃"二次抗癌曙光",总缓解率高达84%
对于经抗BCMA嵌合抗原受体(CAR)T细胞疗法治疗后病情进展的多发性骨髓瘤患者,如何选择挽救性治疗方案仍是临床难题。近期研究显示,靶向GPRC5D的CAR-T细胞疗法或为破局关键。
《柳叶刀》刊发的这项研究,是在徐州医科大学附属医院进行的,2021年12月1日-2024年5月1日期间,共纳入37例经抗BCMA CAR-T细胞治疗后病情进展的复发/难治性多发性骨髓瘤患者(中位年龄59岁,IQR:51-65),入组后接受单剂量静脉注射抗GPRC5D CAR-T细胞治疗。中位随访为12.6个月(IQR:8.2-20.8)。
结果显示;总缓解率达84%(95%CI:68-94),其中35%(13例)患者实现完全缓解(CR)及以上疗效(详见下图)。

▲图源“The Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
总之,上述研究证实,抗GPRC5D CAR-T细胞挽救疗法展现出极高缓解率,为经BCMACAR-T治疗后进展的患者开辟了新路径。尽管短期疗效亮眼,其长期安全性与有效性仍需更大样本、更长随访验证,期待更多研究接力解锁癌症治疗新可能。
"细胞杀手"进化史:五大创新技术助CAR-T细胞,突破实体瘤防线
CAR-T细胞疗法全称“嵌合抗原受体T细胞疗法”,堪称免疫系统的“细胞杀手”。它从患者体内提取T细胞,经实验室基因改造后,为其装配能精准识别癌细胞表面特异性抗原的“导航系统”。回输体内的CAR-T细胞如同训练有素的精锐部队,在血液中巡逻、锁定并歼灭目标癌细胞,同时最大限度减少对正常组织的损伤,甚至能在癌细胞复发时重启攻击模式。
▼CAR-T细胞(蓝色)正在攻击癌细胞(粉色)
▲图源“MSK”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
然而,实体瘤一直是CAR-T疗法的“拦路虎”——肿瘤周围复杂的细胞与分子屏障,如同堡垒外的护城河,往往导致T细胞尚未深入肿瘤核心就已耗尽能量。近年来,中外科研团队突破瓶颈,在实体瘤治疗领域取得突破性进展,核心策略包括:
1、局部精准投送:将CAR-T细胞直接注入病变部位,缩短抵达肿瘤的“路径”。
2、辐射开路:利用低剂量放疗削弱肿瘤屏障,助力T细胞穿透。
3、诱饵战术:通过基因工程赋予CAR-T细胞“诱饵受体”,诱骗癌细胞耗尽自身免疫抑制能力。
4、以毒攻毒:改造CAR-T细胞携带c-KIT基因突变,借助肿瘤微环境的“武器”增强杀伤力,在间皮瘤、肺癌等动物模型中展现显著优势。
5、微型药房策略:研发SEAKER(合成酶武装杀伤细胞),使CAR-T细胞兼具靶向识别与原位释放抗癌药物的双重功能,实现对含有癌症标志物的肿瘤细胞及其周边未表达该标志物癌细胞的“双杀”。
▼CAR-T治疗实体瘤的靶点
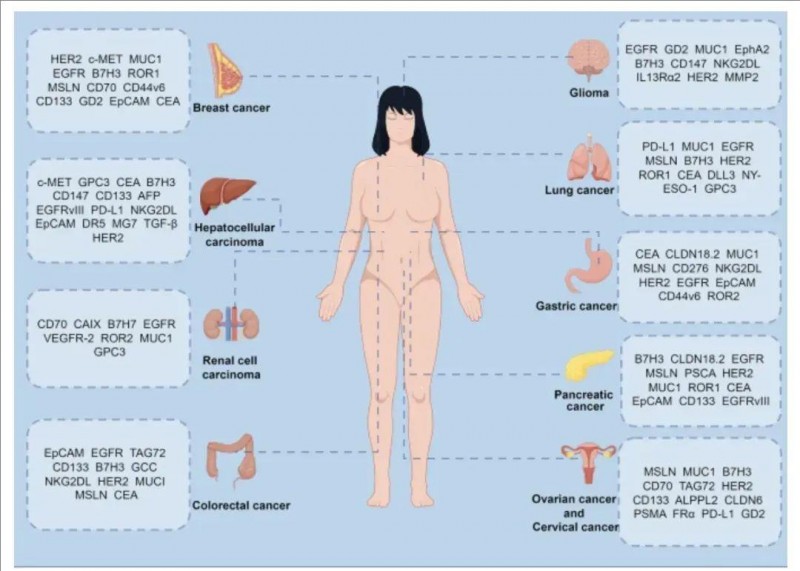
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
做了基因检测的病友可以拿出报告看看,一旦存在上述突变,可联系医学部,初步评估是否有机会接受国内外抗癌新药/新技术的帮助,看不懂检测报告的病友,也可致电医学部详细解读报告。
全球首款Claudin18.2 CAR-T细胞疗法CT041横空出世,胃癌客观缓解率高达60%,一例晚期转移患者4周实现完全缓解
Claudin18.2(CLDN18.2)是一种在多种上皮肿瘤中高表达的膜蛋白,尤其在60%的胃/胃食管结合部癌和胰腺癌中呈现高表达,成为极具潜力的癌症治疗靶点。基于此,中国研发了首款针对Claudin18.2(CLDN18.2)的CAR-T细胞疗法——CT041,成为全球首个且唯一获得中美双报临床试验许可(IND)的CLDN18.2 CAR-T细胞疗法,正为消化系统肿瘤治疗带来突破性进展。
2022年美国临床肿瘤学会(ASCO)大会,公布了CT041针对CLDN18.2阳性实体瘤的Ⅰ期临床数据。研究共纳入14例经多线治疗失败的CLDN18.2阳性肿瘤患者,包括5例胃/胃食管交界癌、9例胰腺癌患者,既往均接受过3线治疗方案,但效果不佳,遂入组接受CT041治疗。
结果显示:在胃/胃食管交界癌亚组疗效亮眼,治疗后客观缓解率(ORR)高达60%,其中,80%的患者病情稳定(SD),肿瘤不同程度的缩小;另有1例患者更是幸运地获得完全缓解(CR)。
值得一提的是,一位62岁晚期胃腺癌,且伴肺转移的女性患者,在接受CT041治疗仅4周后,肺部1个靶病灶完全消失,另外2个病灶显著缩小(详见下图),展现出CAR-T细胞疗法对转移性肿瘤的快速清除能力。
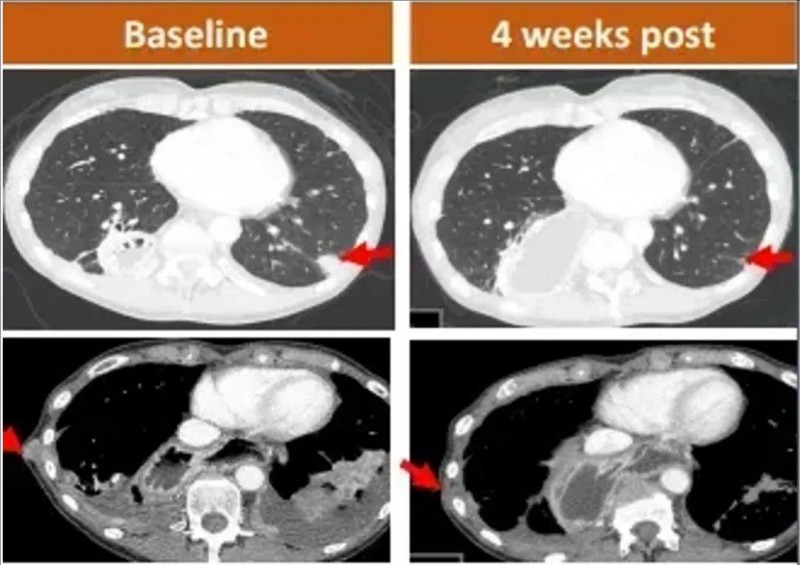
间皮素靶向CAR-T疗法横扫肺癌、乳腺癌、恶性胸膜间皮瘤,中位总生存超17个月
恶性胸膜疾病(包括转移性肺癌、乳腺癌、恶性胸膜间皮瘤)是一类侵袭性实体肿瘤,现有治疗反应不佳。其中,恶性胸膜间皮瘤(MPM)以高度耐药和短生存期为特征——一线化疗中位总生存期(OS)仅13-16个月,联合抗血管药物虽可延长至18.8个月,但毒性显著增加。更棘手的是,其最常见亚型(上皮样)因肿瘤突变负荷(TMB)低、PD-L1表达近乎缺失,导致免疫单药疗效受限。鉴于肺癌和乳腺癌的高发性,临床迫切需要新的突破性治疗方案。
加之近年研究发现,间皮素在恶性胸膜间皮瘤(MPM)及多种实体瘤中高表达(与肿瘤侵袭、转移直接相关),且正常组织低表达的特性,研究团队开发了胸膜腔内注射的间皮素靶向CAR-T细胞疗法,并联合帕博利珠单抗开展首个人体I期临床试验。
本次研究共入组27例恶性胸膜疾病患者,包括1例转移性肺癌患者、1例转移性乳腺癌患者、25例恶性胸膜间皮瘤(MPM)患者,既往均接受过≥1线治疗(中位2线,33%患者≥3线治疗),中位随访时间为20.3个月(19.2-26.1个月)。
结果显示:CAR-T细胞输注后,Kaplan-Meier评估的中位总生存期(OS)达17.7个月(95%CI:13.2-NE),1年总生存(OS)率高达74%(95%CI,58%-94%,详见下图B),显著优于传统疗法。
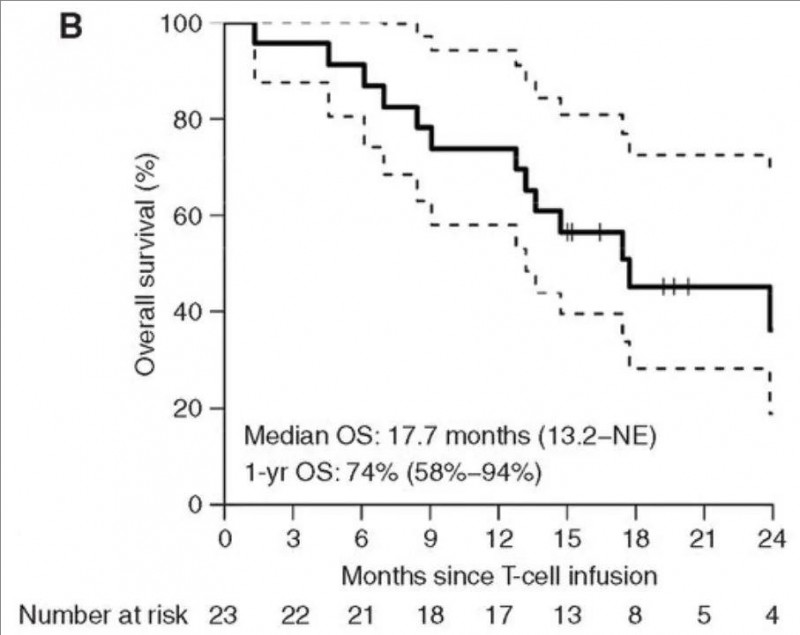
▲图源“Cancer discovery”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
部分患者的深度应答尤为值得关注,其临床表现为疗法效果提供了有力佐证。
其中一位72岁的恶性胸膜间皮瘤(MPM)单次胸膜内输注CAR-T细胞后,PET/CT显示靶病灶缩小40%(mRECIST)(详见下图D),完全代谢缓解持续16个月,期间无需其他治疗,体重及血清标志物(SMRP)保持稳定(详见下图E)。32周活检证实肿瘤细胞减少,PCR检测到CAR-T细胞持续存在(详见下图G)。
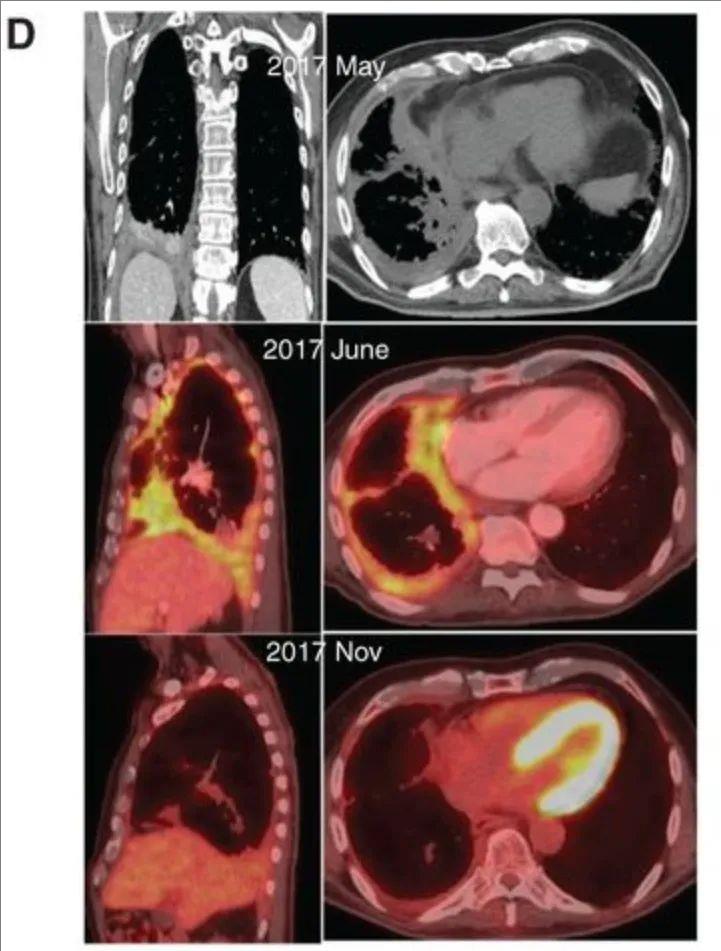
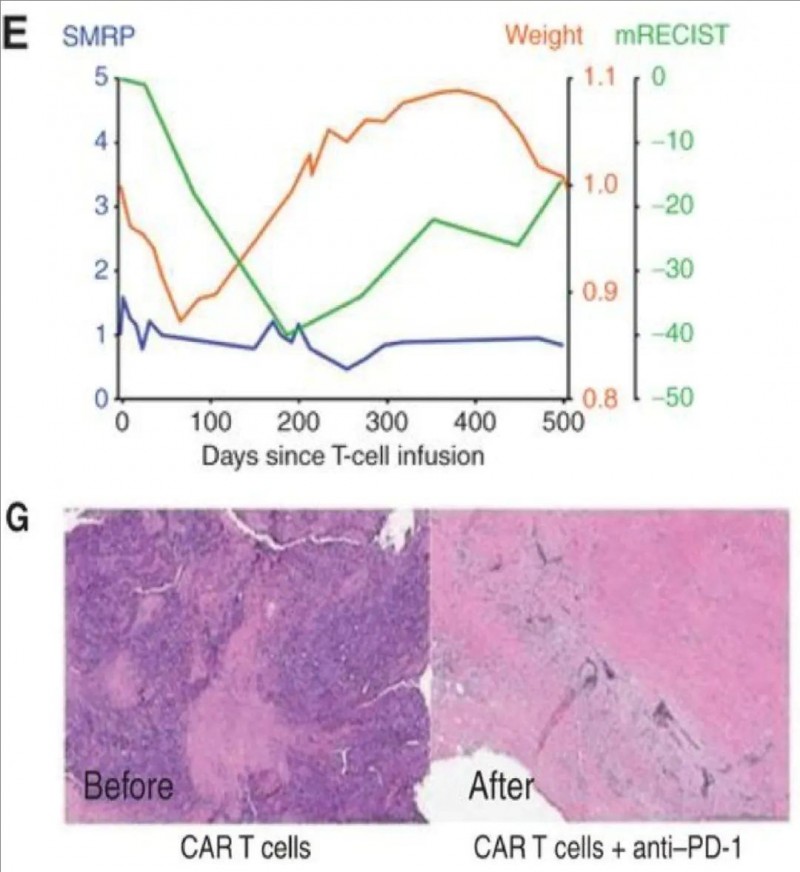
▲图源“Cancer discovery”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
另一位76岁的上皮样恶性胸膜间皮瘤(MPM)患者,CAR-T单药治疗4周后,靶病灶缩小28%,联合帕博利珠单抗3个月后缩小至78%(详见下图A),PET扫描显示代谢完全缓解并维持26个月,患者功能状态良好,体重和血清SMRP值稳定。此外,外周血持续检测到CAR-T细胞及新抗原特异性IgG应答,显示持久免疫记忆,且不需要任何其他治疗。
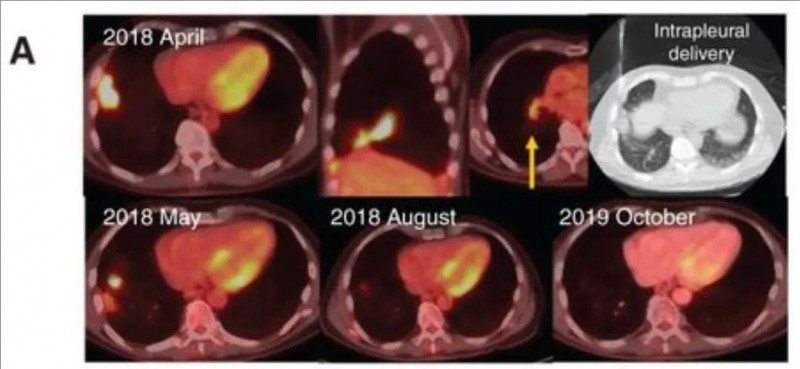
▲图源“Cancer discovery”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
最后一位66岁的上皮样恶性胸膜间皮瘤(MPM)经环磷酰胺预处理及CAR-T细胞输注后,121天启动帕博利珠单抗治疗,3个月内靶病灶按mRECIST标准缩小50%(详见下图H),且外周血重新检测到CAR-T细胞,提示免疫检查点抑制剂激活其二次应答(详见下图I)。
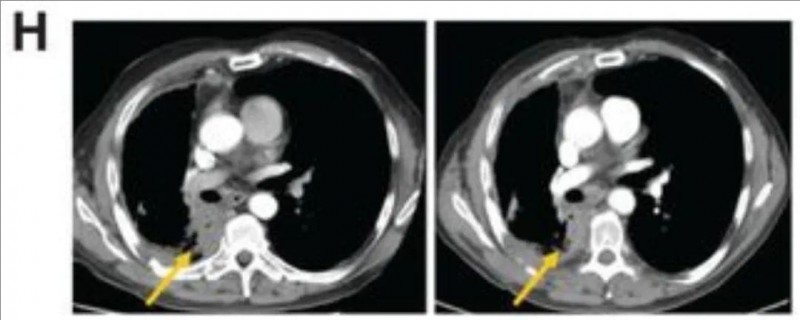
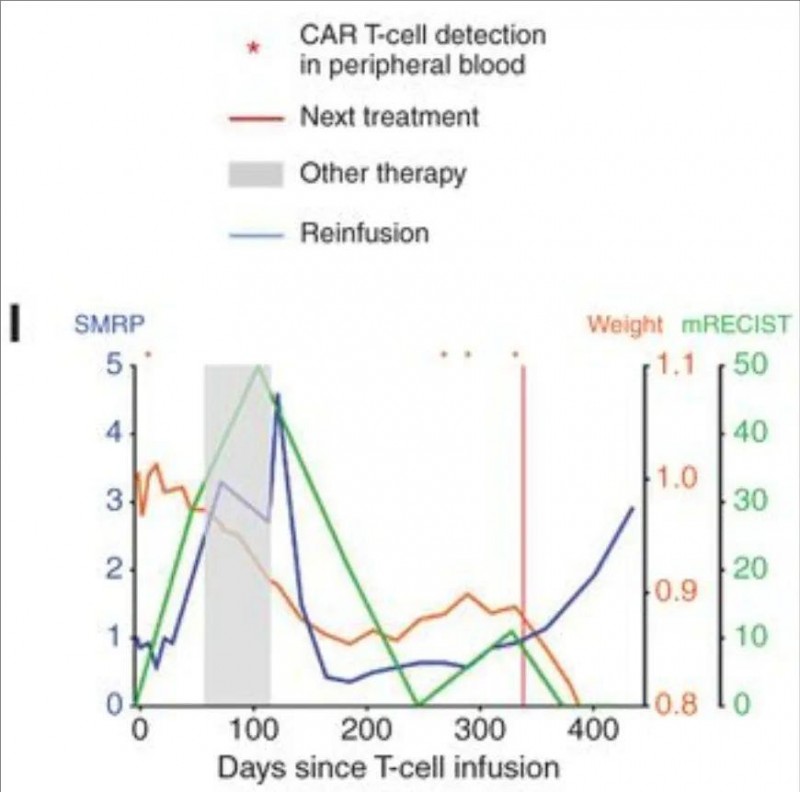
▲图源“Cancer discovery”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,区域性间皮素靶向CAR-T联合帕博利珠单抗疗法在恶性胸膜疾病中展现出安全可控、持久抗肿瘤活性,尤其为多线耐药患者提供了新希望,有望推动实体瘤CAR-T治疗迈向精准化新阶段!
CART-EGFR细胞在晚期胆道癌中展现持久缓解,1例患者奇迹般达完全缓解,无进展生存超22个月
胆道癌(BTC)是一类高度侵袭性的异质性肿瘤,包括胆囊癌(GBCA)、肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)、远端胆管癌(dCCA)。尽管根治性手术是唯一潜在治愈手段,但超90%患者因确诊时已属晚期而失去手术机会,中位总生存期(OS)仅6-8个月。对于不可切除或转移性患者,吉西他滨联合铂类化疗为一线标准方案,然而仅21%-34.5%患者对该方案敏感,较低的总体缓解率(ORR)和生存获益迫切需要更有效的治疗策略。
EGFR作为受体酪氨酸激酶,在胆管癌中呈现高表达特征——几乎所有肝内胆管癌(iCCA)、50%肝外胆管癌(eCCA)、38%胆囊癌(GBCA)均存在EGFR过表达,使其成为晚期胆道癌(BTC)的理想治疗靶点。
近期,《临床癌症研究》报道了一项“应用EGFR特异性嵌合抗原受体工程自体T细胞(CART-EGFR)免疫疗法,治疗EGFR阳性胆道癌(BTC)”的临床试验(NCT01869166)。
本次研究共入组19例中位年龄为57岁(范围:39-70岁)的EGFR阳性晚期不可切除/复发转移性胆道癌(BTC)患者,包括14例胆管癌,5名患有胆管癌胆管癌(GBCA)。入组后,在接受均接受白蛋白结合型紫杉醇联合环磷酰胺预处理后,给予自体CART-EGFR细胞输注(1-3个周期)。
结果显示:在17例可评估患者中,1例奇迹般达到完全缓解(CR),10例达到病情稳定(SD)(详见下图A),中位无进展生存期(PFS)为4个月(范围:2.5~22个月)(详见下图C)。
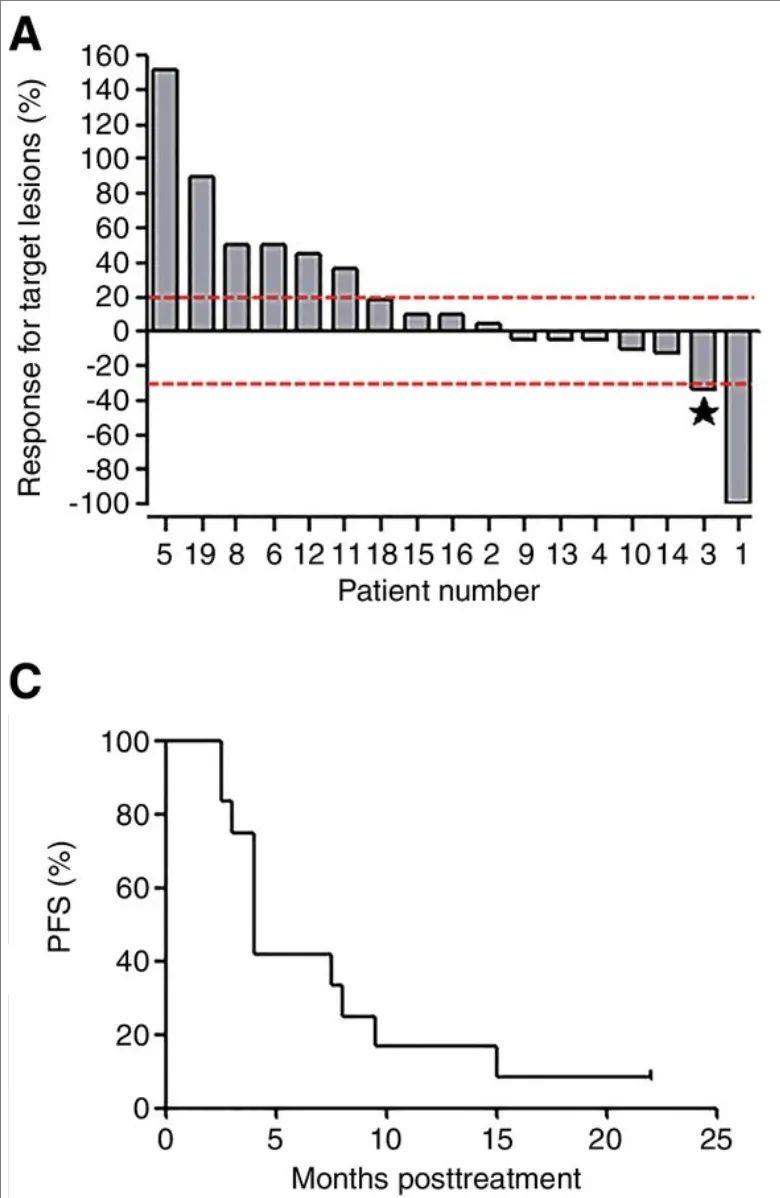
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,其中1例伴腹膜后淋巴结转移的晚期远端胆管癌(dCCA)患者,治疗3个月后经CT/PET-CT评估,原发肿瘤及转移淋巴结的异常代谢活性完全消失(详见下图),奇迹般达到完全缓解(CR)状态。截至论文发表,其中位无进展生存(PFS)已持续超过22个月,且缓解仍在持续。
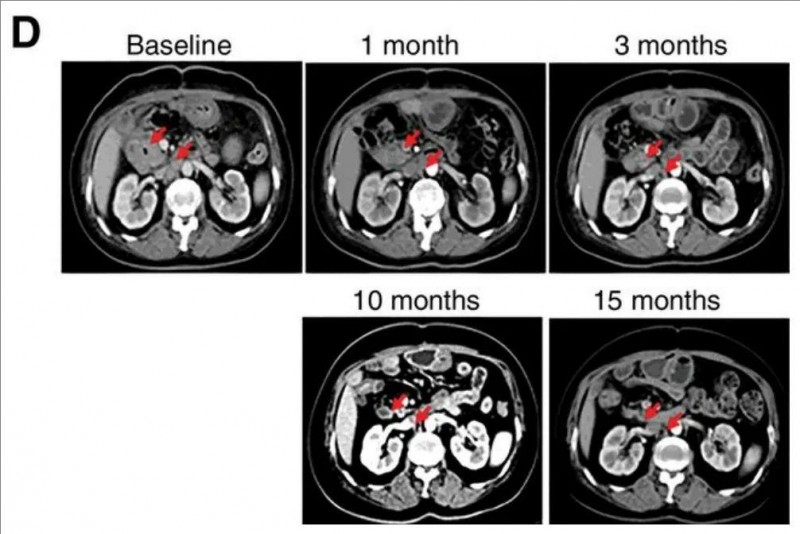
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
CAR-T细胞疗法经过数十年的发展,已成为肿瘤治疗领域的新兴支柱,作为肿瘤免疫细胞疗法中的佼佼者,在治疗血液肿瘤方面的成绩有目共睹。如今CAR-T技术也已发展到了第五代,国内外相继有13款产品获批上市。CAR-T疗法的出现打破了传统的肿瘤治疗模式,肿瘤免疫疗法也成为了继手术、放化疗后的第四类肿瘤治疗方法。
好消息是,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,想明确自身靶点或寻求CAR-T等新型疗法帮助的患者,可将完整的病理报告、治疗经历等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Xia J,et al.Anti-GPRC5D CAR T-cell therapy as a salvage treatment in patients with progressive multiple myeloma after anti-BCMA CAR T-cell therapy: a single-centre, single-arm, phase 2 trial[J]. The Lancet Haematology, 2025.
https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(25)00048-1/abstract
[2]Adusumilli P S,et al.A phase I trial of regional mesothelin-targeted CAR T-cell therapy in patients with malignant pleural disease, in combination with the anti–PD-1 agent pembrolizumab[J]. Cancer discovery, 2021, 11(11): 2748-2763.
https://aacrjournals.org/cancerdiscovery/article/11/11/2748/666400/A-Phase-I-Trial-of-Regional-Mesothelin-Targeted
[3]Guo Y,et al.Phase I study of chimeric antigen receptor–modified T cells in patients with EGFR-positive advanced biliary tract cancers[J]. Clinical Cancer Research, 2018, 24(6): 1277-1286.
https://aacrjournals.org/clincancerres/article/24/6/1277/476/Phase-I-Study-of-Chimeric-Antigen-Receptor
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




