TCR-T疗法异军突起!挑战难治性实体瘤的"领头羊"对中晚期肝癌下手了!
TCR-T细胞免疫疗法,TCR-T细胞免疫治疗实体瘤异军突起,TCR-T临床试验招募进行中
讲到免疫治疗大家普遍会想到的都是PD-1/PD-L1疗法,其实还有细胞免疫疗法,尽管这方面的研究进展稍稍逊色,但近两年来,众多细胞免疫疗法纷纷崛起,发展迅猛,无疑掀起了一场癌症治疗的热潮。
而细胞免疫疗法中的T细胞免疫疗法可谓是炙手可热的一块领域,之前无癌家园往期的文章经常提及的是CAR-T细胞疗法(嵌合抗原受体T细胞免疫疗法)。
CAR-T细胞疗法是通过识别膜表面抗原(如CD19,BCMA等)而发挥作用,对血液肿瘤疗效显著,但一直在努力尝试突破实体瘤方面的瓶颈。而今天要讲的主角则是——TCR-T细胞疗法,即细胞受体基因工程改造的T细胞疗法。
瞄准实体瘤!TCR-T疗法赶超CAR-T疗法,未来可期
CAR-T 细胞和TCR-T细胞都属于经基因工程技术改造的T细胞。相较于CAR-T疗法,TCR-T疗法在实体瘤治疗领域具备独特优势。
TCR-T细胞疗法可识别细胞膜表面或细胞内来源的肿瘤特异性抗原,已从最开始的基础免疫研究走进临床应用,在实体瘤中显示出初步疗效,成为目前最有可能在实体瘤领域中取得突破的T细胞免疫疗法!
何谓TCR-T细胞疗法
TCR-T技术主要机制是向普通T细胞中引入新的基因,使得改造过的T细胞能够表达有效识别肿瘤细胞的TCR(T cell receptor,T细胞抗原受体),从而引导T细胞杀死肿瘤细胞。
说起TCR-T细胞疗法的起源,就要追溯到2002年,当时Rosenberg团队率先发现:从黑色素瘤中分离出的肿瘤浸润淋巴细胞(Tumor infiltrating lymphocyte,TIL)经体外扩增回输后,可以特异性杀伤肿瘤细胞。
但是在其他肿瘤中,TILs往往不易被获取且在体外扩增时间长,扩增后多为终末分化的T细胞,持续抗肿瘤效果相对较弱。在这样的情况下,便有了在正常外周血淋巴细胞(PBL)上导入已知的抗原特异性TCR基因进行治疗的不断探索。
2006年Rosenberg小组在《Science》上发表的一篇文章显示,经基因修饰的TCR-T细胞在黑色素瘤的治疗中显示了较好的应用前景。参与试验的17名患者中,有2人出现了抗肿瘤响应,该研究首次证明了基因改造TCR用于肿瘤治疗的可行性。
晚期肝癌迎来新曙光!TCR-T疗法让癌症患者完全缓解
早在2020年国际肝病大会(ILC)上,一款基于T细胞的肝癌新型TCR-T疗法ADP-A2AFP引起了不小的轰动,也让肝癌的新疗法有了新的突破。
ADP-A2AFP研究采用的是特有的TCR-T(T细胞受体-T细胞)技术平台SPEAR(特定肽增强亲和力受体)T细胞治疗技术。这是一项首次在人体内进行的开放性研究,采用改良的3+3设计,目标剂量逐渐增加:1亿(队列1),10亿(队列2)和12~60亿(队列3)转导SPEAR T细胞以评估安全性,包括剂量限制毒性(DLT)。
在纳入的患者中,有一名患者的癌细胞进程出现了完全缓解(CR)的表现,其余参与者的甲胎蛋白(AFP)也都出现了不同程度的下降,这意味着试验取得了进展,也说明该疗法针对晚期肝癌的治疗是有效果的。

参与的9例患者均接受过手术及常规放化疗,但出现失败或不耐受的现象。在接受最高剂量治疗的4例患者中,有1例患者获得完全缓解,CT扫描显示,患者体内所有病变都消失了,而且完全缓解后已持续半年以上无任何复发的状态!
其他患者(队列1、队列2)最佳反应是病情稳定。队列2中的1例患者在治疗1个月后原发病灶体积未缩小,但纵膈淋巴结转移灶体积明显缩小!

因此,靶向AFP(甲胎蛋白)的TCR-T疗法能够杀死表达AFP的肿瘤细胞,基于此项研究的积极结果,研究人员有望将最大剂量扩大至50亿个细胞治疗,我们期待这项研究更新的数据公开!
无癌家园TCR-T疗法招募
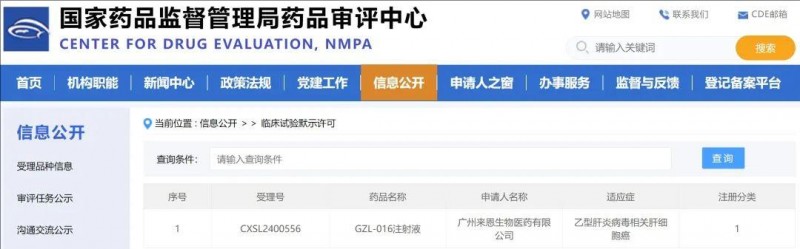
那么到底有没有机会尝试TCR-T疗法呢?小编这就带来了一个好消息,目前正有一项研发的TCR-T疗法在招募肝癌患者开展临床试验,想要参加的患者可以咨询无癌家园医学部(400-626-9916)了解详细入排标准。
【部分入选标准如下】
1、18周岁≤年龄≤70周岁,男女均可;
2、经病理组织学或者细胞学检查确诊的中晚期肝细胞癌(HCC)患者,不适合手术或局部治疗且既往曾接受至少一种规范系统性治疗后发生进展或不耐受(系统性治疗包括但不局限于全身用化疗、分子靶向、免疫检查点抑制剂等治疗),或无力承担标准治疗的患者;
基因型筛选须符合:HLA-A*02:01、02:02、02:03、02:04、02:07、02:09或02:16。
治疗滑膜肉瘤总缓解率达40%,TCR-T技术有望明年上市
在2021年ASCO大会上,美国MD安德森癌症中心公布了一项关于新型过继性T细胞的疗法治疗滑膜肉瘤/圆细胞脂肪肉瘤的II期研究数据,疗效十分亮眼!
在这项研究中,专门采用针对MAGE-A4癌症抗原的TCR-T技术 afamitresgene autoleucel(afami-cel,以前称为ADP-A2M4),在多种实体瘤类型,包括滑膜肉瘤、头部肿瘤、宫颈癌和肺癌中均获得了缓解,并且多名患者出现持久反应,这意味着这种新型的基于TCR的新兴技术是未来攻破实体瘤的新希望。
共纳入45例晚期转移性滑膜肉瘤/圆细胞脂肪肉瘤患者,均符合HLA-A2阳性且肿瘤表达MAGE-A4的条件。截至2021年2月4日,32例患者接受了afami-cel治疗。这些中位年龄为43岁的患者有87.5%患有滑膜肉瘤,且之前接受过3次全身治疗。
(注:其中HLA-A2是最常见的HLA-I类分子,在汉族中大约占50%,MAGE-A4则在滑膜肉瘤中则有52.9%的阳性率。)
在数据截止时,25例患者可评估初步疗效,其中23例滑膜肉瘤患者,2例粘液样/圆细胞脂肪肉瘤(MRCLS)患者,其余患者随访不足。
结果显示:在25名可评估患者中,afami-cel总缓解率为40%(10/25)。其中2例完全缓解(CR)、8例部分缓解(PR)、11例疾病稳定(SD)和4例疾病进展(PD),疾病控制率为84%(21/25)。10例应答者中有9例在数据截止时有持续应答!
这些初步数据表明afami-cel在大量预处理的患者中有效且耐受性良好。在广泛的 MAGE-A4 抗原水平上报告了客观反应,并观察到了深度反应,最初的耐用性数据令人鼓舞。
疾病控制率为71.1%,ADP-A2M4 T疗法治疗实体瘤著有成效
谈到ADP-A2M4疗法,其实早在2020年ASCO大会上,美国MD安德森癌症中心公布了一项关于新型过继性T细胞的疗法治疗实体瘤的I期研究数据,引起了不小的轰动!

ADP-A2M4的作用机制
何谓ADP-A2M4
ADP-A2M4是靶向MAGE-A4的T细胞疗法,通过SPEAR T细胞平台对T细胞进行工程设计,使其能够特异性地识别,并增强对癌细胞HLA(人类白细胞抗原)肽复合物的亲和力,从而提高T细胞识别癌细胞的敏感度并其增强摧毁癌症细胞的能力。
2019年12月,ADP-A2M4被美国药品监督管理局(FDA)授予医学先进疗法称号(RMAT),用于治疗滑膜肉瘤;这款疗法在2018年也被FDA授予孤儿药称号,用于治疗软组织肉瘤。值得一提的是,基于以上积极数据,该公司预计ADP-A2M4将于2022年在美国上市。
该研究共纳入了38例晚期实体瘤患者,既往中位治疗线数为3,主要包括18例滑膜肉瘤、9例卵巢癌、3例头颈鳞癌等。
结果显示,38例患者的客观缓解率(ORR)为23.7%,疾病控制率(DCR)为71.1%。其中,滑膜肉瘤的ORR为43.8%,非肉瘤的ORR为9.1%;头颈癌的ORR为33.3%,肺癌的ORR为50.0%。在不同的瘤种都观察到了疗效。

其中,本次试验可评估的16例滑膜肉瘤患者,客观缓解率(ORR)为43.8%(7名患者肿瘤缩小),疾病控制率为90%以上(14名患者响应)。

这些患者的中位反应持续时间为28周,中位无进展生存期为20周,中位总生存期(OS)未达到。

目前,靶向MAGE-A4的SPEAR T细胞疗法在开展全球多项临床试验,以评估进一步评估该疗法的疗效。
典型病例
一名67岁的老年男性,有4年的滑膜肉瘤患病史,心包复发,既往采用减瘤术和异环磷酰胺治疗,MAGE-A4高表达。输了9.95*109的TCT细胞产品。基线扫描显示很高的疾病负担155mm,疾病在心包和肝脏。输液后扫描,在第12周时,靶向的肿瘤病灶大程度减少了45%。骨髓异常综合征方面在一段时间后继续减少了71%,由于新的不明靶向的病灶的出现,在第24周时发生了疾病进展。

总缓解率达50%,E7 TCR-T疗法治疗上皮癌效果不俗
2020年ASCO大会上还公布了E7 TCR-T细胞疗法的I期研究初步结果。该研究纳入了人乳头瘤病毒(HPV)相关的上皮癌患者,入组后收集患者血液中T细胞,由于E7癌蛋白在这类患者高表达,因此通过携带E7 TCR基因的病毒载体对T细胞进行工程化后,再次回输进入患者体内。

E7 TCR-T细胞治疗过程
此实验纳入的均为多线经治的晚期患者,也是首个用于人体的E7 TCR-T疗法,纳入的都是多线经治的晚期患者。结果显示,在既往至少接受过三线治疗方案的12例上皮癌患者中(主要有头颈鳞癌和宫颈癌),部分缓解(PR)6例,另外4例达到了疾病稳定(SD)。在达到PR的大部分患者中,都有一个或多个肿瘤病灶的持续完全缓解。
对于经多线治疗的患者,客观缓解率(ORR)达到50%,可以说疗效非常显著。此外,在8例既往使用过PD-1/PD-L1免疫治疗的患者中,4例出现肿瘤缓解。

12例患者特征及疗效
【典型病例】
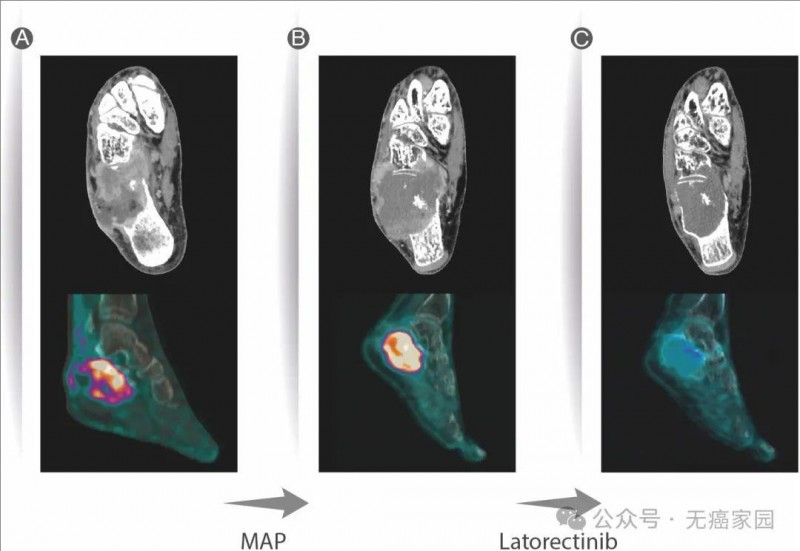
患者为一名49岁的老年女性,外阴癌。之前用过7次全身性化疗治疗。广泛的肺部、腹膜后、骨盆和大腿转移。经细胞产品治疗8个月后,大部分肿瘤缩小。

患者治疗前和治疗3个月后的PET-CT结果
小编有话说
近年来,科学家们已经做出了相当大的努力来开发新的方法攻克实体瘤的障碍,并采用优化策略用于针对这些特定适应症的CAR-T疗法,并且还在TCR-T疗法领域倾注更多的心血。我们期待着,越来越多的临床前/临床试验数据能够拼凑出一幅完整的拼图,充分展示T细胞免疫疗法治疗实体瘤的真正实力。
参考文献
https://meetinglibrary.asco.org/record/195713/abstract
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期前列腺癌术后五年生存率超99%,但是
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
重磅!"O+Y"双免
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
生死时速!DC疫苗为脑瘤患者抢下关键缓冲
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
双肺转移灶全部消失!治疗4个月肉瘤完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

实现肿瘤控制率100%!2025非小细
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【EGFR TKI药物】新一代靶向药TY
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




