生死时速!DC疫苗为脑瘤患者抢下关键缓冲期!还有CAR-T、硼中子、电场疗法等合力抗癌
胶质母细胞瘤新疗法新技术,DC疫苗、CAR-T、BNCT、TTFields全面围剿胶质母细胞瘤
胶质母细胞瘤作为最常见的恶性原发性脑肿瘤,即便采取最优治疗方案,患者预后仍不容乐观,中位总生存期(OS)仅约14-18个月(2-5)。其根源在于肿瘤细胞群具有高度异质性,因此,靶向多种抗原的治疗策略被视为降低肿瘤逃逸风险的关键。
而ICT-107是一种极具潜力的自体树突状细胞(DC)免疫疗法,可同时靶向肿瘤及癌症干细胞上的六种关键抗原——MAGE-1、AIM-2、HER2/neu、TRP-2、IL13Rα2和gp100。这一特性恰好匹配胶质母细胞瘤的异质性特征,为攻克肿瘤逃逸难题提供了新思路。
《临床癌症研究》公布的II期临床试验(NCT01280552)数据显示,ICT-107疗法应用于新诊断胶质母细胞瘤患者时展现显著潜力,为这类难治性患者带来了突破性希望!
ICT-107树突状细胞疫苗:为胶质母细胞瘤患者抢下2.2个月无进展"黄金期"
《临床癌症研究》报道的这项研究,共纳入124例新诊断胶质母细胞瘤患者,均为HLA-A1+和/或-A2+亚型,且术后残留肿瘤体积≤1cm³。患者中位年龄为59.2岁(范围22.9-81.8岁),将其随机分为两组:81例接受标准治疗联合ICT-107免疫疗法(试验组),43例接受标准治疗联合安慰剂(对照组)。
结果显示:试验完成时(67例事件),ICT-107组主要终点中位总生存期(OS)为17.0个月(CI:13.68-20.61),对照组为15.0个月(CI 12.33-23.05),差异无统计学意义(HR=0.87,P=0.58)。然而,ICT-107的次要终点中位无进展生存期(PFS)为11.2个月(CI:8.22-13.05),与对照组的9.0个月(CI:5.52-10.29)相比,有显著延长(HR=0.57;P =0.011;详见下图)。
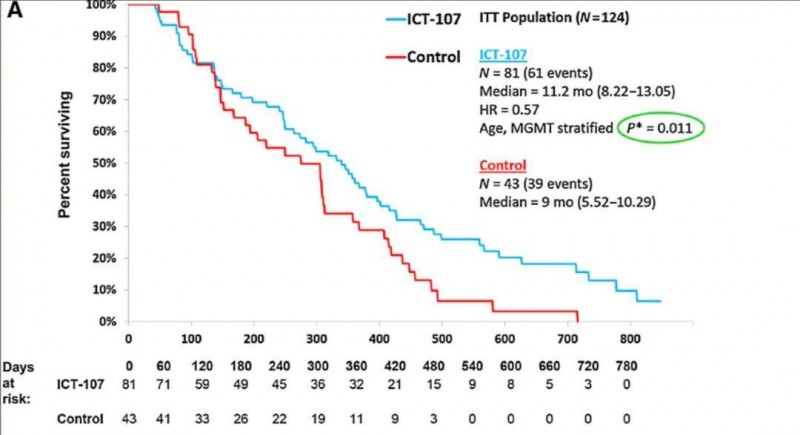
▲图源“Clin Cancer Res”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
中国患者如何寻求癌症疫苗帮助
树突状细胞疫苗正成为癌症患者的全新希望。目前,这一疗法已在日本、德国等国家用于临床,用于皮肤癌、肺癌、肾癌、乳腺癌等多种癌症的辅助治疗。令人振奋的是,我国也已开展针对癌症疫苗的临床研究,这也意味着国内患者同样有机会寻求这抗癌新技术的帮助!
对此感兴趣的病友,可将治疗经历、近期病理报告、影像学检查等资料,提交到医学部,详细评估病情。
CAR-T、电场疗法、硼中子俘获疗法三大抗癌"重器"齐发力,全面围剿胶质母细胞瘤
除了上文提到的DC细胞疫苗外,还有CAR-T 细胞疗法、肿瘤电场治疗(TTFields)、硼中子俘获疗法(BNCT)等“抗癌黑科技”,同样在胶质母细胞瘤的战场上大放异彩!
01、CAR-T细胞:为胶质母细胞瘤患者撕开生命新出口,肿瘤"腰斩式"缩小60%
CARv3-TEAM-E是一种靶向表皮生长因子受体变体Ⅲ(EGFRvIII)的CAR-T细胞疗法。其第二代CAR结构精准锁定EGFRvIII,同时分泌T细胞接合抗体分子(TEAM)靶向胶质母细胞瘤中表达的野生型EGFR,并能重定向调节性T细胞协同抗肿瘤。
《新英格兰医学杂志(NEJM)》刊发的Ⅰ期临床研究(由美国麻省总医院癌症中心联合神经外科开展),披露了CARv3-TEAM-E疗法治疗3例复发性胶质母细胞瘤的初步数据。令人振奋的是,所有患者在输注后2-5天内均出现肿瘤显著缩小!
以其中1例72岁的男性患者为例,该患者因阅读困难就诊,后确诊EGFRvIII阳性胶质母细胞瘤,虽历经开颅手术、放疗及替莫唑胺化疗,疾病仍在初诊20个月后出现进展,遂入组接受CARv3-TEAM-E治疗。
结果显示:该患者输注CARv3-TEAM-E第2天,MRI显示,肿瘤横截面积缩小18.5%;治疗第69天,肿瘤较基线(治疗前)骤减60.7%(详见下图)。且在无糖皮质激素或抗血管生成干预下,缓解持续超150天(近6个月)。此外,脑脊液液体活检证实,该患者肿瘤标志物EGFRvIII与EGFR水平同步下降。

▲图源“NEJM”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
02、硼中子俘获疗法:精准爆破复发性胶质母细胞瘤,1年生存率高达79.2%,远超传统疗法1倍
硼中子俘获疗法(BNCT)是针对脑和头颈部恶性肿瘤的创新粒子治疗技术。其原理基于稳定硼同位素(¹⁰B)与低能热中子反应,生成两束射程仅约10微米(相当于细胞直径)的重粒子——阿尔法粒子与锂粒子(⁷Li³⁺)。这一特性使辐射效应精准局限于硼化合物富集区域,理论上大幅降低对正常组织的损伤,实现细胞级“定点爆破”。
临床数据证实,BNCT能在保护正常细胞的同时靶向摧毁肿瘤,显著延长胶质母细胞瘤(GBM)等难治性癌症患者的生存期并提升安全性。
《神经肿瘤学进展》发布的一项Ⅱ期临床试验数据尤为亮眼,本次研究共入组27例复发性胶质母细胞瘤患者(24例为经典型GB),中位年龄49.5岁(范围:25–68岁),中位肿瘤体积7.3mL(范围:1.3–30.0mL)。
结果显示:复发性GB患者的中位总生存期(OS)达18.9个月(95%CI:12.9-无法估计),1年生存率更是高达79.2%(95%CI:57.0-90.8),较贝伐单抗组(中位OS仅为10.5个月,1年生存率仅为34.5%)提升超1倍!
▼胶质母细胞瘤患者的总体生存率
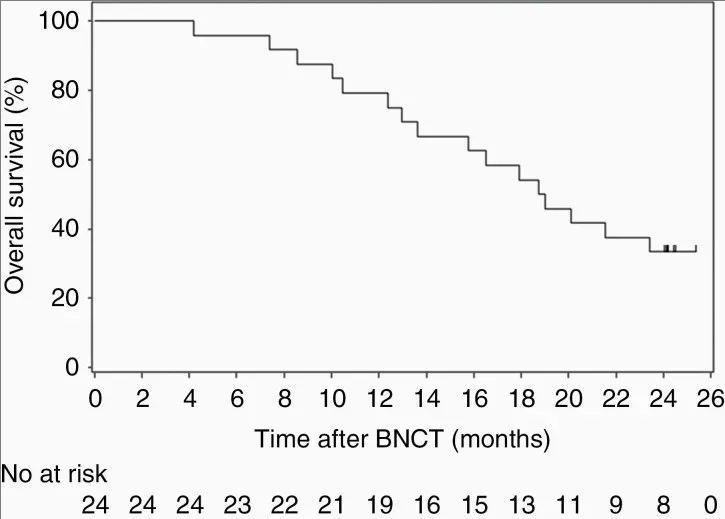
▲图源“Neurooncol Adv”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
其中一位63岁的女性患者极具代表性,该患者因左颞叶胶质母细胞瘤,相继接受手术、放疗及替莫唑胺(TMZ)标准治疗。但14个月后,肿瘤复发,遂入组接受硼中子俘获疗法(BNCT)治疗。
结果显示:治疗1年后,肿瘤得到有效控制,虽因放射损伤出现脑肿胀,但经贝伐单抗(BEV)干预后水肿稳定。随访3年,患者神经系统状态保持稳定,生活质量显著改善(详见下图)。
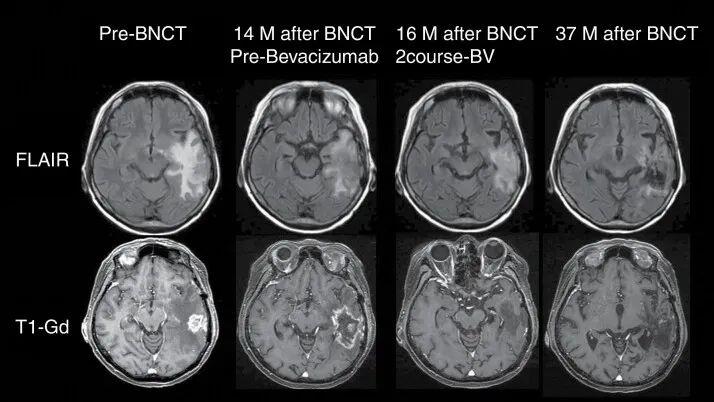
▲图源“Neurooncol Adv”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
好消息是,日本的硼中子俘获疗法近期终于启动临床了,主要针对难以全部切除恶性肿瘤患者。想寻求硼中子俘获疗法帮助的病友,可联系医学部,进行初步评估,或了解详细的入排标准。
03、电场疗法:助胶质母细胞瘤患者重拾希望,7个月显著缓解病情
肿瘤电场疗法(TTFields)是一种便携无创的局部物理治疗手段。患者通过在皮肤表面粘贴特殊绝缘电极贴片,即可产生穿透组织的低强度中频电场,通过干扰癌细胞内类似“马达”的关键构件,从根源上阻断癌细胞的转移与扩散。其最大优势在于居家可操作,患者无需频繁往返医院,治疗与日常生活互不干扰。
▼电场疗法组成及佩戴示例图

▲图源“MDPI”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
《临床肿瘤护理杂志(CJON)》曾记录过一则经典病例:一名28岁男性因癫痫发作及意识恢复迟缓就医,MRI显示右侧颞叶与顶叶交界处存在病变。经高剂量类固醇及左乙拉西坦(Keppra®)稳定病情后,患者接受开颅肿瘤切除术,病理确诊为胶质母细胞瘤。
术后,患者先完成放化疗,间隔一月后开启为期一年的替莫唑胺(TMZ)辅助化疗。6年后,因右手间歇性颤抖而复查,MRI发现原肿瘤区域出现一个2.2cm×1.5cm强化病灶,二次手术后病理证实为复发性胶质母细胞瘤,并伴放射后改变。
经神经肿瘤科团队多方案评估(含临床试验选项),患者最终选择肿瘤电场疗法(TTFields)。令人振奋的是,治疗7个月后,患者恢复状况良好(详见下图)。
▼该患者在电场疗法治疗前后的MRI对比
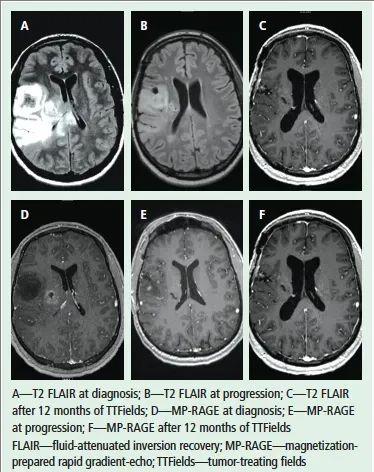
▲图源“MDPI”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
树突状细胞(DC)是机体内唯一能够激活初始T细胞的抗原提呈细胞,在机体的免疫反应中扮演着举足轻重的角色。不过现阶段,大多DC疫苗还处于早期临床试验阶段;但也有一些国家,已将树突细胞疫苗正式投入临床应用。
对于部分早期肿瘤患者而言,在手术后可考虑采用树突细胞联合放化疗的辅助治疗方案,这有助于清除残留的癌细胞,形成免疫记忆,从而有效预防癌症的复发和转移。对目前治疗方案不满意,或想寻求树突状细胞疫苗、CAR-T、电场疗法、硼中子俘获疗法等抗癌新技术帮助的患者,可将近期病理报告、影像学检查资料、治疗经历等,提交至医学部,进行初步评估。
参考资料
[1]Wen PY,et al.A Randomized Double-Blind Placebo-Controlled Phase II Trial of Dendritic Cell Vaccine ICT-107 in Newly Diagnosed Patients with Glioblastoma. Clin Cancer Res. 2019 Oct 1;25(19):5799-5807.
https://pmc.ncbi.nlm.nih.gov/articles/PMC8132111/
[2]Choi BD,et al.Intraventricular CARv3-TEAM-E T Cells in Recurrent Glioblastoma. N Engl J Med. 2024 Mar 13.
https://www.nejm.org/doi/10.1056/NEJMoa2314390?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
[3]Kawabata S,et al.Accelerator-based BNCT for patients with recurrent glioblastoma: a multicenter phase II study. Neurooncol Adv. 2021 May 20;3(1):vdab067.
https://pmc.ncbi.nlm.nih.gov/articles/PMC8209606/
[4]Schwartz M A,et al.Rationale and Background on Tumor-Treating Fields for Glioblastoma[J]. Clinical Journal of oncology Nursing, 2016, 20(5).
https://www.ons.org/publications-research/cjon/20/5/supplement-october-2016-glioblastoma-treatment/rationale-and
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期前列腺癌术后五年生存率超99%,但是
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
重磅!"O+Y"双免
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

生死时速!DC疫苗为脑瘤患者抢下关键缓冲
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
双肺转移灶全部消失!治疗4个月肉瘤完全缓
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

实现肿瘤控制率100%!2025非小细
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【EGFR TKI药物】新一代靶向药TY
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




