2024五大免疫细胞疗法战绩盘点,完全缓解率突破50%,通杀血癌及实体瘤,开启抗癌"私人定制"时代
2024年NK、CAR-NK、CAR-T、TIL、TCR-T五大细胞疗法疗效数据盘点,完全缓解率突破50%,通杀血癌及实体瘤,开启抗癌"私人定制"时代
癌症作为一种极其狡猾且复杂的疾病,它擅长伪装且会不断进化,因此,“联合疗法至关重要”,在现阶段,仅仅依靠单一的治疗手段往往难以达到预期的治疗效果。在早期精准诊断的基础之上,以手术、放化疗等传统疗法作为根基,同时结合免疫细胞疗法、肠道菌群疗法、靶向药物疗法等其他疗法进行联合治疗,是当前较为理想的抗癌策略。
其中,运用患者自身的免疫细胞或经过基因工程改造的免疫细胞,来抗击癌症的免疫细胞疗法,在抗癌领域拥有关键地位。我们很欣慰的看到,今年免疫细胞疗法也取得了前所未有的重大突破,不仅有多款产品相继获批上市,更是有多种疗法正在正处于探索进程之中,涵盖CAR-T细胞、肿瘤浸润淋巴细胞(TIL)、TCR-T、NK细胞、CAR-NK细胞等等。2024年也被誉为“细胞治疗元年”!
在2024年末之际,小编将为大家简单回顾一下,本年度广谱性免疫细胞疗法在临床研究领域所获取的重大进展,为肿瘤患者树立抗癌信心!
五项免疫细胞疗法技术突破,让我们更接近战胜癌症
在过去的数十年间,手术、放疗和化疗作为传统癌症疗法,始终在癌症治疗领域占据着标准治疗方案的主导地位。然而,伴随时间推移,其在处理癌症复杂特性时所暴露出的局限性愈发显著。已难以满足当下癌症治疗的多元需求。
幸得近年来,癌症分子生物学与免疫肿瘤学领域持续发力,取得了一系列振奋人心的新突破,由此癌症治疗得以逐步迈入精准化与靶向化的崭新时代。特别是以CAR-T、TCR-T、NK 细胞、TIL 细胞、CAR-NK 细胞等为典型代表的免疫细胞疗法的蓬勃兴起,为深陷癌症泥沼的患者们带来了充满希望的新曙光。这类前沿的免疫细胞疗法凭借其独特的作用机制,能够动员自身免疫系统,精准地锚定癌细胞并展开靶向清除行动,同时在治疗过程中,最大程度地削减对正常细胞的附带毒性作用以及各类不良影响,从而为癌症治疗开拓出全新的发展路径与方向,极大地丰富了癌症治疗的策略库。
截至2024年8月,全球范围内共有6448项细胞疗法相关的临床试验完成登记,其中我国占据2687项,占比达41.7%;美国则有1859项,占比28.8%。这不但表明细胞疗法已正式向实体瘤发起挑战,更为患者燃起了新的治疗希望之火。
NK细胞疗法
NK 细胞,也就是自然杀伤细胞,是人体免疫系统的关键组成部分。它借助细胞介导的细胞毒性以及抗体依赖性细胞毒性机制,在先天免疫体系中扮演着举足轻重的角色。值得一提的是,与 CAR - T 细胞疗法存在差异的是,NK 细胞疗法具备多元的细胞来源途径,既可以从健康供体的外周血(PB)获取,也能够利用脐带血(UCB)、诱导性多能干细胞(iPSC),甚至是市售的 NK 细胞系等。这种丰富的来源多样性赋予了 NK 细胞疗法卓越的多功能性,使其能够实现兼具成本效益的大规模制备以及便捷的现成可用性,进而为患者提供了随需应变的治疗方案选择。
不仅如此,NK 细胞自身还拥有诸多显著优势。它不受主要组织相容性复合体(MHC)的限制进行识别,拥有深入肿瘤微环境的能力、强劲的细胞溶解效能,并且在安全性方面表现出色,能够有效降低细胞因子释放综合征(CRS)、移植物抗宿主病(GvHD)以及免疫效应细胞相关神经毒性综合征(ICANS)等并发症发生的风险。这些独特的生物学特性使得 NK 细胞成为攻克实体肿瘤极具潜力的候选方案,为 CAR - T 等基因改造细胞疗法提供了一种切实可行的替代路径。尤其在与化疗或靶向治疗联合应用的情境下,NK 细胞疗法能够进一步显著提升整体的治疗成效,为癌症治疗策略的优化拓展了新的维度。
600例患者大型研究证实,NK细胞疗法安全有效
近期,全球著名期刊《免疫学前沿(Frontiers in Immunology)》,公布了一篇时间跨度20年、涵盖31项研究、涉及600例实体瘤患者的荟萃分析的最新研究结果,范围涉及非小细胞肺癌 (NSCLC)、肝细胞癌 (HCC)、乳腺癌、卵巢癌、胰腺癌、肾细胞癌 (RCC)、中枢神经系统肿瘤 (CNS 肿瘤)、鼻咽癌、消化系统肿瘤等多种实体瘤。该荟萃分析结果显示如下:

▲截图源自“frontiers”
1、治疗效果评估:总体缓解率 (ORR)(定义为部分缓解或更佳)为 28.2%(95% CI:0.194 - 0.389)。疾病控制率 (DCR)(定义为病情稳定或更佳)达到63.2%(95% CI:0.543 - 0.713)(详见下图)。
▼总体缓解率和疾病控制率的森林图
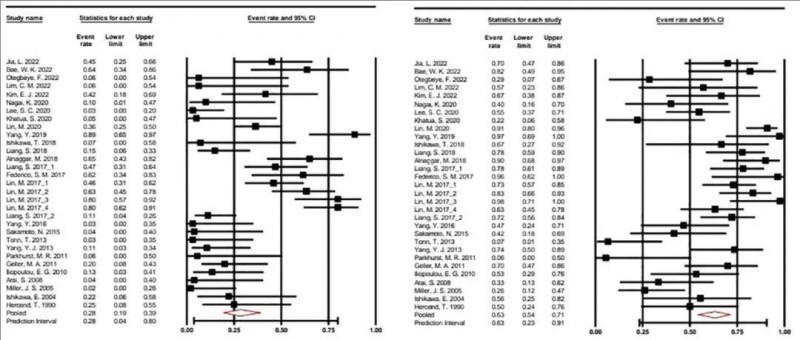
▲图源“frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
尤其值得注意的是,在肝细胞癌亚组,其ORR 高达 72.3%(95% CI:0.527-0.859),DCR 高达 88.9%(95% CI:0.749-0.956)。此外,同种异体细胞比自体细胞表现出更好的疗效,其ORR分别为39.6%(同种异体细胞组,95% CI:0.261-0.549) vs 21.7%(自体细胞组,95% CI:0.121-0.359);DCR分别为71.9%(同种异体细胞组,95% CI:0.603-0.812) vs 56.1%(自体细胞组,95% CI:0.442-0.674)。
2、安全性评估:荟萃分析纳入了31项研究中的15项,共计218名受试者,报告了指定级别的不良事件。在1-2级不良事件中,常见包括疲劳(占44%,95% CI:0.34-0.56)、恶心(37%,95% CI:0.25-0.53)、贫血(占33%,95% CI:0.22-0.47)。在3级或更高级别的不良反应中,常见包括头痛(25%,95% CI:0.16-0.37)、厌食症(8%,95% CI:0.02-0.20)、中性粒细胞减少症(7%,95% CI:0.03-0.16)(详见下图)。值得一提的是,未见细胞因子释放综合征 (CRS) 或移植物抗宿主病 (GvHD)等 CAR-T细胞疗法的常见副作用。
▼不良事件总体发生率与95% CI的森林图
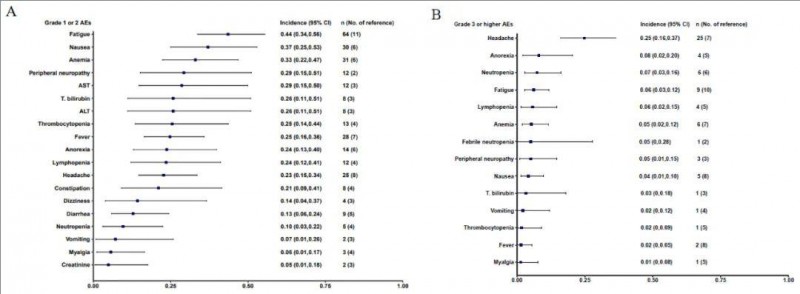
▲图源“frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
CAR-NK细胞疗法
CAR-NK细胞疗法是利用基因工程技术,给NK细胞安上一个“CAR(一种人工修饰的融合蛋白)”导航头,使其在保留NK细胞原有功能的基础上,还能将打击目标精准地锁定在特定的抗原蛋白上,使狡猾的癌细胞难以遁形,最终达到精准抗癌的目的。
CAR-NK疗法优势
尽管CAR-T细胞在部分特定的血液系统癌症治疗中已展现出临床疗效,但该领域也遭遇了诸多阻碍,例如治疗剂量的生产耗时漫长,以及难以从接受过大量前期治疗的癌症患者体内获取足量的自体T细胞等难题。而CAR-NK细胞疗法的问世,则标志着癌症免疫疗法领域一次充满希望的变革,为CAR-T细胞疗法所面临的困境提供了潜在的解决途径。
→首先,CAR-NK细胞使用同种异体NK来源,可以利用无穷无尽的同种异体NK资源,并且不会引发移植物抗宿主病(GVHD)等问题,这使其具备了极为显著的安全优势。
→其次,借助NK细胞系或iPSC-NK细胞,展现出了“现成”产品的潜力,从而大幅缩减了生产时间。这种效率对于治疗病情快速进展的患者至关重要。
→最后,CAR-NK细胞疗法的应用范畴更为宽泛,能够针对血液系统和实体恶性肿瘤中的多种肿瘤抗原发挥作用,既可以用于淋巴瘤、骨髓瘤和白血病等血液系统恶性肿瘤的治疗;还可用于实体瘤治疗,包括卵巢癌、前列腺癌、脑癌、肝癌、肠癌、肺癌和胰腺癌等。
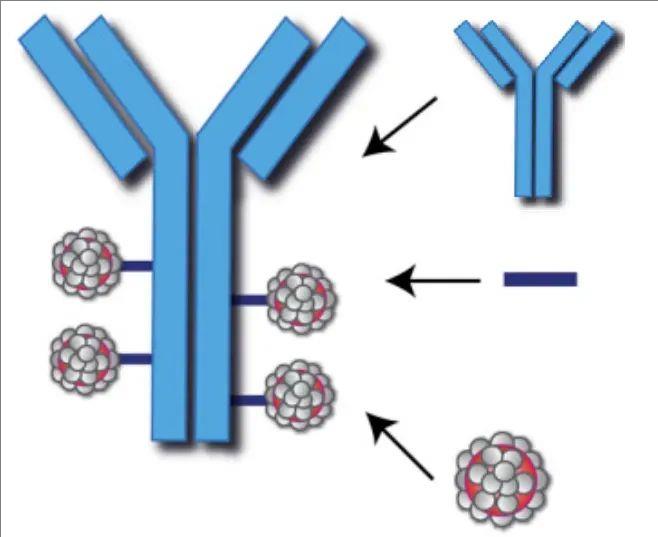
下图展示了CAR-T和CAR-NK细胞疗法从细胞获取到疾病靶向的整个过程。对于CAR-T细胞,需要进行MHC匹配以防止排斥。对于CAR-NK细胞,MHC匹配的需要较少,从而简化了制备过程。不过,两者都经过工程改造和扩增,并重新引入患者体内以对抗疾病。
▼CAR-T细胞和CAR-NK细胞治疗过程的对比图
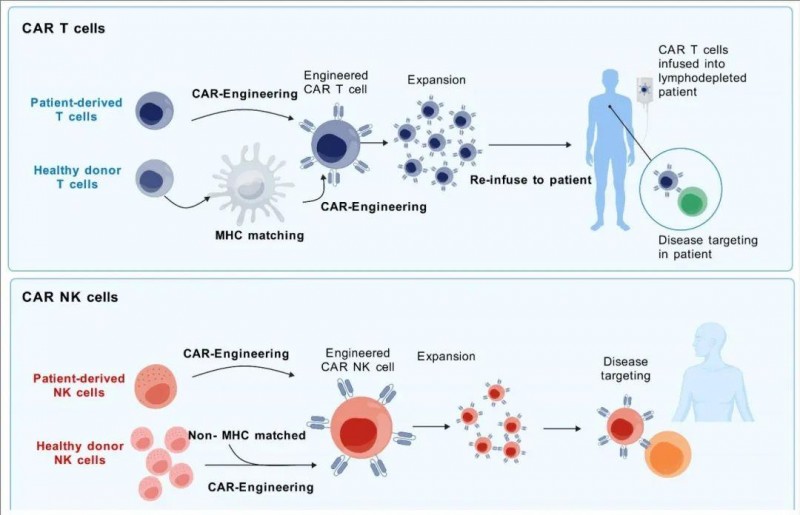
▲图源“MDPI”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
CAR-NK疗法助复发性胶质母细胞瘤患者,实现近三年生存奇迹
全球知名《神经肿瘤学(Neuro-Oncology)》期刊,近期报道了一项“应用CAR-NK细胞,治疗复发性HER2阳性胶质母细胞瘤”的Ⅰ期惊艳临床数据,生存时间最长达到了135周(33.75个月,≈2.8年)。本次共纳入9例可评估疗效的复发性HER2阳性胶质母细胞瘤(GB)患者,这些患者在复发手术期间,接受了手术腔边缘注射CAR-NK细胞治疗。
结果显示:全部入组患者(n=9)的中位总生存期(OS)为31周,中位无进展生存期(PFS)为7周。而出现假性进展的2例患者其OS分别为98周、135周,PFS为37周(详见下图)。

▲图源“Neuro-Oncology”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,56%的患者在复发手术和持续7~37周的CAR-NK治疗后,达到病情稳定(SD)。其中,2例患者在注射部位发现假性进展,提示存在治疗诱导的免疫反应。其中,MRI显示CAR-NK注射后第12周,患者切除边缘附近,出现斑点状对比增强,并在接下来的几周内消失,这可能与诱导的免疫反应相关,无需进一步治疗(详见下图)。

▲图源“Neuro-Oncology”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,全部9例患者均未出现剂量限制性毒性,也未见细胞因子释放综合征或免疫效应细胞相关神经毒性综合征。综上,对于复发性胶质母细胞瘤患者,颅内注射靶向HER2的CAR-NK细胞是安全可行的。
CAR-T细胞疗法
1182名患者大型研究结果曝光,CAR-T完全缓解率超50%
近期全球知名《血液学》杂志,曝光了一项针对1182名患者接受CAR-T细胞治疗后,效果及安全性的大型分析,其中79%的患者处于疾病晚期(III-IV期)阶段。

▲截图源自“Blood”
经过22.3个月的中位随访,结果显示:客观缓解率(ORR)超过80%,分别为83%(tiNHL组,即转化惰性淋巴瘤) vs 81%(DLBCL组,即弥漫性大B细胞淋巴瘤患者);完全缓解率(CRR)也超过了50%,分别为67%(tiNHL组) vs 59%(DLBCL组)。24个月的总生存率(OS)分别为58%(tiNHL组) vs 52%(DLBCL组);24个月的无进展生存率(PFS)则分别为41%(tiNHL组) vs 38%(DLBCL组)。
2024喜迎一款新型CAR-T产品,Aucatzyl在美国获批上市
2024年11月8日,一款名为Aucatzyl(obe-cel,obecabtageneautoleucel)的新型CAR-T疗法,获美国食品药品监督管理局(FDA)批准,用于治疗成人复发或难治性B细胞前体急性淋巴细胞白血病(ALL),这是FDA批准的首个无需REMS计划(即“风险评估缓解策略”)的CAR-T疗法,大大简化了其使用和监管流程!

▲截图源自“FDA官网”
而且在Ib/II期FELIX临床研究(NCT04404660)中,Aucatzyl获得了57%(71/124)的完全缓解率(CR),77%的CR/CRi(“完全缓解”或“完全缓解但计数不完全恢复”)率,1年的无事件生存率(EFS)也高达50%(详见下图),为白血病患者带来了新的曙光!
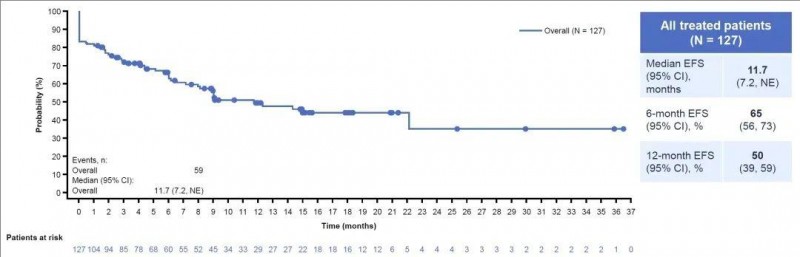
▲图源“ASH”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
TIL细胞疗法
肿瘤浸润淋巴细胞(TIL细胞)是从患者自身的肿瘤活检组织中,采集浸润的淋巴细胞;在体外扩增、培养后,再回输到患者体内的方法。这些改造后的细胞,相当于深入到敌军内部的免疫细胞敢死队,具有优越的肿瘤病灶浸润能力及低脱靶毒性,在治疗肺癌、肝癌、宫颈癌、乳腺癌、卵巢癌、黑色素瘤等实体瘤方面,具有独特的优势,是当之无愧的实体瘤大杀器!
中国自研TIL疗法暴击妇科肿瘤,疾病控制率高达71%
近期国际知名医学期刊《BMC Medicine》报道了我国进行的一项针对晚期妇科肿瘤患者的 I 期开放临床研究的惊艳数据,据悉这是首次在晚期妇科癌症患者中对改良方案产生的 TIL 进行的临床试验。该研究共入组16例晚期妇科肿瘤(包括宫颈癌、卵巢癌、子宫内膜癌、腹膜癌),既往接受过3-4种全身治疗(包括化疗,靶向,PD-1 或 CTLA4 抗体治疗)失败,且评估存在3~4个病灶的晚期难治性患者。
最终在14例可评估疗效的患者中,结果显示:客观缓解率(ORR)达到36% (5/14, 95%CI 16.3–61.2),疾病控制率(DCR)高达71% (10/14, 95%CI 45.4–88.3),其中 3例(21%)患者奇迹般获得完全缓解 (CR),另2 例患者 (14%) 达到部分缓解 (PR),5 例 (36%) 患者达到病情稳定 (SD) (详见下图)。
▼治疗持续时间的 Swimmer图
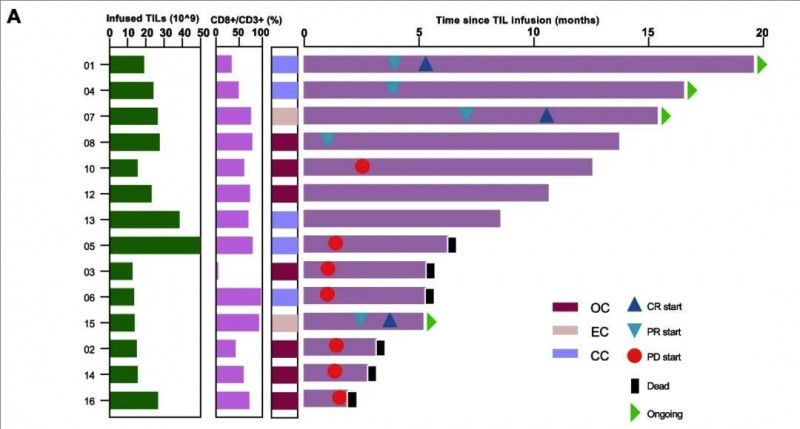
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:每条柱的长度代表每位患者的治疗持续时间。
值得一提的是,三例完全缓解分别持续了 19.5、15.4 和 5.2 个月。下图展示了一例患有复发性宫颈癌并伴有膀胱转移的患者(01号患者),在 TIL 治疗后获得了超过 1.5 年的持续完全缓解(详见下图)。
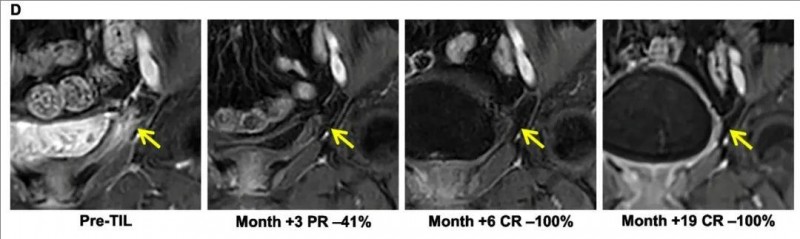
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2024全球首款TIL产品—Lifileucel震撼上市
2024年2月16日,我们迎来了全球首款获批上市的自体TIL细胞药物——Lifileucel(LN-144,Amtagvi),已获美国FDA批准,用于成人既往使用过PD-1阻断抗体治疗的不可切除或转移性黑色素瘤的治疗。
除了治疗黑色素瘤外,Lifileucel治疗转移性非小细胞肺癌(mNSCLC)的疗效依然抗打。2期临床研究结果显示,Lifileucel治疗免疫检查点抑制剂(ICI)耐药的晚期非小细胞肺癌的客观缓解率 (ORR) 达21.4%(6/28),部分缓解率(PR)达到17.9%(5/28),高达79.2%(19例)的患者出现肿瘤负荷缩小表现,42.9%的患者达到病情稳定(SD)(详见下图)。其中1例幸运患者(患者3B-02)更是奇迹般获得了完全缓解(CR),且无需后续局部或全身治疗。

▲图源“Cancer Discov”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
TCR-T细胞疗法
T细胞受体工程化T细胞(TCR-T细胞)疗法是利用基因工程技术,将抗原特异性TCR基因序列(α及β链),转移到T细胞中,使其特异性识别肿瘤抗原,并精准地杀死癌细胞,主要用于实体瘤的治疗,包括滑膜肉瘤、肺癌、肝细胞癌、宫颈癌、黑色素瘤等。
北京协和医院完成全球首创TCR-T治疗,28天肿瘤显著缩小74%,近7个月无进展
近期,北京协和医院肝脏外科团队一篇“应用SCG101 TCR-T细胞,助晚期乙肝相关肝癌患者,肿瘤缩小超70%”的临床研究成果,荣登《临床和分子肝病学》的封面论文!标志着我国TCR-T研究的重大进步,为肝癌等实体瘤患者带来了新的曙光!SCG101全球首创(First in class)的一款针对乙型肝炎表面抗原特异性的自体TCR-T细胞治疗产品,兼具抗病毒和抗肿瘤活性!
本次参与研究的这位患者,是一位54岁的晚期(IIb期)乙肝相关肝癌(HBV-HCC)患者,入组前状态不佳且已不适合手术治疗了,遂入组接受淋巴细胞清除化疗+SCG101回输治疗。
结果显示:SCG101输注后第28天,肿瘤大面积坏死,,靶肿瘤病灶分别减少74.5%(m RECIS)、47.5%(i RECIST)。并最终获得部分缓解(PR),目标病变大小缩小70%以上(详见下图)。
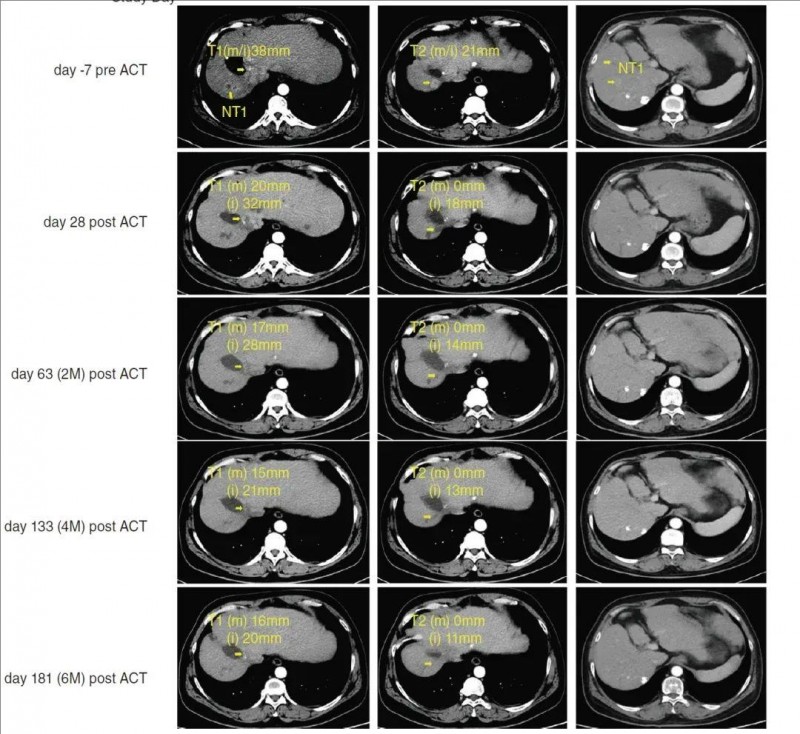
▲图源“Clin Mol Hepatol ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,血清乙肝表面抗原(HBsAg)大幅下降,在细胞移植后1周内,从557.96IU/ml,迅速降至1.3IU/ml。与基线相比的最大降幅为3.84log10~0.08IU/mL,并维持了6个月以上。值得一提的是,SCG101治疗73天后,肝活检中表达HBsAg的肝细胞无法检测到。

▲图源“Clin Mol Hepatol ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2024全球首个TCR-T产品—Afami-cel,终于在美国获批上市
2024年8月2日,我们迎来了全球首个TCR-T产品——Afami-cel(afamitrisgene autoleucel,TECELRA®),获美国FDA批准上市的好消息,用于治疗不可切除或转移性滑膜肉瘤的成人患者。至此,CAR-T(目前获批12款产品)、TIL(“Amtagvi”TIL细胞产品)这三款过继性T细胞疗法,正式形成“三足鼎立”的局面!
在2期SPEARHEAD-1临床试验(NCT04044768)中,Amtagvi的总体缓解率(ORR)达到37%,这也意味着,近40%的晚期肉瘤患者,经Afami-cel治疗后,肿瘤显著缩小(超过30%)甚至消失(详见下图)。
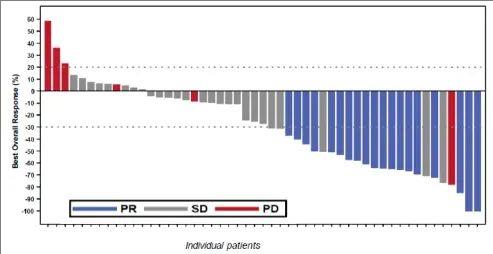
▲图源“Adaptimmune”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,中位总生存期(OS)达到17个月,而且对于缓解患者2年总生存率高达70%。这也意味着,近70%的患者生存超过2年,这无疑是难治性肉瘤的巨大生存突破!
小编寄语
癌症治疗一直是困扰世界的难题,传统的手术、放化疗等抗癌方式,易出现复发或转移,因此迫切需要开发新型抗癌手段。随着医学技术的不断发展,癌症逐渐进入精准治疗的时代,以CAR-T、TCR-T、TIL、NK细胞疗法等为代表的免疫细胞疗法,主要通过调动人体的免疫细胞,精准识别并杀灭癌细胞,与此同时对正常细胞组织的损伤较小,颠覆了传统的抗癌模式!
值得欣慰的是,今年这些过继性免疫细胞疗法都取得了突破性进展,不仅相继有多款产品获批上市,而且多项在研的临床试验也取得了重大进展,为癌症患者带来了新的曙光!对现有治疗方案不满意,或想寻求CAR-T、TCR-T、TIL、NK或CAR-NK疗法等国内外其他抗癌新技术帮助的患者,可先将近期病理报告。治疗经历等资料,提交至全球肿瘤医生网医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Park H,et al.Efficacy and safety of natural killer cell therapy in patients with solid tumors: a systematic review and link-analysis[J]. Frontiers in Immunology, 2024, 15: 1454427.
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2024.1454427/full
[2]Li W,et al.CAR-NK cell therapy: a transformative approach to overcoming oncological challenges[J]. Biomolecules, 2024, 14(8): 1035.
https://www.mdpi.com/2218-273X/14/8/1035
[3]Burger M C,et al.Intracranial injection of natural killer cells engineered with a HER2-targeted chimeric antigen receptor in patients with recurrent glioblastoma[J]. Neuro-oncology, 2023, 25(11): 2058-2071.
https://academic.oup.com/neuro-oncology/article/25/11/2058/7155851?login=false
[4]Kambhampati S,et al.Real-World Outcomes of CD19CAR T Cell Therapy in Adult Patients with Relapsed Refractory Transformed Indolent Lymphoma[J]. Blood, 2023, 142: 3511.
https://ashpublications.org/blood/article/142/Supplement+1/3511/503728/Real-World-Outcomes-of-CD19CAR-T-Cell-Therapy-in
[5]Roddie C,et al.Obecabtagene autoleucel (obe-cel, AUTO1) for relapsed/refractory adult B-cell acute lymphoblastic leukemia (R/R B-ALL): pooled analysis of the ongoing FELIX phase Ib/II study[J]. Blood, 2023, 142: 222.
https://ash.confex.com/ash/2023/webprogram/Paper179454.html
[6]Guo J, Wang C, Luo N, et al. IL-2-free tumor-infiltrating lymphocyte therapy with PD-1 blockade demonstrates potent efficacy in advanced gynecologic cancer[J]. BMC medicine, 2024, 22(1): 207.
https://bmcmedicine.biomedcentral.com/articles/10.1186/s12916-024-03420-0
[7]Schoenfeld A J,et al.Lifileucel, an autologous tumor-infiltrating lymphocyte monotherapy, in patients with advanced non–small cell lung cancer resistant to immune checkpoint inhibitors[J]. Cancer discovery, 2024, 14(8): 1389-1402.
https://aacrjournals.org/cancerdiscovery/article/14/8/1389/746508/Lifileucel-an-Autologous-Tumor-Infiltrating?searchresult=1
[8]Wan X,et al.Genetically-modified, redirected T cells target hepatitis B surface antigen-positive hepatocytes and hepatocellular carcinoma lesions in a clinical setting. Clin Mol Hepatol. 2024 Oct;30(4):735-755.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11540345/
[9]https://www.adaptimmune.com/investors-and-media/news-center/press-releases/detail/271/adaptimmune-receives-u-s-fda-accelerated-approval-of
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
2025获批在即!六大ADC药物重磅来袭
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
愈见大"CAR"|&
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
愈见大"CAR"|得
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

CLDN18.2靶向药M108单抗注射液
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【CLDN18.2药物】新一代靶向药AS
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
晚期肺癌有救了,疾病控制率高达87.3%
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




