肿瘤治疗的一束光:放疗+免疫
免疫加放疗治疗肿瘤,放疗联合免疫治疗肿瘤癌症既是强强联合又是优势互补
免疫治疗(immunotherapy)主要是指依靠激活自身免疫系统对肿瘤的免疫反应,来达到肿瘤治疗的目的。而对肿瘤免疫中,最主要的参与者和执行者之一,就是T淋巴细胞。
因此,激活T淋巴细胞对肿瘤免疫,是大多数免疫疗法的主要方向,包括免疫检查点抑制剂、过继性细胞疗法,以及癌症疫苗。
同样诞生于19世纪最后十年的放疗和免疫治疗,走过各自的百年历程之后,终于在21世纪的第二个十年走到了一起。二者的结合,既是强强联合,又是优势互补。
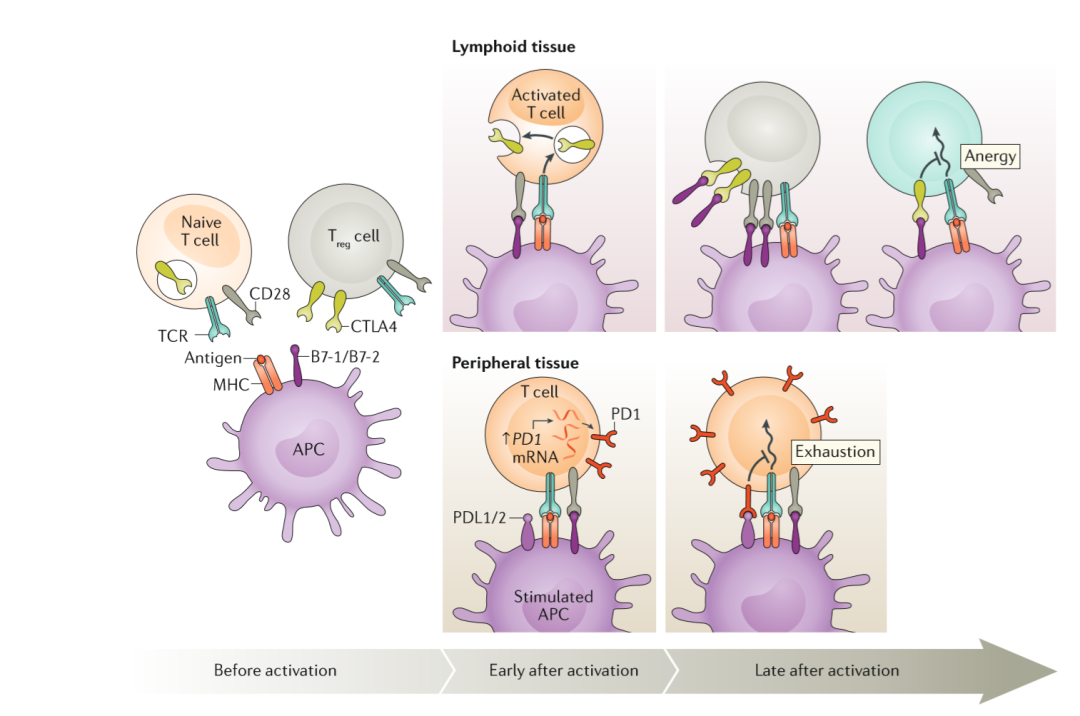
免疫治疗的坎坷之路
实际上,早在1893年,Coley公布研究成果的时候,肿瘤学界都是抱着看“祖传老偏方”的姿态去怀疑他的。美国癌症协会更是毫不留情面地质疑道,“我们还需要更多的研究来确定这种疗法对癌症患者的可能益处,如果有的话。”[6]
当然,从今天往回看,肿瘤学界质疑Coley是完全有道理的。在那个年代,学界对人体免疫系统的认知几乎为零,过了半个多世纪,才看到了一丝丝光亮。毕竟与简洁优雅的物理学相比,生命系统要复杂的太多太多。
免疫治疗的曙光初现在千禧龙年——2000年。科学家和医生在转移性黑色素瘤患者身上,第一次见识到了免疫治疗的威力。十一年之后,全球第一个免疫检查点抑制剂CTLA-4抗体获得FDA的上市批准。真正让免疫治疗家喻户晓的,还是靶向PD-1/PD-L1通路的免疫检查点抑制剂。
无论是靶向CTLA-4的免疫检查点抑制剂治疗黑色素瘤,第一次让世人见识了免疫治疗的“超长待机”能力[7];还是PD-1抗体把复发/难治性非小细胞肺癌的5年生存率,从5%提升到16%[8],我们都能切实的感受到,免疫治疗给癌症带来了革命性的变化。
不过,免疫治疗的不足也非常明显,仅有10%-30%的患者响应免疫检查点抑制剂的治疗。这与癌细胞、免疫系统和肿瘤微环境的复杂性密不可分。
从癌细胞的角度来讲,为了避免被杀伤性T细胞识别,它会降低主要组织相容性复合体(MHC)的表达,增加有免疫抑制作用的表面蛋白或细胞因子的表达,或者通过特殊信号招募髓源性免疫抑制细胞进入肿瘤[9]。
人体免疫系统的复杂程度让人咋舌。杀伤性T细胞除了要面对自身的PD-1表达水平之外,它的抗癌活性还受其他辅助性免疫细胞和抑制性免疫细胞的影响[10]。
肿瘤微环境是免疫细胞和癌细胞作战的第一线,这里的环境极其恶劣。不仅有各种癌细胞的代谢产物抑制免疫细胞的活性,甚至肿瘤的基质细胞,也参与到抑制免疫细胞活性的过程中[11]。
鉴于上述总总情况的复杂性,免疫治疗联合手术、放疗、化疗、靶向治疗,甚至是免疫治疗之间的联合,成为近年来的研究热点。尤其是与放疗的联合。
放疗联合免疫,相互增益
由于放疗自身的特点,长期以来,学界都有个猜测,放疗可以增强免疫治疗的作用[12]。近年来,这个猜测正在被越来越多的临床证据证实。

例如PACIFIC这个三期临床试验[13]。在这个全球多中心的大型三期临床试验中,研究人员一共招募了来自26个国家235家医院的713名不可手术的Ⅲ期非小细胞肺癌患者,在同步放化疗后接受的PD-L1单抗Durvalumab(简称“I”药)的巩固治疗。
最终,那些接受了Durvalumab治疗的患者:无疾病进展生存期从5.6个月提升到16.8个月,患者的疾病进展或死亡风险降低了48%。生存率方面,目前Durvalumab治疗组66.3%的2年生存率,也好过单纯放化疗的55.6%。
同步放化疗+Durvalumab免疫治疗,现在已经是美国NCCN指南推荐的III期不可手术肺癌患者一线标准方案[14]。不仅如此,欧洲ESMO和中国CSCO指南也将其作为1A类证据,推荐为III期肺癌患者的新的标准治疗方案。
在2019年ASCO年会上。PACIFIC的三年随访数据发布,Durvalumab治疗组的患者三年生存率高达57%,而安慰剂组只有43.5%,患者的死亡风险降低了31%。
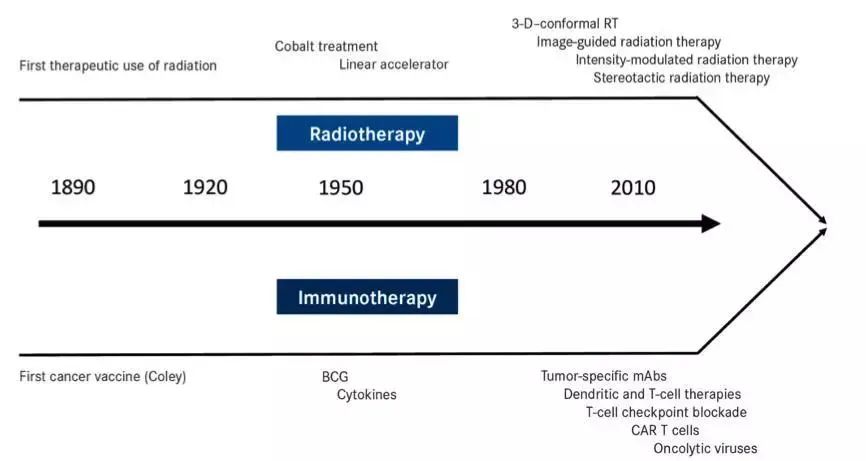
免疫治疗和放疗的发展时间线
放疗联合免疫治疗之所以能起到1+1>2的效果,这与二者之间相互增益的抗癌机制有关。
首先,放疗可以全面引发免疫细胞对癌细胞的识别
放疗可以直接导致癌细胞以凋亡、坏死和自噬等方式死亡[15]。上述死亡方式,促进肿瘤细胞释放肿瘤特异性抗原,增加免疫细胞发现癌细胞的机会。射线可以直接破坏细胞的DNA,让癌细胞产生新抗原,这也会引发免应答[16]。甚至还有研究表明,放疗可以上调肿瘤MHC-I的表达,从而能够更好地呈递肿瘤特异性抗原,增强肿瘤对细胞毒性T细胞的可见性[17]。
其次,一些先天免疫通路可以在放疗的过程中被激活,进而调节T细胞免疫活性
我们都知道,虽然免疫系统对肿瘤的抵抗,主要依赖于获得性免疫,但先天性免疫在其中也起到一定的作用。尤其是cGAS-STING这条重要的通路。
之前有研究表明,在接受放疗时,如果阻断树突细胞的cGAS-STING通路,T细胞的抗癌活性就会被削弱[18]。这应该主要是因为,放疗导致癌细胞DNA断裂,被cGAS-STING通路发现,上调I型干扰素的表达,促进了T细胞的抗癌活性。
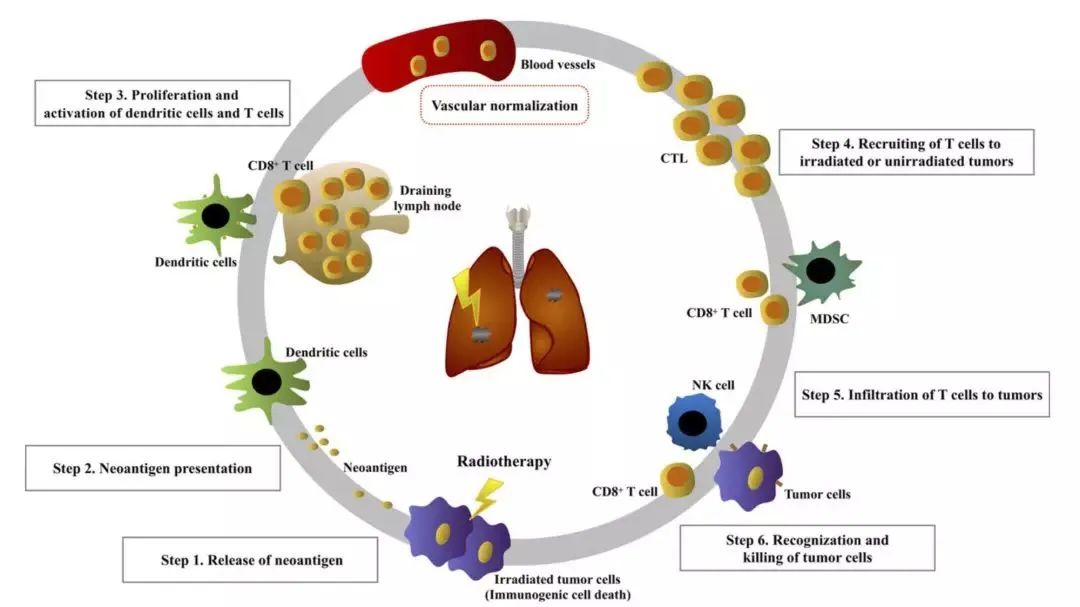
免疫治疗+放疗治疗肺癌的机制
第三,放疗可以调节肿瘤微环境,增加肿瘤微环境中趋化因子CXCL10和CXCL16的水平[20],促进杀伤T细胞往肿瘤迁移。在放疗的过程中,癌细胞表面的PD-L1表达水平会上升[21],进而增强PD-L1抗体的治疗效果[22]。
此外,之前有早期研究表明,放疗诱导的免疫响应效果可能依赖于放疗的剂量[23,24]。在这个基础上美国MD Anderson癌症中心立体放射外科中心主任张玉蛟教授等人,提出了免疫治疗联合立体定向消融放疗(I-SABR)治疗不能手术的早期肺癌患者[25]。2019年,张教授又升级了I-SABR概念,主张同时对多个肿瘤病灶开火,全面提升免疫响应水平[26]。
作为两种互相增益的治疗方式,免疫治疗也给放疗带来有利的影响。
实际上,有很多肿瘤对放疗耐药,其中一个重要原因是肿瘤内部因血管异常或功能失调而缺氧。这种缺氧的状态,会导致,在相同辐射剂量的情况下,DNA的损伤更少[27]。不仅如此,缺氧还会通过积累和稳定缺氧诱导因子-1(HIF1)来驱动对放疗的抗性[28]。
近来已经有研究表明,免疫检查点抑制剂不仅可以激活杀伤性T细胞,还可以使肿瘤血管正常化[29,30],减轻肿瘤缺氧的状态,增加肿瘤对放疗敏感的可能性。
也正是因为放疗和免疫治疗互相增益,因此,目前放疗联合免疫治疗在临床上的使用,有三种形式[10]:先放疗再免疫治疗的序贯治疗(Sequential therapy),几轮免疫治疗之后再同时放疗的诱导治疗(Induction therapy),同时开展放疗和免疫治疗的同步治疗(Concurrent therapy)。
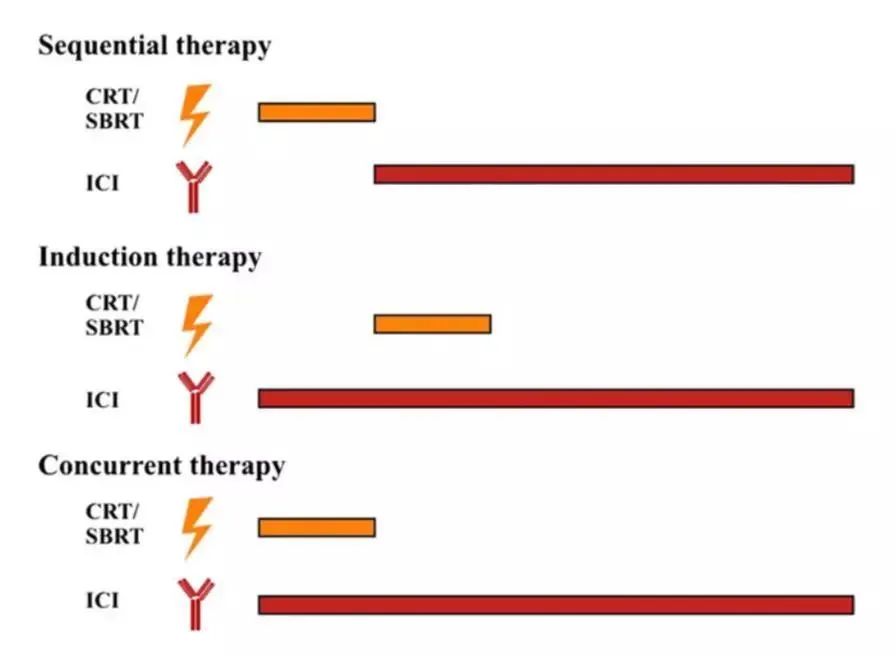
三种不同的免疫治疗+放疗方案
至于上面的三种形式哪种更好,目前没有确切答案[10]。这主要是因为免疫检查点抑制剂的作用靶点有差异,患者的临床分期也存在差异。所以,需要根据药物和患者自身的情况,探索最合适的联合治疗方式。
放疗联合免疫,现状和未来
自James Allison于1996年发现CTLA-4可以作为抗肿瘤的免疫治疗靶点以来,积攒了100年力量的免疫肿瘤学,终于迎来全面爆发。
在过去的一二十年中,科学家和临床医生已经开展数百个临床试验,来研究免疫疗法在多种癌症类型中的效果。
2018年年初,来自内布拉斯加大学医学中心和德州大学MD安德森癌症中心的科学家,分析了近10年放疗联合免疫治疗的临床研究[31]。
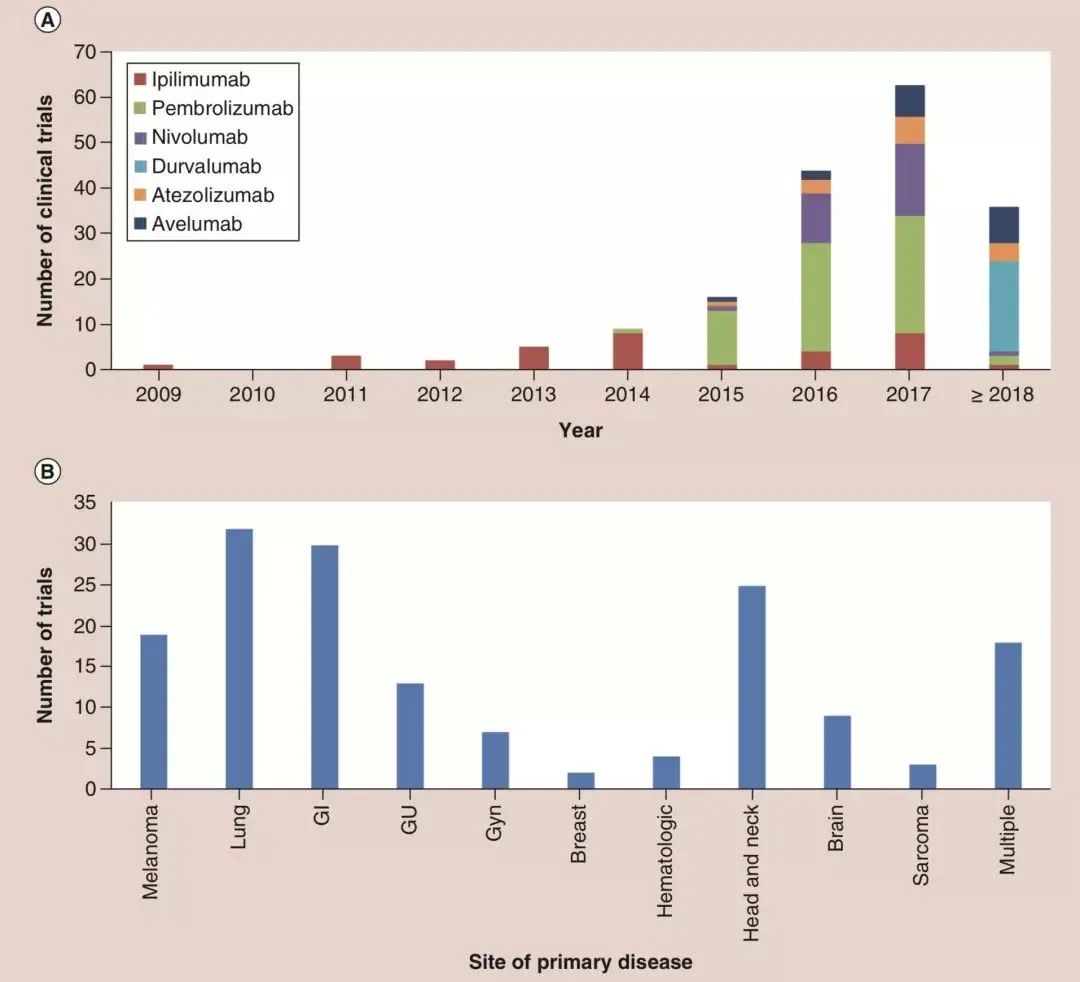
不同年份免疫治疗+放疗临床试验数量,及不同癌种的分布
从数据来看,作者认为免疫治疗联合放疗是全世界肿瘤治疗的主要前沿。自2015年以来,Pembrolizumab一直主导着免疫+放疗临床试验。但是受PACIFIC试验结果的影响,在一系列即将进行的临床试验中,PD-L1单抗Durvalumab已成为新的研发基石,是开展临床研究最多的免疫治疗药物。
不过在这之前,科学家和临床医师们还需要针对不同的癌种,不同的分期,在结合不用的免疫检查点抑制剂,更深入地探索放疗的剂量、次数、时间,以及先后顺序,还有更好的控制联合治疗的副作用,才能让患者从放疗和免疫治疗的联合中获益更大。
参考文献:
[1].https://www.mskcc.org/blog/immunotherapy-revolutionizing-cancer-treatment-1891
[2].https://www.npr.org/sections/health-shots/2015/12/28/459218765/cutting-edge-cancer-treatment-has-its-roots-in-19th-century-medicine
[3].Lederman M. The early history of radiotherapy: 1895–1939[J]. International Journal of Radiation Oncology* Biology* Physics, 1981, 7(5): 639-648.
[4].Coutard H. Principles of x ray therapy of malignant diseases[J]. The lancet, 1934, 224(5784): 1-8.
[5].Citrin D E. Recent developments in radiotherapy[J]. New England Journal of Medicine, 2017, 377(11): 1065-1075.
[6]."Coley Toxins". American Cancer Society. Retrieved 1 March 2018.
[7].Schadendorf D, Hodi F S, Robert C, et al. Pooled Analysis of Long-Term Survival Data From Phase II and Phase III Trials of Ipilimumab in Unresectable or Metastatic Melanoma[J]. Journal of Clinical Oncology, 2015, 33(17): 1889-1894.
[8].Gettinger S N, Horn L, Jackman D M, et al. Five-Year Follow-Up of Nivolumab in Previously Treated Advanced Non–Small-Cell Lung Cancer: Results From the CA209-003 Study[J]. Journal of Clinical Oncology, 2018, 36(17): 1675-1684.
[9].Kalbasi A, June C H, Haas N B, et al. Radiation and immunotherapy: a synergistic combination[J]. Journal of Clinical Investigation, 2013, 123(7): 2756-2763.
[10].Hui Yang, Tao Jin, et al. Synergistic effect of immunotherapy and radiotherapy in non-small cell lung cancer: current clinical trials and prospective challenges[J]. Precision Clinical Medicine, 2(1), 2019, 57–70.
[11].Whiteside T L. The tumor microenvironment and its role in promoting tumor growth[J]. Oncogene, 2008, 27(45): 5904-5912.
[12].Wang Y, Liu Z, Yuan H, et al. The Reciprocity between Radiotherapy and Cancer Immunotherapy[J]. Clinical Cancer Research, 2019, 25(6): 1709-1717.
[13].Antonia S J, Villegas A, Daniel D, et al. Overall survival with durvalumab after chemoradiotherapy in stage III NSCLC[J]. New England Journal of Medicine, 2018, 379(24): 2342-2350.
[14].NCCN Clinical Practice Guidelines in Oncology, Non-Small Cell Lung Cancer
内容来源:中国抗癌协会肺癌专业委员会
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




