闪耀国际!"中国造"CAR-T疗法迎来高光时刻,剑指胃癌、结直肠癌、间皮瘤及淋巴瘤等多癌种!
中国国产CAR-T疗法闪耀国际,针对多种癌症肿瘤的CAR-T临床试验招募正在进行中
对于癌症的治疗和攻克,我国的医学家们从未停止过研究创新的脚步,从最初的化疗药,再到现如今的靶向、免疫治疗,我们距离治愈癌症的目标也越来越近。
免疫疗法作为继手术、放化疗及靶向治疗之后的第四大癌症治疗手段,主要通过增强患者自身的免疫系统识别杀伤癌细胞的能力,或给予患者外来的免疫力量帮助其杀伤癌细胞,以达到“带瘤生存”的目的。
细胞免疫疗法是免疫治疗的一种,通过直接分离我们自己的免疫细胞并简单地扩展其数量,或者对我们的免疫细胞进行基因改造(通过基因疗法)以增强其抗癌能力。而近期内最火的细胞免疫疗法,当属嵌合抗原受体T细胞(CAR-T)疗法莫属。
作为一种“活的”药物,CAR-T疗法与传统药物有着很大的区别。它是一种治疗肿瘤的新型精准靶向疗法。通过基因工程技术将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”,即CAR-T细胞,专门识别体内肿瘤细胞,并高效杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。与传统的化疗和造血干细胞移植相比,它对肿瘤细胞的杀伤更为精准,在提高疗效的同时大幅减轻了毒副作用。
目前,随着2021年阿基仑赛注射液、瑞基奥仑赛注射液先后在中国获批上市,2022年西达基奥仑赛获美国FDA批准上市,CAR-T疗法已进入井喷期。这项技术在治疗各种恶性肿瘤方面取得了巨大进展,已成功应用于多种血液恶性肿瘤的治疗。
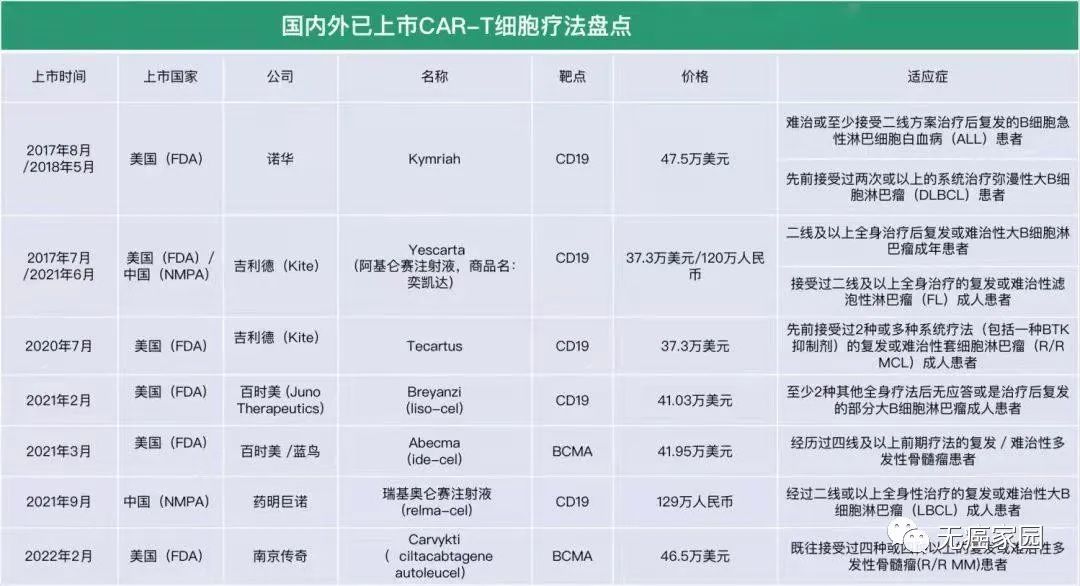
目前国内外已上市的CAR-T细胞疗法
然而,面对占比90%以上的实体瘤治疗领域,CAR-T疗法同样存在巨大的临床需求。值得一提的是,在实体肿瘤方面如消化系统肿瘤领域CAR-T取得了一定的疗效,包括食管癌、胃癌、肝癌、结直肠癌、胰腺癌、胆管癌等。
在2022年6月3~7日召开的2022年美国临床肿瘤学会(ASCO)年会上,众多国产CAR-T细胞治疗产品精彩亮相,纷纷展示其创新成果。作为全球肿瘤领域权威的学术交流盛会,此次有多家国内生物医药高科技公司参会,除乐以往以CD19、BCMA等靶点为主的血液肿瘤外,此次盛会还报道了很多新兴CAR-T靶点产品,更是覆盖众多实体瘤,如胃癌/胃-食管交界处癌、结直肠癌、恶性胸膜/腹膜间皮瘤等。
那么,接下来无癌家园小编就给各位癌友们详细介绍下这些走出国门,闪耀ASCO国际舞台的CAR-T细胞治疗产品的临床研究数据!
CAR-T疗法治疗胃癌/胃-食管交界处癌
科济药业CT041率先突破胃癌,首次公布中美注册临床试验数据
作为国际上首个针对Claudin18.2的CAR-T细胞,CT041早在2019年ASCO年会上就崭露头角,当时总客观缓解率为33.3%就已经惊艳世界,如今更加显著的疗效无疑是锦上添花!此次的临床数据展现出对消化系统肿瘤的良好治疗前景!
国产CAR-T疗法CT041首次亮相ESMO
2021年欧洲肿瘤内科学会(ESMO)年会上,由科济药业开发的靶向Claudin18.2(CLDN18.2)自体CAR-T候选产品CT041展现了其在消化系统肿瘤中的突出疗效,可谓是大放异彩!
研究数据格外亮眼!
1. 所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%。
2. 既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
3. 而且总体耐受性良好!
在此次ASCO大会上,科济药业展示了两篇关于CT041的研究成果,包括:(1)在美国进行的针对晚期胃癌和胰腺癌患者的多中心1b期试验的结果;(2)在中国进行的针对晚期胃癌/食管胃结合部腺癌患者的Ib/II期试验的安全性和初步疗效结果。
客观缓解率60%!多线治疗失败的胃癌患者抗肿瘤活性显著改善
此项Ib期试验在美国6个中心进行,截止2022年5月6日,已有14例患者入组,包括既往接受过至少两种前线系统治疗的5例胃癌/食管胃结合部腺癌(GC/GEJ)患者以及至少接受过一种前线治疗的9例胰腺癌患者。既往中位治疗线数为3线,共接受18个周期的CT041治疗。
14例患者按三个剂量水平(DL)给药,包括DL1为2.5~3.0×108细胞(n=6),DL2为3.75~4.0×108细胞(n=6)和DL3为6.0×108细胞(n=2)。

在胃癌/食管胃结合部腺癌患者的分组中,客观缓解率(ORR)为60%,其中完全缓解(CR)1例。此外,约80%(4/5)的疾病稳定(4例胰腺癌患者)患者中观察到了肿瘤的缩小。
中位缓解持续时间及中位无进展生存期均未达到。在DL1中观察到的客观缓解率(ORR)为16.7%,疾病控制率(DCR)为50%。在DL2中观察到的客观缓解率为33.3%,疾病控制率为83.3%。DL3组的两例患者在截止日期前尚未评估肿瘤疗效。未观察到剂量限制性毒性或治疗相关死亡。
此项临床试验数据显示,与历史治疗方案相比,CT041在既往接受多线治疗的胃癌患者中可能有显著的抗肿瘤活性改善。
疾病控制率达78.6%!57.1%患者首次输注后肿瘤达到部分缓解
此项Ib/II期试验旨在评估中国胃癌/食管胃结合部腺癌患者的安全性和有效性。在Ib期,使用3+3设计研究了CT041 2.5×108和3.75×108细胞的剂量水平。

截止到2021年12月22日,14例胃癌/食管胃结合部腺癌患者纳入Ib期,其中57.1%的患者转移器官数目≥3个,92.9%存在腹膜转移。大多数患者(85.7%)之前接受过二线治疗或包含氟尿嘧啶、奥沙利铂和紫杉醇的三联疗法治疗。35.7%的患者曾接受过PD-1/PD-L1抑制剂治疗。
最后有13例患者可进行肿瘤评估,1例患者退出评估。14例患者中有8例(57.1%)在CT041首次输注后的首次肿瘤评估即达到部分缓解,基于研究者评估客观缓解率和疾病控制率分别为57.1%和78.6%。
中位随访时间为8.8个月,中位无进展生存期(mPFS)和中位总生存期(mOS)分别为5.6个月和10.8个月。至数据截止日期,有7例患者仍然存活。
初步研究结果表明,CT041在接受晚期胃癌/食管胃结合部腺癌患者中具有显著疗效及可控的安全性。
CT041取得成就一览
2020年5月,FDA批准了CT041用于治疗claudin18.2阳性的胃、胃食管连接处或胰腺腺癌患者的研究新药(IND)许可;
2020年,美国FDA授予其孤儿药认定,用于治疗胃癌/胃食管结合部癌;
2021年,CT041先后获得欧洲药品管理局(EMA)的孤儿药认定、欧洲“优先药物”(PRIME)资格;
2022年,CT041获美国FDA授予“再生医学先进疗法”(RMAT)资格。
2022年3月3日,CT041获中国国家药品监督管理局(NMPA)药品审评中心(CDE)同意进入确证性Ⅱ期临床试验!
除此之外,还有多款靶向CLDN18.2的CAR-T细胞疗法。例如,由传奇生物研发的LB-1904,用于治疗胃癌或者胰腺癌,目前已经进入临床I期试验。此外,科济药业自主研发的重组人源化Claudin 18.2(CLDN18.2)单克隆抗体AB011,用于治疗晚期胃腺癌患者,目前也正在进行临床试验招募中。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性白血病、非霍奇金淋巴瘤、肝癌、胃癌、前列腺癌、甲状腺癌、卵巢癌、间皮瘤等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!
CAR-T疗法治疗结直肠癌
靶向结直肠癌!斯丹赛实体瘤CAR-T疗法闪耀国际
2022年6月3日~6月7日举行的美国临床肿瘤学会(ASCO)年会上,上海斯丹赛生物公司将以壁报的形式汇报GCC19CART的最新数据。
会上,斯丹赛将做基于自主研发的CoupledCAR®平台技术开发的首发候选产品GCC19CART的报告,该产品被开发用于治疗复发/难治性结直肠癌(R/R mCRC)患者。
2022年4月19日,上海斯丹赛生物宣布,其开发的实体瘤CAR-T产品GCC19CART被美国食品和药物管理局(FDA)授予快速通道资格。
GCC19CART是一款自体CAR-T治疗产品,是用于治疗复发难治转移型结直肠癌(R/R mCRC)的实体肿瘤领先疗法。不得不说,这项殊荣让CAR-T疗法在攻克实体瘤的道路上又迈出了坚实的一步,可喜可贺!
何谓复发难治型结直肠癌?美国国家综合癌症委员会(NCCN)认定的定义为:经多线标准治疗无效或发展转移的患者,这类患者只有极少的有效治疗选项。简而言之这类患者均经过多次常规治疗后无效,几乎没有治愈的可能。而美国最新的统计数据显示,复发难治转移型结直肠癌三线治疗的客观缓解率为1%~1.6%,总中位数生存期仅为6.4~7.1个月,有大批的患者未得到满足的医疗需求。
GCC19CART专门靶向并清除表达结直肠癌肿瘤标记物GCC的癌细胞。公开资料显示,靶向鸟苷酸环化酶C(guanylyl cyclase C,GCC/GUCY2C)属于受体鸟苷酸环化酶家族中的一员,是鸟苷酸、尿鸟苷酸和大肠杆菌肠毒素的受体,在胃肠道的液体和离子稳态中起关键作用。大约80%的结直肠癌患者肿瘤中GCC表达阳性。GCC在正常组织中的表达仅限于肠道内腔上皮细胞顶端,不在其他组织器官中表达,近年来研究发现,GCC在原发性结直肠癌细胞中稳定表达,而在转移性结直肠癌细胞中异常高表达,被认为是转移性结直肠癌的特异性标志分子之一。

在本次ASCO会议上,斯丹赛将会重点介绍来自中国5家临床中心2个剂量爬坡试验组21例患者的数据,验证了GCC19CART产品的安全性和初步疗效。其中13患者以1级剂量(1x106 cells/kg)入组,8名患者以2级剂量(2x106 cells/kg)入组。
截至2022年5月3日,根据实体肿瘤疗效评价标准(RECIST1.1),两种剂量水平的总体客观缓解率(ORR)为28.6%(6/21),即21例受试者中有6例通过治疗后观察到肿瘤体积缩减达到30%;1级剂量组客观缓解率(ORR)为15.4%(2/13),2级剂量组客观缓解率为50%(4/8)。其余4名受试者也被观察到反应良好,3个月内疾病控制率(DCR,即使用药物后,肿瘤的体积不再增长)为100%。
受试患者最常见的不良反应事件是细胞因子释放综合征(CRS)和腹泻,2例患者出现神经中毒,经皮质类固醇治疗后得到缓解。总的来说,GCC19CART在复发/难治性结直肠癌患者中显示出与剂量相关的良好的临床初步疗效以及可接受的安全性。
无癌家园临床招募
目前,无癌家园正在对一款CAR-T细胞疗法进行招募,主要是关于晚期实体瘤的临床研究。
其中涵盖14大癌种,包括结直肠癌、肺癌、乳腺癌、肝癌、膀胱癌、食管癌、肾癌、卵巢癌、子宫癌、黑色素瘤、胃癌、胰腺癌、滑膜肉瘤、头颈癌。
具体的入排标准可详情咨询无癌家园医学部,会进行详细的医学评估。
除了靶点GCC外,结直肠癌另外一个有效靶点GUCY2C也是近期研究热门,中国有一项针对7名患者的小型 CAR-T 研究,以结肠癌标志物GUCY2C为靶点。该研究发现,2~3 例患者出现部分缓解和疾病稳定。
CAR-T疗法治疗恶性间皮瘤
大多数CAR-T细胞疗法需要靶向癌细胞相关膜蛋白,而上海细胞集团运用一种新的方法除了靶向癌细胞相关膜蛋白,同时还分泌抗体改变肿瘤周围的微环境,这种方法源自由羊驼、骆驼自然产生的“纳米抗体”,羊驼体内的“纳米抗体”帮助CAR-T细胞治疗实体肿瘤。

此项临床试验共纳入10例晚期复发/难治性间皮瘤患者,所有患者至少接受过≥2线化疗线失败。7例患者分别接受了1至2次aPD1-mesCAR-T细胞回输,回输剂量范围在1×106~1.5×107CAR-T/kg,6例完成了回输后安全性和初步疗效评价。回输后的28天,患者接受增强CT或PET-CT评估产品的初步疗效。
6例己可评价的间皮瘤患者,完全缓解(CR)1例,部分缓解(PR)2例,客观缓解率为50%;在PD-L1阳性≥5%的间皮瘤患者,获得客观缓解3例,客观缓解率达到100%;截止发稿,入组的所有间皮瘤患者回输后,持续生存,最长生存时间已达22个月,获得完全缓解的患者持续无瘤生存已超过15个月,在完全缓解患者的外周血中持续检出CAR-T自分泌的PD-1纳米抗体达9个月。
临床研究表明,自分泌PD1纳米抗体间皮素CAR-T细胞能够通过减少肿瘤负担和延长生存期给复发/难治性间皮瘤患者带来临床获益,尤其是PD-L1阳性的肿瘤患者,实现了肿瘤清除和长期无瘤生存。
CAR-T疗法治疗多发性骨髓瘤
完全缓解率近100%!CD19/BCMA双靶点CAR-T疗法GC012F初战告捷
GC012F通过同时靶向CD19和BCMA靶点,能带来快速、深入且持久的治疗效果,帮助MM及B-NHL患者提高治疗响应率、并有望降低复发率。美国FDA已授予GC012F孤儿药资格认定,用于治疗复发/难治性多发性骨髓瘤(r/r MM)。
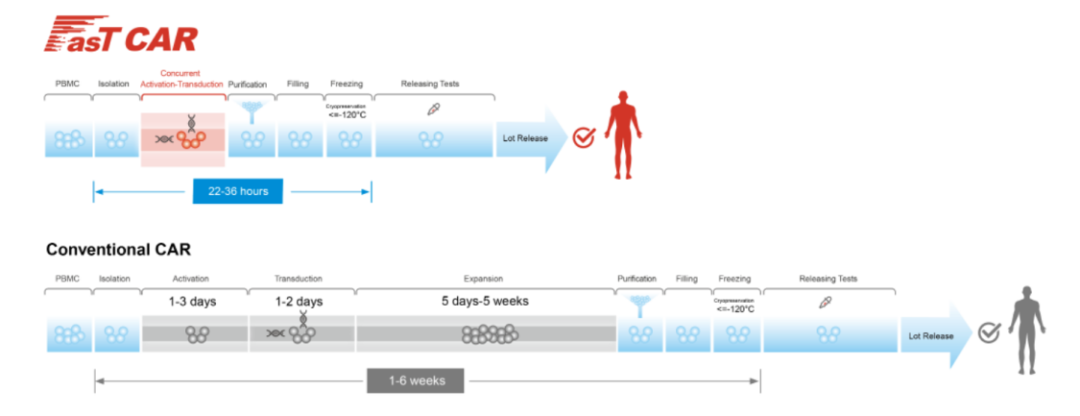
FasTCAR与传统CAR-T生产过程对比(图源亘喜生物官网)
我国亘喜生物宣布将在2022年ASCO大会上公布了CD19/BCMA双靶点FasTCAR-T GC012F治疗复发/难治性多发性骨髓瘤(r/r MM)的首次人体试验的最新研究结果。

截至2022年1月26日,28例接受过深度既往治疗的复发/难治性多发性骨髓瘤患者,分别接受GC012F三种剂量水平的单次输注治疗:1x105 细胞/公斤体重(DL1)、2x105 细胞/ kg(DL2)和 3x105 细胞/ kg(DL3),中位随访时间为6.3个月。
DL1、DL2、DL3不同剂量水平的客观缓解率(ORR)分别为100%(2/2),80%(8/10)以及93.8%(15/16),在所有可进行微小残留病灶(MRD)疗效评估的患者中,100%(27/27)的患者达到了MRD阴性;75%(21/28)的患者达到了MRD阴性严格意义上的完全缓解(MRD-sCR)。
在安全性方面主要是低级别的细胞因子释放综合征。未观察到任何级别的免疫效应细胞相关神经毒性(ICANS)。
如何寻求CAR-T细胞治疗
自从靶向BCMA的西达基奥仑赛被FDA批准上市外,复发或难治性多发骨髓瘤患者这个群体就受到大家的格外重视,对于这一血液系统的第二大常见恶性肿瘤,CAR-T疗法无疑给癌友们提供了新的治疗选择!
目前无癌家园也正有两款针对多发性骨髓瘤的CAR-T疗法、针对B细胞急性淋巴细胞白血病的一款靶向CD19/CD20/CD22三靶点的CAR-T临床试验
正在临床招募中,想要参加的患者可提交病理报告、治疗经历、出院小结等资料至无癌家园医学部初步评估病情。
除了上述提到的CAR-T疗法的临床研究外,此次ASCO大会上还公布了药明巨诺的瑞基奥仑赛治疗中国难治/复发性弥漫大B淋巴瘤患者的多中心II期RELIANCE临床研究的2年随访结果、传奇生物的西达基奥仑赛治疗多发性骨髓瘤的最新长期随访数据、原启生物的OriCAR-017治疗复发/难治性多发性骨髓瘤的I期研究数据、供体来源的CD7 CAR-T对复发/难治性T细胞急性白血病的治疗效果,无癌家园小编将会在后续几天为大家继续介绍,敬请期待!
延伸阅读:临床CAR-T和商业CAR-T,有何区别
临床CAR-T的招募由医药公司或具有临床科研资质的医院开展,患者需要评估身体状况、疾病进展等适应症是否能够入组,其筛选较为严格,除了适应症外,还要综合考虑患者的年龄、用药经历、既往病史等诸多条件,有一项不符合都无法成功入组。
相比之下,商业CAR-T的要求就较为宽松,除了符合病情符合适应症外,再综合判断身体条件及疾病进展情况即可,若符合条件且有一定经济能力的患者,在标准治疗失败后可以尝试CAR-T疗法,这不失为一个新的治疗选择。
特别提醒
需要特别提醒病友们的是,临床试验并不适合极晚期的患者,比如进展期的脑转移患者,体力评分不佳或卧床不起,肝肾功能低下和贫血较严重者通常无法入组,需要提升免疫,调整身体状态后再进行评估,可以通过无癌家园营养免疫的相关专家寻求改善晚期状态的方案。此外,正在接受正规治疗的早期患者也要多关注新药进展,一旦病情进展,可以寻求新药的临床试验。
CAR-T疗法的获批将为中国患者带来更多临床获益
阿基仑赛注射液、瑞基奥仑赛注射液、西达基奥仑赛的纷纷获批上市,首先对符合其适应症的患者又增加了一种新的治疗选择,也就多了一份治愈的希望。
其次,这三次的获批意味着CAR-T疗法已经被国内外环境所接纳,未来更多CAR-T产品或适应症的研发及审批都将得到提速。
经过近30年的发展,CAR-T细胞疗法已然兴起,该领域不会孤立的发展。目前已经有一些试验表示,很可能最好的肿瘤响应需要特异性的CAR-T疗法结合小分子治疗、免疫调节、化疗和基于抗体的治疗等多种治疗的协同作用,这些试验不提供特定的CAR,而是针对一些可能的抗原靶点设计CAR,这些抗原靶点取决于病人疾病的免疫表型。
在个性化医疗的时代,无论是单一疗法还是联合疗法,CAR-T无疑是医药领域火热的研究对象,希望今后能够取得更多突破,在血液肿瘤和实体瘤的治疗上展现其独特的实力!
参考文献
https://meetings.asco.org/meetings/2022-asco-annual-meeting/288/program-guide/scheduled-sessions
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
癌症复发的"头号凶手"
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

停药4年仍无癌!TIL细胞联合伊匹单抗,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

《CAR-T三人行》第十五期|魏双教授:
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

刚刚!PD-1抑制剂纳武利尤单抗新适应证
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
4.23 全国肿瘤防治宣传周第九弹!同心
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【抗BTLA单克隆抗体】新一代靶向药JS
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




