CAR-NK细胞疗法,有前途的癌症肿瘤细胞免疫疗法
CAR-NK细胞疗法,有前途的癌症肿瘤细胞免疫疗法
随着嵌合抗原受体工程化T 细胞(CAR-T)在治疗血液肿瘤方面的巨大成功,开发CAR工程化自然杀伤细胞(CAR-NK)的兴趣迅速增长。本文着眼于CAR-NK细胞基因工程设计和临床应用的进展,讨论当前挑战和未来前景。
NK细胞占人类外周血白细胞的5%~15%,表达CD56,不表达CD3和T细胞受体(TCR)。人NK细胞可根据CD56和CD16(Fcγ受体Ⅲ或FcγRⅢ)的表达进一步分为两个亚组:CD56dim CD16high NK细胞和CD56bright CD16low/- NK细胞。CD56dim CD16high NK 细胞占外周血NK细胞的85%~95%,发育成熟,细胞毒性强,CD56bright CD16low/- NK细胞发育不成熟,细胞毒性低。
NK细胞发育不进行体细胞基因重排,不表达抗原特异性受体,是一种非特异性肿瘤杀伤细胞。NK细胞受一系列激活和抑制受体信号调控,其杀伤力取决于抑制信号和激活信号之间的平衡。HLA低表达的肿瘤细胞由于KIR介导的抑制作用下降而更易于被NK细胞杀伤。
NK细胞还通过抗体依赖性细胞介导的细胞毒性(ADCC)杀伤靶细胞。NK细胞膜上的CD16可识别与靶细胞表面结合IgG的Fc部分,通过ITAM信号途径激活NK细胞,通过多种途径诱导靶细胞凋亡(如释放穿孔素、颗粒酶等细胞毒物质杀伤靶细胞,Fas/FasL、TNF-α/TNFR-I介导靶细胞凋亡等)。活化的NK细胞还分泌各种细胞因子和趋化因子,进一步募集并活化其他免疫细胞,如T细胞、树突状细胞和巨噬细胞。
1、CAR-NK细胞优势
过继细胞疗法旨在利用人体免疫系统消除癌症。早期临床研究显示LAK或TIL细胞疗效不够强大。通过在免疫细胞(包括T细胞、NK细胞、NKT细胞和巨噬细胞)表达抗原特异性TCR或嵌合抗原受体(CAR)可明显提高免疫细胞抗癌效果。
与CAR-T细胞相比,CAR-NK细胞有一些显著优势,包括:
(1)更好的安全性
未修饰的NK细胞及CAR-NK细胞安全性已在临床研究中得到证明,如没有细胞因子释放综合征(CRS)和神经毒性,异体来源的CAR-NK不会诱发移植物抗宿主病(GVHD),这可能是由于活化的CAR-T细胞分泌IL-1α、IL-1Rα、IL-2、IL-2Rα、IL-6、TNF-α、MCP-1、IL-8、IL-10 和IL-15,与CRS 和神经毒性高度相关,而活化的NK 细胞通常分泌的是IFN-γ和GM-CSF 。
(2)有多种激活机制
除了以CAR依赖性方式杀死肿瘤靶细胞外,CAR-NK细胞具有天然的细胞毒活性,可通过非CAR依赖的机制激活,例如NCR、NKG2D、共刺激受体DNAM-1(CD226)和KIR(KIR2DS1、KIR2DS4和KIR2DL4)。此外,NK细胞可通过CD16介导的ADCC杀伤肿瘤细胞。因此,NK细胞具有广谱高效的杀瘤活性。
(3)可生产"现货"(off-the-shelf product) 产品
(4)可对CAR-NK细胞进行改造,使其靶向多种抗原,增加对实体瘤的浸润,克服耐药的肿瘤微环境,最终实现有效抗肿瘤反应。
2、CAR-NK 细胞来源
同种异体NK 细胞的低GVHD风险使CAR-NK细胞的来源多样化,包括NK92细胞系、外周血单核细胞(PBMC)、CD34+ 造血祖细胞(HPC)、脐带血(UCB)细胞和诱导多能干细胞(iPSC)。
当前CAR-NK细胞临床试验多使用NK92细胞系,因它具有无限体外增殖能力。但作为肿瘤细胞系的NK92细胞具有固有缺陷,包括潜在的致瘤风险,缺乏CD16和NKp44表达,输注前需要进行辐射处理,因此不是最理想细胞来源。
PBMC是原代NK细胞重要来源,细胞可来自HLA匹配或不匹配供体。PBMC衍生的CAR-NK细胞90%以上是CD56dimCD16+ NK细胞,属于成熟细胞,表达大部分激活受体,因此细胞毒性强,但增殖能力较弱。
UCB来源的NK细胞由于单份UCB体积有限,分离得到NK 细胞数量少,可能无法满足临床需要。此外UCBNK细胞不成熟,某些黏附分子、CD16、KIR、穿孔素和颗粒酶B表达较低,而抑制性分子如NKG2A的表达较高,导致活性不如PBMC 来源的CAR-NK细胞。
采用CD34+ HPC分化是获得大量成熟NK细胞的另一种方法。可从骨髓、胚胎干细胞、动员的PBMC或UCB中分离CD34+ HPC,然后扩增并分化为成熟的NK细胞。
由于具有无限增殖能力,iPSC已成为重要CARNK细胞来源。与分化的NK细胞相比,iPSC可更稳定表达CAR。CAR-iPSC可在含有SCF、VEGF 和BMP4的培养基中分化为HPC,然后用含有IL3、IL-15、IL-7、SCF 和FLT3L的培养液分化为CARNK细胞。但是与UCB-NK细胞相似,iPSC生的NK细胞通常具有不成熟表型,KIR和CD16表达较低而NKG2A表达较高。
综上,CAR-NK细胞易于取材、生产,具备通用性,可根据治疗需求提供现货产品。
3、CAR的结构
大多数CAR-NK细胞研究都使用CAR-T细胞设计的CAR,少部分是针对NK细胞专门设计的CAR。含有4-1BB共刺激域(scFv-CD8TM-4-1BB-CD3ζ)的第二代抗CD19CAR 可在原代NK细胞中表达。生产的NK细胞可特异性杀伤CD19+急性淋巴细胞白血病细胞。针对HER2、EGFR或EGFR变体Ⅲ和CS1的CAR-NK也已开发出。此外,具有不同信号传导域(包括CD3ζ、DAP10和DAP12)的原代CAR-NK细胞或CARNK92细胞也有报道。
4、CAR基因转染方法
开发CAR-NK细胞的主要障碍之一是原代NK细胞缺乏有效基因转染方法。
逆转录病毒载体转染NK细胞效率为27%~52%。编码分泌型IL-15或膜结合型IL-15(mIL-15)基因的逆转录病毒的转导效率可达70%,然而这种方法有两个弊端:一是病毒可插入到基因组,导致细胞癌变;二是逆转录病毒转染会抑制原代NK细胞活力。
慢病毒具有较低遗传毒性和插入诱变作用,但慢病毒在原代NK细胞中的转导效率很低,通常需要多轮转导。修饰的狒狒包膜糖蛋白(BaEVgp)假型化的慢病毒载体可提高转染效率。同样,用长臂猿猿猴白血病病毒的包膜蛋白假型化的慢病毒也能有效地转导原代NK细胞。
电穿孔和脂质体转染也可将外源基因有效传入NK细胞,而且转入的基因表达快, 细胞凋亡水平较低,个体间变异性较小。但电穿孔和脂质体转染的外源DNA不会整合到靶细胞的基因组中,因此转基因的表达是瞬时。
DNA转座子是可移动的DNA元件, 可通过“ 剪切和粘贴”机制在载体和染色体之间有效转座,产生稳定表达CAR分子的CAR-iPSC-NK细胞。PiggyBac(PB)和“ 睡美人”(SB)是两个最常用转座子系统,由两个部分组成:介导“剪切和粘贴”功能的转座酶和侧接两个末端反向重复序列(TIR)的DNA载体。
与病毒载体相比,这些转座子系统具有多个优势,如免疫原性低、生物安全性高、生产成本低及具有转导长度大于100 kb大基因片段的能力。然而转座子系统在转导原代NK细胞中的适用性仍需要进一步完善,以克服低转导效率和质粒DNA电穿孔导致NK细胞死亡等缺点。
因此,开发有效基因转染方法是未来CAR-NK细胞的研究重点。
5、体外扩增CAR-NK 细胞
NK细胞仅占PBMC一小部分,因此扩增足够数量NK细胞仍然是主要挑战。IL-2、IL-15、IL-12、IL-21和IL-18是常用的体外原代NK细胞扩增因子,但扩增效率不够高。
采用与刺激性细胞共培养的方法比细胞因子的扩增效率高。常用的刺激细胞包括Wilms肿瘤细胞系、自体PBMC、EB 病毒转化的淋巴母细胞、K562细胞、表达mIL-15 或4-1BB配体(4-1BBL)的K562 细胞、共表达mIL-15 和4-1BBL的K562细胞等。但这些饲养细胞激活的原代NK细胞连续增殖8~15周后会发生衰老。
肿瘤细胞在与NK细胞共培养之前则必须经过照射,以确保最终产品中没有存活的饲养细胞。表达mIL-15的NK细胞在体外和体内均表现出优异增殖和存活率,并对肿瘤细胞具有更高细胞毒性。总体上目前还缺乏高效、安全的NK细胞体外扩增方法。
6、CAR-NK 细胞临床应用
CAR-NK细胞临床研究还处于早期阶段。2016年之前只开展了2项试验(NCT01974479、NCT00995137),至今仍在进行中。2016年之后进入临床研究的CAR-NK细胞项目明显增加,目前有19项研究已在Clinicaltrials.gov 中注册,其中11项靶向造血系统恶性肿瘤,针对抗原包括CD19、CD22、BCMA、CD33和CD7。
针对转移性实体瘤的试验中,靶向抗原包括HER2、PSMA、间皮素、ROBO1、MUC1和NKG2DL。4项原代NK细胞的研究中有3项使用mRNA 电穿孔介导瞬时CAR表达。这些试验中仅3项发表了研究结果。其中编号为NCT03056339的临床研究纳入11名高危CD19+ B细胞恶性肿瘤患者,在接受UCB衍生的CAR-NK细胞移植后11位患者中有7 位完全缓解,而且未出现严重副作用。
Fate Therapeutics 公司开展的Ⅰ期临床试验(NCT04245722)采用iPSC制备CAR-NK细胞(代号FT596),用于治疗CD19+B 细胞恶性肿瘤。FT596表达3种蛋白:CD19-CAR、高亲和力CD16及IL-15受体融合蛋白。自分泌IL-15可支持CAR-NK细胞在体内长久存活。当FT596与治疗性抗体一起使用时可有效克服由于CD19抗原丢失而引起的肿瘤细胞抵抗。
7、CAR-NK 细胞未来研究方向
与CAR-T细胞不同,CAR-NK细胞可通过非CAR依赖性方式杀伤癌细胞。因此。可研发不表达活化信号的CAR,该CAR虽然不会诱导直接靶细胞杀伤,但会促进NK细胞黏附靶细胞,触发NK 细胞自然杀伤机制,而不会杀伤表达相同抗原的正常细胞。
使用先进基因工程技术使NK细胞同时表达其他细胞因子、抗体和蛋白酶等,从而促进其增殖、迁移和浸润,或改善肿瘤微环境。
与T细胞一样,活化NK细胞也表达一些T 细胞免疫检查点分子(如PD-1、CTLA-4、LAG3 和TIM3),它们可能会抑制NK抗肿瘤活性。因此,通过基因编辑敲除检查点分子也是提高CAR-NK活性的途径。
NK细胞表达CD16并发挥ADCC介导的肿瘤杀伤作用。但细胞因子的激活或靶细胞刺激通常会导致NK细胞CD16表达明显下降。对NK细胞进行基因改造,使其稳定表达CD16可提高CAR-NK活性。
总之,CAR-NK细胞作为一种新型的癌症细胞免疫疗法将提高癌症患者的生存率,具有广阔的前景。
内容来源:医学参考报 生物谷
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
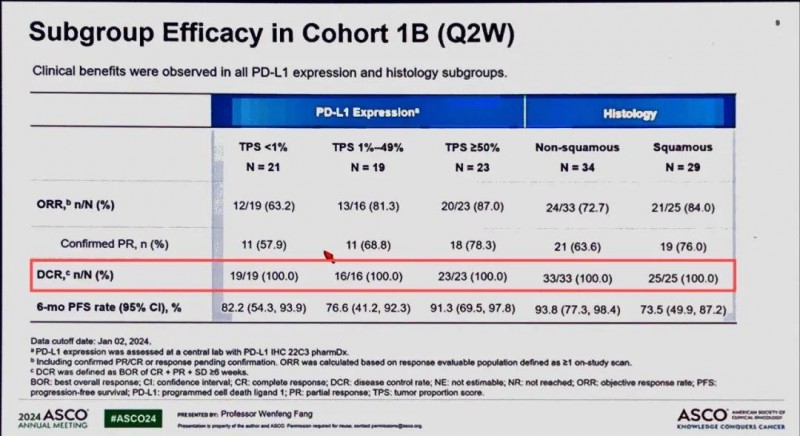
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
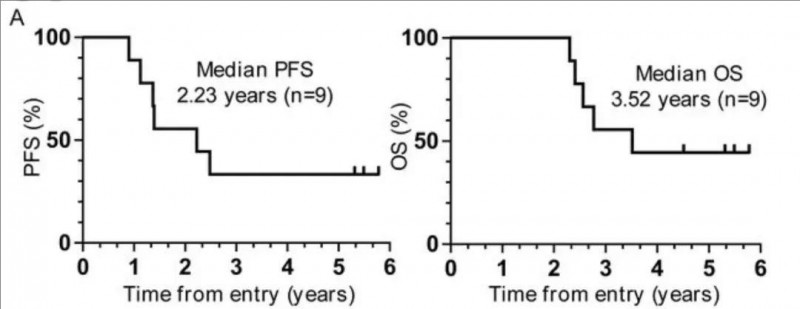
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

早期前列腺癌术后五年生存率超99%,但防
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
67%的肝癌患者生存期超2年!国产实体瘤
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




