一文读懂:肿瘤的生物治疗——肿瘤疫苗
一文读懂|肿瘤生物治疗,肿瘤生物疗法-抗癌疫苗,抗肿瘤疫苗,癌症肿瘤疫苗分类
肿瘤的免疫及其逃脱机制实际上来说只是属于生物治疗(Biotherapy)的一部分,而后者是一个广泛的概念,涉及一切应用生物大分子进行治疗的方法。而生物治疗在肿瘤领域的应用,使得患者多了一种治疗手段。这是一种新兴的、具有显著疗效的肿瘤治疗模式,经过不断探索,其安全有效、不良反应小等优点已逐渐被广大医务工作者和患者接受,成为继手术、放疗、化疗肿瘤治疗三大法宝之后的第四种新型肿瘤治疗模式。目前总体上生物治疗主要包括肿瘤免疫治疗和基因治疗,而肿瘤免疫治疗下主要包括肿瘤疫苗、免疫调节剂、过继性细胞免疫治疗、免疫结合点阻断治疗四大类。这期我们来简单谈一谈肿瘤免疫治疗下的——肿瘤疫苗
作者:Riza Eraw1 Eleanor Edward1 林亮2
单位:1中山大学中山医学院肿瘤研究中心 2中山大学肿瘤防治中心
肿瘤疫苗与肿瘤免疫治疗
肿瘤疫苗是指利用肿瘤抗原,通过主动免疫方式诱导机体产生特异性抗肿瘤效应,激发机体自身的免疫保护机制,达到治疗肿瘤或预防复发的作用,属于主动免疫治疗范畴。根据肿瘤抗原组分和性质的不同,肿瘤疫苗可分为以细胞为载体的肿瘤疫苗、病毒疫苗、蛋白/多肽疫苗、核酸疫苗(DNA疫苗)、抗独特型疫苗和异种疫苗等。
而根据肿瘤疫苗的用途可以将其分为两类:一类是预防性肿瘤疫苗,可以通过接种此类疫苗减少或消除肿瘤发生的几率;另一类是治疗性肿瘤疫苗,其主要以肿瘤抗原为基础,用于放化疗或手术切除后的辅助治疗。此外,根据肿瘤疫苗的来源又可将其分为肿瘤细胞疫苗、树突状细胞(DC)疫苗、DNA疫苗、多肽疫苗、CTL表位疫苗、靶向肿瘤新生血管疫苗等。当然,这只是目前传统常见的分类方法。
实际上,在肿瘤生物治疗领域发展日益迅速,就在去年的2019美国ASCO大会盛宴上,就有三项mRNA疫苗、两项多肽癌症疫苗、两项DC疫苗、两项基因疫苗的研究报告,引起广泛关注。又例如刚刚于4月13日发表于《Acta Biomater》上的综述从纳米角度阐述了纳米技术作为CAR-T疗法的研究情况[1]。新技术的出现不断给这个领域带来挑战与机遇,因而传统理论和方法也在一次又一次的认识中不断更新,实际上肿瘤疫苗与免疫治疗中的其他治疗都是是紧密结合、相互交叉,并没有绝对的分离,在一种技术的发展中必然掺杂有另一技术的成分。
癌症肿瘤疫苗分类
01、肿瘤细胞为载体的肿瘤疫苗
原始的肿瘤细胞疫苗往往不能诱导很强的免疫应答。为改变这不足,目前大部分都采用分子修饰技术改变肿瘤细胞的免疫特性或遗传背景,以提高其免疫原性,诱导更强的免疫应答,常见的有MHC分子转基因肿瘤疫苗、共刺激分子转基因的肿瘤疫苗、细胞因子转基因的肿瘤疫苗、多因素修饰的肿瘤疫苗。然而由于其本身具有免疫原性差、有致瘤可能等局限,单纯的传统肿瘤细胞疫苗目前大部分已被DC疗法、CAR-T、PD-1/L等新疗法进行取代或改良。
02、树突细胞(DC)肿瘤疫苗
目前大部分 DC 疫苗都是从患者体内分离 DC 细胞或 DC 单核前体细胞通过体外负载肿瘤抗原(DC/肿瘤融合细胞),再回输给患者。基于其强大的识别、加工、呈递及T细胞的致敏、激活能力,DC细胞在肿瘤的免疫中发挥有极其重要的作用。近年来,DC 免疫治疗已经从一种简单的体外疫苗培养,发展到更高级的直接在体内针对目标抗原激活特异的 DC 亚群[2]。经过不断的修饰和改良,DC疗法在临床研究中取得了突破性的进展,并已成为肿瘤免疫治疗领域的研究热点[3]。
03、CAR-T
CAR-T,即Chimeric Antigen Receptor T-Cell Therapy(嵌合抗原受体T细胞疗法),是几年来一种比较新式的肿瘤免疫疗法,并不是真正意义上的疫苗范畴。
CAR-T简单来说就是从患者体内提取出T细胞,通过基因工程技术,人工改造肿瘤患者的T细胞,在体外大量培养后生成肿瘤特异性CAR-T细胞,再将其回输入患者体内用以攻击癌细胞,而所谓基因修饰技术,即将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,使T细胞直接与肿瘤细胞表面的特异性抗原相结合而被激活,与DC相比更加高效与精准[4]。
然而,冰冻三尺非一日之寒,肿瘤细胞疫苗的成功也并非一蹴而就,回顾细胞免疫治疗LAK,DC,CIK,DC-CIK,CAR-T,TCR-T,NK,CAR-NK, TILs等先后登上而又退出舞台,几经沉浮才换来了今天的成就。
04、蛋白/多肽疫苗
多肽疫苗是通过激活患者自身的免疫系统,利用肿瘤抗原肽诱导机体产生相应的体液免疫和细胞免疫反应,增强机体的抗癌能力,阻止肿瘤的生长、扩散和复发,以达到清除或控制肿瘤的目的[5]。肿瘤抗原进入细胞后,需要抗原递呈细胞(APC)能够识别并摄取外源抗原,进而启动免疫抗肿瘤机制[6]。在2019 ASCO大会上,基于新抗原的多肽疫苗的临床疗效表明新抗原疫苗能够激活T细胞进而杀伤肿瘤细胞。
最近,《Cancer Immunol Immunother》发表的一项双盲、安慰剂对照和随机II期研究表明,混合多肽疫苗组合多烯紫杉醇和地塞米松治疗在去势抵抗性前列腺癌(CRPC)研究表明虽然无进展和总生存(OS)在组间没有差异,但20种混合多肽(KRM-20)是安全的,而且带来CRPC患者中与对照组相比具有相似的PSA减少、HLA匹配的特异性多肽CTL和lgG响应增加的好处[7]。
05、核酸疫苗
核酸疫苗常用皮肤、肌肉、静脉接种重组DNA[8],一般认为, 含抗原基因的核酸疫苗被导入宿主骨骼肌细胞或皮肤细胞后, 可在细胞内表达相应的蛋白质抗原, 经加工后形成的多肽抗原可与宿主细胞MHC I类和Ⅱ类分子结合, 并被提呈给宿主的免疫识别系统, 从而可引起特异性体液和细胞免疫应答。
目前这类疫苗正在取得快速的发展,前不久的4月4日发表在《Curr Opin Immunol》指出DNA疫苗是处在发展的黄金期,新的DNA传递的改进包括喷射传递,基因枪传递以及先进的电穿孔(EP)与其他先进技术相结合都在核酸疫苗中发挥重要作用[9]。而mRNA疫苗作为一种新的核酸疫苗,与DNA相比具有更有安全、有效、低成本[10]的特点,具有强劲的发展势头和广阔的前景。
安全性问题
虽然目前肿瘤疫苗的研究得到快速发展,研究成果层出不穷,但相比与传统的治疗来说仍然处于起步阶段,不像传统的放疗、化疗,其安全性仍然需要进一步的论证,有许多机制仍然需要进一步的探索,而每年的ASCO大会公布的结果更多的是具有引领性意义,在真正应用和临床推广上仍然有一段路要走。
例如在CAR-T刚兴起时,其并非完美无瑕,其所带来的副作用包括细胞因子紊乱、发热、心脏、神经毒性等都是不可忽略的缺陷。而今天,改良版的CAR-T疗法已经已经取得了很大的进展,在尽可能保持疗效的基础上保证治疗的安全性。因此有理由相信,在不久的将来,随着新技术的不断出现,肿瘤疫苗会取得更加瞩目的成就,同时也可能会对我们现有的认知带来挑战,也期待有更多的新成果出现。
参考文献
[i] Nanotechnology and Immunoengineering: How nanotechnology can boost CAR-T therapy. Acta Biomater. 2020 Apr 13. pii: S1742-7061(20)30212-9. doi: 10.1016/j.actbio.2020.04.015.
[ii] 王建莉,路小超,封贺,赵同军.树突状细胞与肿瘤免疫系统相互作用研究进展[J].生命科学,2020,32(02):188-194
[iii] Targeting Toll-like receptor 3 in dendritic cells for cancer immunotherapy. Expert Opin Biol Ther. 2020 Apr 7:1-10. doi: 10.1080/14712598.2020.1749260.
[iv] Engineering CAR-T cells. Biomark Res. 2017 Jun 24;5:22. doi: 10.1186/s40364-017-0102-y. eCollection 2017.
[v] Cancer immunotherapy targeting neoantigens. Semin Immunol. 2016 Feb;28(1):22-7. doi: 10.1016/j.smim.2015.11.002. Epub 2015 Nov 30.
[vi] 万岩岩,钟静静,高宁宁,刘宇,黄馨萍,刘兵,王竹林,靳广毅,刁昱文.肿瘤多肽疫苗研究进展[J].动物医学进展,2015,36(02):101-105.
[vii] Mixed 20-peptide cancer vaccine in combination with docetaxel and dexamethasone for castration-resistant prostate cancer: a randomized phase II trial. Cancer Immunol Immunother. 2020 Feb 5. doi: 10.1007/s00262-020-02498-8.
[viii] 薛振伟,周小林.肿瘤核酸疫苗研究进展[J].中国疫苗和免疫,2010,16(02):183-186.
[ix] DNA vaccines: prime time is now. Curr Opin Immunol. 2020 Apr 4;65:21-27. doi: 10.1016/j.coi.2020.01.006.
[x] mRNA vaccines — a new era in vaccinology. Nat Rev Drug Discov. 2018 Apr; 17(4): 261–279.
文章来源:医脉通血液科
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
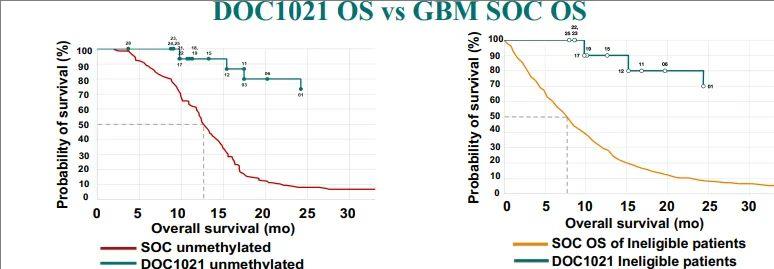
生存率提升至88%!新型树突细胞疫苗DO
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
绝境逆袭!传统化疗束手无策时,WT1 D
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
早期膀胱癌术后五年生存率高达90%,这5
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

探秘肺癌手术强院:医科院肿瘤医院-胸外科
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

首战告捷!WT1-DC疫苗联合多药化疗,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肺癌根治术后如何预防高危复发?五大疗法齐
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







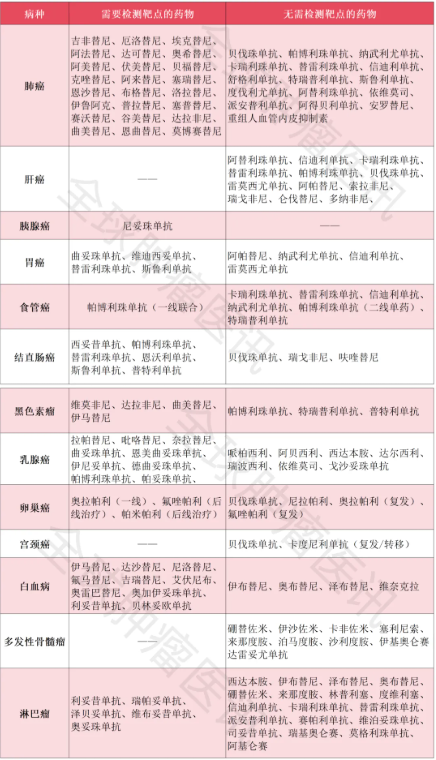
![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




