T细胞免疫疗法新靶标HPK1的识别及其抑制剂发现
T细胞疗法新标靶HPK1靶点的识别及其抑制剂发现
内源性或过继转移的细胞毒性T细胞是抗肿瘤免疫的重要介质。持续性的抗原暴露会导致T细胞逐渐分化为耗竭状态,其特征是效应器功能和增殖能力的层次性丧失,以及明显的转录、表观遗传和代谢变化。如何预防T细胞耗竭并拓展效应T细胞功能是目前肿瘤免疫学中最紧迫的问题之一。

造血祖细胞激酶HPK1(HematopoieticProgenitor Kinase1)是一种免疫抑制调节激酶,在造血干细胞中限制性表达。HPK1是T细胞受体(TCR)的负信号调节剂。TCR激活后,胞质HPK1被募集到细胞膜附近,活化的HPK1磷酸化衔接蛋白SLP76,以此激活SLP76作为负调节蛋白14-3-3π的停靠位点,最终导致TCR信号复合物的不稳定,从而下调TCR信号。
先前的一项研究分析指出,HPK1激酶活性可以抑制CD4+ T细胞、CD8+ T细胞和树突状细胞(DC)的免疫功能,并确定此激酶的失活可以引发抗肿瘤免疫反应。最近,清华大学廖学斌课题组报道了HPK1在T细胞免疫疗法中的功能意义,并设计出HPK1小分子抑制剂及靶向其的PROTAC分子用以增强抗肿瘤免疫效应。
研究人员首先在公开的肿瘤数据库中分析得知,MAP4K1(编码HPK1)与T细胞耗竭相关的信号分子(如:PDCD1、TIGIT、CTLA4、LAG3等)呈现很强的正相关性。在低级别胶质瘤(LGG)、浸润性乳腺癌(BRAC)等肿瘤中显著的表现出,MAP4K1低表达的患者有着更长的生存期。
接下来,研究人员选取多发性骨髓瘤组织活检,分选测量T细胞中HPK1与免疫抑制分子的蛋白表达情况,实验结果可知在耗竭的T细胞中,HPK1的表达上调。此实验结果表明HPK1与肿瘤浸润性T细胞耗竭的正相关性,HPK1可能是调节T细胞耗竭并抑制抗肿瘤免疫反应的一个重要激酶。

继而,研究人员在B16-F10小鼠黑色素移植瘤模型中验证了MAP4K1基因敲除小鼠可增强T细胞抗肿瘤活性并抑制肿瘤的生长。
首先他们通过抗体在小鼠体内分别耗尽内皮细胞(NO)、CD8+ T细胞、CD4+ T细胞和自然杀伤细胞(NK),发现在CD8+ T细胞和CD4+ T细胞耗尽后MAP4K1敲除小鼠的抗肿瘤效果被消除,表明HPK1主要介导T细胞的免疫抑制。
然后使用流式细胞荧光分选技术获取在耗竭的T细胞中已知的抑制分子,发现与WT相比 MAP4K1敲除的CD8+T细胞表达PD-1、TIM-3、LAG-3的细胞数变少。
并且在MAP4K1敲除小鼠中产生了更多的CD107a、脱粒酶B、干扰素γ和肿瘤坏死因子α。这些结果表明,相比于WT CD8+TIL(肿瘤浸润性淋巴细胞),MAP4K1-/- CD8+ TIL不仅表现出耗竭的减少,还展现出更强的抗肿瘤活性。

为了更好地理解HPK1敲除是否会影响肿瘤浸润性淋巴细胞的转录谱,研究人员进行RNA-seq分析发现在HPK1敲除细胞中PRDM1(表达Blimp1)和GATA3表达显著降低,TBX21表达增加。在B16-F10移植瘤小鼠中,验证了在MAP4K1敲除的T细胞中Blimp1显著增加。IP-MS和FACS等实验表明HPK1通过NF-κB信号通路调节Blimp的表达,HPK1-NF-κB-Blimp1信号轴驱动CD8+ TIL耗竭。

研究人员接下来建立了三种敲除MAP4K1的CAR-T细胞模型,在B淋巴细胞瘤、乳腺癌和多发性骨髓瘤的体内实验中,MAP4K1敲除的CAR-T细胞比PDCD-1敲除的CAR-T细胞表现出更好的抗肿瘤功能。令人惊喜的是在乳腺癌实体瘤小鼠中,相较于PD-1敲除与WT相比生存期没有明显改善,但MAP4K1敲除的CAR-T治疗有着更长的生存期。

通过上述实验,研究人员认为通过小分子抑制或PROTACs降解HPK1,可以作为联合肿瘤免疫治疗的新策略。研究人员开发了一系列HPK1的小分子抑制剂,其中ZYF0033可以很好地降低SLP76的磷酸化,其可以降低T细胞的耗竭。然后基于ZYF0033又设计出一系列靶向HPK1的PROTAC分子,如SS44、SS47等。小分子抑制剂和PROTAC分子联合CAR-T免疫治疗表现出更好的抗肿瘤效应。

综上,研究人员发现HPK1通过NF-κB信号通路激活Blimp表达,从而介导T细胞的功能障碍。HPK1可以作为良好的药物靶标,MAP4K1 KO CAT-T细胞或HPK1小分子抑制剂/PROTAC分子联用都能增强免疫治疗疗效。为通过免疫途径进行新靶标的确认及先导化合物的发现提供了重要基础。
参考文献:
1、Siet al., Hematopoietic Progenitor Kinase1 (HPK1) Mediates T Cell Dysfunction andIs a Druggable Target for T Cell-based Immunotherapies, Cancer Cell (2020).
2、Wang,X., Li, J.P., Chiu, L.L., Lan, J.L., Chen, D.Y., Boomer, J., and Tan, T.H. Attenuationof T cell receptor signaling by serine phosphorylation-mediated lysine 30ubiquitination of SLP-76 protein. J. Biol. Chem (2012). 287, 34091–34100.
文章来源:分子设计 ,作者王婷婷 & 张健
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
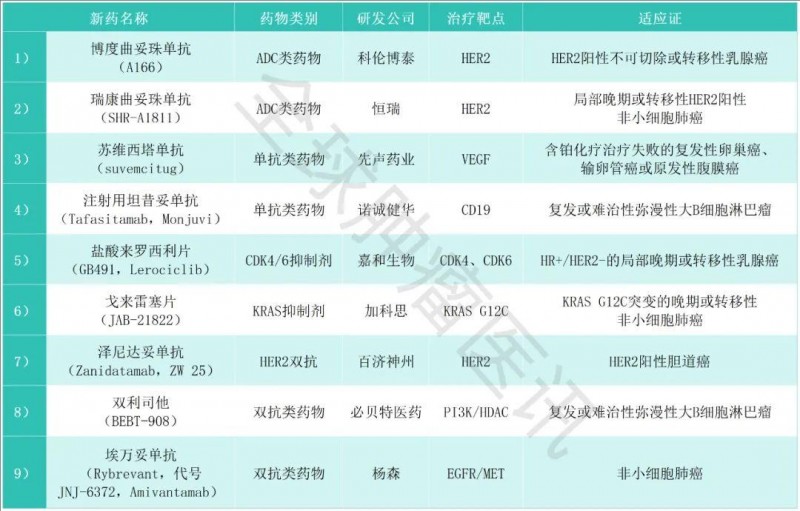
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




