7月最新|抗癌新药井喷上市!上百种癌症靶向,免疫治疗药物免费用药招募信息公布
肿瘤临床试验招募,肿瘤药物临床试验招募,肿瘤临床试验,癌症新药临床试验
2020年,各类癌症的新药井喷上市,仅上半年,FDA就批准了32款癌症新疗法,众多癌症更是迎来史上首款靶向疗法,可谓是里程碑式的重大突破,让更多幸运的病友等到了新的治疗选择和希望。
非小细胞肺癌:Capmatinib(卡马替尼),Selpercatinib(LOXO-292);
小细胞肺癌:Durvalumab(德瓦鲁单抗),Lurbinectedin(鲁比卡丁);
乳腺癌:Tucatinib(图卡替尼);
三阴乳腺癌:Trodelvy;
卵巢癌:Niraparib(尼拉帕尼),Olaparib(奥拉帕尼);
胃肠间质瘤:Ayvakit
肝癌:Nivolumab(纳武单抗)+Ipilimumab(伊匹单抗),Atezolizumab(阿特珠单抗)+Bevacizumab(贝伐单抗);
结直肠癌:Encorafenib(康奈菲尼)+Cetuximab(西妥昔单抗);
胆管癌:Pemazyre;
肾癌:Rucaparib;
肉瘤:Tazemetostat(他泽司他);
不限癌种:Pembrolizumab(派姆单抗)。
这些新疗法的获批,让更多幸运的病友们等来了新的希望和治疗选择,不得不说,近两年靶向疗法,免疫疗法等新型的治疗手段开启了肿瘤治疗的新时代,让患者看到了更多的希望。
但是,它们很昂贵!
Keytruda年自费治疗费用约60万
全球首款广谱抗癌新靶向药Vitrakvi每月32,800美元
罗氏的Rozlytrek为每月17,050美元
礼来公司将Retevmo的定价定为每个月20,600美元
电场疗法每个月的治疗费接近20万人民币......
如果说有什么比“无药可治”更让人绝望的,那就是有特效药,但却买不到!买不起!
全球肿瘤医生网临床招募中心
在抗肿瘤新药不断更新的今天,很多患者通过参加临床试验获得了免费试用最新药物的机会,通过疗效更好的新药,获得了更长的生存获益和更多的治疗机会,对明确了获益机会的患者而言,临床实验可能是最佳的治疗选择。
为了让更多的癌症患者免费用到新型抗癌药物,全球肿瘤医生网为广大病友提供免费入组临床试验的渠道,可以为癌症患者精准匹配最适合的临床试验。
所有的招募信息均由药厂提供,感兴趣的病友扫描下方二维码填写基本信息,全球肿瘤医生网医学部招募团队将会协助您参加匹配的临床试验,招募信息将会不断更新,建议大家添加文末医学顾问二维码,随时获取最新招募信息。
7月更新,重磅抗癌新药免费招募信息公布
实体肿瘤临床试验招募
1、有效率75%!“治愈系”抗癌药拉罗替尼招募实体瘤
去年7月,拉罗替尼将在国内开展临床招募的信息公布后,引起了广泛的关注,经过半年多的审批流程,近日,我们得到拜耳公司的最新信息,目前“治愈系”抗癌药拉罗替尼针对成人实体瘤和儿童实体瘤的两项试验终于正式在国内开始招募患者了!这意味着,国内的患者也终于有机会免费用上这款美国的抗癌“特药”!
成人实体瘤招募信息
这项研究是为了验证拉罗替尼对不同类型的肿瘤疗效。这些肿瘤必须存在一种特定的基因变化(NTRK1, NTRK2或NTRK3)。Larotrectinib是一种试验性的药物,可以阻止这些NTRK基因在癌细胞中的作用,因此可以用来治疗肿瘤。
试验分期:II期
主要终点指标:由独立放射学审查委员会测定最佳总缓解率
入组人数:总体140人中国13人
预计入组结束时间:中国2021年8月31日
| 序号 | 机构名称 | 项目负责人(PI) | 城市 |
| 1 | 中山大学附属肿瘤防治中心 | 徐瑞华 | 广州 |
| 2 | 复旦大学附属中山医院 | 刘天舒 | 上海 |
| 3 | 四川大学华西医院 | 刘咏梅 | 成都 |
| 4 | 北京大学肿瘤医院 | 沈琳 | 北京 |
儿童实体瘤招募信息
本研究是验证拉罗替尼在儿童肿瘤患者中的安全性。该肿瘤必须存在特定(NTRK)基因改变。拉罗替尼旨在限制肿瘤细胞中NTRK基因的活性而治疗肿瘤。研究的第一部分(I期)验证儿童受试者中,剂量的安全性,药物在体内的吸收和改变,对于肿瘤的作用。第二部分(II期)主要目的是药物治疗的作用及其时长。
主要终点指标:1期:受试者发生不良事件的例数,不良事件持续的时间;II期由独立放射学审查委员会测定最佳总缓解率。
入组人数:国际多中心试验:总体159人中国5人
预计入组结束时间:中国2021年11月30日
| 序号 | 机构名称 | 项目负责人(PI) | 城市 |
| 1 | 中山大学附属肿瘤防治中心 | 徐瑞华 | 广州 |
| 2 | 天津市肿瘤医院 | 赵强 | 天津 |
| 3 | 北京儿童医院 | 王焕民 | 北京 |
2、横跨十大癌症!高效抗脑转抗癌药恩曲替尼招募开始
2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。
临床数据显示:对于携带神经营养性酪氨酸受体激酶(NTRK),ROS1或间变性淋巴瘤激酶(ALK)融合的儿童肿瘤类型对治疗的响应率高达100%(完全缓解和部分缓解)!包括难治的中枢神经系统中的肿瘤!这个数字是史无前例的,相信给儿童肿瘤患者打开了一扇全新的希望之门。
1)在NTRK融合阳性实体瘤患者中,entrectinib(恩曲替尼,RXDX-101)的客观缓解率ORR(肿瘤缩小)为57.4%,并且在横跨10种不同类型肿瘤中均观察到了客观缓解(肿瘤缩小)。存在脑转移的患者中,entrectinib的颅内客观缓解率ORR为54.5%,其中超过1/4实现完全缓解(病灶全部消失)。
2)在局部晚期或转移性ROS1阳性非小细胞肺癌NSCLC患者中,临床试验结果表明,在51名ROS1阳性NSCLC患者中,总缓解率达到78%,完全缓解率达到5.9%。
经过国内近半年的审批流程,近日,我们得到罗氏公司的信息,目前“治愈系”抗癌药恩曲替尼针对成人实体瘤的临床试验终于正式在国内开始招募患者了!儿童患者的招募也正在协商中。这意味着,国内的患者也终于有机会免费用上这款美国的抗癌“特药”!这对于所有国内的患者来说又多了一份“治愈”的希望!
成人实体瘤招募信息
这项 Entrectinib治疗携带 NTRK1/2/3、ROS1或 ALK基因重排的局部晚期或转移性实体瘤患者的开放性、多中心、全球性 II期篮式研究,来确定携带NTRK1/2/3、ROS1或ALK基因重排的每类实体瘤患者人群(篮子)接受Entrectinib治疗后的客观缓解率(ORR)。
试验分类:安全性和有效性
试验范围:国际多中心试验
试验分期:II期
主要终点指标:由独立放射学审查委员会测定最佳总缓解率
入组条件(部分):
1. 经组织学或细胞学确诊为局部晚期或转移性实体瘤,而且根据Foundation Medicine, Inc.或CLIA认证或同等机构认可的当地诊断实验室采用任何核酸类诊断检测方法进行的检测,该肿瘤携带一种预计分别转化成具有一个功能性TrkA/B/C、ROS1 或ALK激酶结构域的融合蛋白的NTRK1/2/3、ROS1或ALK基因重排,且不同时存在第二种致癌因素(例如EGFR、KRAS);
2. 对于通过当地实验室分子检测入组的患者,要求提交存档或新鲜的肿瘤组织(除非存在医学禁忌),在Foundation Medicine, Inc.或该地区其他认可的中心实验室进行独立中心分子检测;3. 根据当地采用RECIST v1.1进行的评估,疾病可测量。
3、传奇抗癌药LOXO-292震撼上市,国内招募开始
2020年5月8日,传奇抗癌药LOXO-292就加速获批上市了,同时也有了自己的大名-Retevmo,不得不说,这款对于RET基因融合的患者有着显著疗效的广谱抗癌药将给病友们带来全新的选择和希望。Retevmo也是首个被批准专门用于治疗携带RET基因变异的癌症患者的精准疗法。这款药物即将在美国面市,有条件的患者可以前往美国接受治疗,距离在国内上市还有不短的时间,对于大部分走投无路的癌症患者来说,临床试验是一种很好的选择,Rossy找到了一项已经在国内开始招募的临床试验,但是入组的首要条件是先进行基因检测,确认存在RET基因突变。想参加的患者可以联系医学部。
4、疾病控制率100%!BLU-667招募实体瘤
2020年5月,Pralsetinib(BLU-667,普雷西替尼)用于治疗局部晚期或转移性RET融合阳性非小细胞肺癌的新药上市申请(NDA)和营销授权申请(MAA)已分别被美国FDA和欧洲药监局(EMA)受理。目前,pralsetinib已被美国FDA授予了优先审评资格,预计将于2020年11月23日前做出审批决定。这意味着如果一切顺利,今年的第四季度,我们将迎来既LOXO-292之后的第二款RET抑制剂。
2020年7月2日,pralsetinib(BLU-667,普雷西替尼)再次向FDA提交了新药申请,用于新适应症的审批,治疗患有晚期或转移性RET突变型甲状腺髓样癌和RET融合阳性甲状腺癌的患者。我们期待这款药物能早日获批上市。
目前,一项高选择性RET抑制剂BLU-667治疗甲状腺癌、非小细胞肺癌和其他晚期实体瘤患者的I期研究现在国内开始招募患者,如果您是甲状腺髓样癌、含有RET 融合的非小细胞肺癌和其他含有RET变异的晚期实体肿瘤患者,可以尝试联系全球肿瘤医生网医学部评估是否能够入组(4006667998)。
试验目的
确定每种肿瘤类型的客观缓解率,并明确BLU-667的安全性和耐受性。
入组条件(部分)
1.非小细胞肺癌患者必须有病理学证实和确诊的携带RET融合的局部晚期或转移性非小细胞肺癌,且既往接受过含铂化疗。
2.甲状腺髓样癌患必须有病理学证实和确诊的晚期MTC,在筛选访视之前14个月内疾病已进展,且既往未接受过治疗。
3.患有携带RET突变或融合的其他实体肿瘤。
4.有可测量病灶。
5.同意提供肿瘤组织以进行RET状态确认。
6.签署知情同意书
5、国药之光!泛癌种新药来比古星招募100名患者!
注射用莱古比星是一种新型的蒽环类化疗药物,将6-马来酰亚胺基团(EMC)与四肽氨基酸基团(ALA-ALA-ASN-LEU)连接,并与多柔比星相偶联。
在疗效方面,与多柔比星相比,莱古比星的疗效是突破性的。由于其在心脏和免疫系统等正常组织中均以复合物的形式存在,因此造成的心脏毒性和免疫系统损伤更少、安全性更好。且其为泛癌种药物,针对多种实体瘤均有显著疗效,有望使更多患者受益。
目前,莱古比星已经被认定为化学1类新药,并获得了国家药品监督管理局的临床试验批准(2018L02645),允许进行临床试验。就在近期,莱古比星的Ⅰ期临床试验开始招募患者了!
入选标准:
1.年龄18~75周岁(含两端),性别不限;
2.组织学或细胞学确认的晚期恶性实体肿瘤患者,经标准治疗失败,或无标准治疗方案,或现阶段不适用标准治疗;
3.根据RECIST 1.1版,至少有一个可评估的肿瘤病灶;
4.ECOG体力评分0~1分;
5.预计生存时间≥3个月;
6.有充分的器官功能(结合血常规检查、肝功能检查、肾功能检查等数据进行评估)等。
6、靶向实体瘤!TILs疗法国内临床试验招募中
2019年6月,FDA批准肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的细胞免疫疗法首次获此殊荣,相信距离上市也仅是时间问题,一旦FDA批准,这将是首款用于实体瘤的细胞免疫疗法,将给癌症患者带来巨大的生存获益。
FDA此次授予是基于正在进行的第二阶段innovaTIL-04(C-145-04)积极的试验的数据,摘要数据显示,晚期宫颈癌患者的TIL治疗总体反应率(ORR)为44%。
在2019年2月4日的数据截止时,有27名可评估的患者。
结果显示:
1)44%(12名)的患者有效果,包括1名完全应答,9名部分应答和2个未确认的部分应答;
2)疾病控制率为89%;
3)中位随访时间为3.5个月,12例患者中有11例持续应答;
4)没有任何严重的副作用发生。
除了被国际上认可外,国内也开展了诸多关于TILs疗法的临床研究。目前有一项TILs疗法治疗原发性胆道系统恶性肿瘤的临床研究正在进行中,如果您是符合下述标准的患者,可以尝试联系医学部评估是否能够入组。
试验目的:
观察和评估ScTIL-v2治疗原发性胆道系统恶性肿瘤的耐受性、药代动力学特征,以及安全性和有效性。
入组条件(部分):
1.年龄≥18岁且≤70岁,性别不限;
2.预期自然存活3个月以上者;
3.组织学或细胞学证实的局部晚期或转移性胆道肿瘤患者;
4.既往治疗失败或已经放弃放化疗,自愿接受细胞治疗的患者
5.签署知情同意书。
7、CAR-T细胞治疗晚期实体瘤临床实验招募
一项CAR-T细胞治疗晚期实体瘤的安全性和有效性临床研究在全国各地的三甲医院开展,并且已经获得国家食品药品监督管理总局和相关医院医学伦理委员会的批准。
主要招募的癌种:
1.胰腺癌:无法进行手术或者不适合手术的患者,或手术后复发的患者;或接受过一二线充分治疗,标准治疗无效的患者
2.转移性乳腺癌:既往接受过至少 2-4 个化疗方案或者多线内分泌治疗,目前无标准治疗方案;
3.非小细胞肺癌:标准一线和二线药物治疗失败的晚期患者;诊断为非小细胞肺癌的患者必须检测 EGFR 突变情况、ALK 易位提到的情况需要接受适当的酪氨酸酶抑制剂治疗后无效的患者;
4.复发难治性甲状腺癌:碘难治且对索拉菲尼(或其他相关靶向药物)治疗无应答的患者,或者自动放弃碘 131 治疗或者索拉菲尼(或其他相关靶向药物)治疗的患者;
5.结直肠癌:无法进行手术或者不适合手术的患者,或手术后复发的患者;或接受过一二线充分治疗,标准治疗无效的患者
6.胃癌:无法进行手术或者不适合手术的患者,或手术后复发的患者;或接受过一二线充分治疗,标准治疗无效的患者。
8、二代免疫药物NC318对PD-1无响应者有效!临床招募中
PD-1/PD-L1虽被誉为“神药”,但有效率仅有20%~30%左右,也就是说多数患者并没有治疗效果。近年来,研究发现,Siglec-15与PD-L1相似,是肿瘤细胞逃脱免疫细胞追杀的办法之一,可用于免疫治疗新靶标,且在多种癌症中含量明显增加,如甲状腺癌、子宫癌、膀胱癌、肾癌、肺癌、肝癌及结直肠癌等。但它的表达水平与PD-1/PD-L1的表达是互斥的。简单来说,对绝大多数的肿瘤而言,有PD-1/PD-L1高表达就没有Siglec-15;有Siglec-15高表达就没有PD-1/PD-L1,因此对PD-1/PD-L1抗体不响应的肿瘤,Siglec-15抗体可能就是新的希望。
通过抑制Siglec-15表达,能使患者体内的肿瘤微环境回归正常化,从而实现通过免疫来杀灭肿瘤的效果。因此,陈列平团队超有效率地开发出了Siglec-15抗体药物——NC318,对于那些PD-1/PD-L1治疗无效的肿瘤患者,NC-318或许是它们的克星。
13例非小细胞癌患者接受NC318治疗,而且均为PD-1无效或耐药的患者,在可评估的10例患者中,1例患者肿瘤完全消失,达到完全缓解(CR);1例患者肿瘤显著缩小,达到部分缓解(PR);3例患者疾病稳定(SD),并时间长达16周。客观缓解率(ORR)为29%(2/7),疾病控制率(DCR)为71%(5/7)。
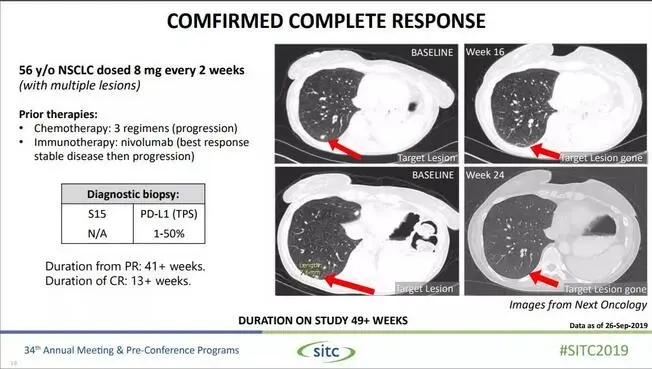
图为肿瘤完全消失的肺癌患者治疗概况
免疫药物PD-1/PD-L1在非小细胞肺癌中的一线单药ORR在20%左右,而NC318单药后线有效率为29%,实属不易。若是能够增加样本量,说不定后续报道结果会让人更加期待。
目前,NC318相关临床试验仍在招募中,并且研发公司NextCure计划在2020年上半年启动2期临床试验。在2期试验中,NextCure计划招募约143名非小细胞肺癌、卵巢癌、头颈癌和三阴性乳腺癌等晚期或转移性实体瘤患者。想参加的患者可以自己登录clinicaltrials.gov搜索,或致电全球肿瘤医生网进行评估和申请。
9、有效率高达85.7%!新一代双靶点广谱抗癌药M7824招募中
药品名称:Bintrafusp alfa(M7824)
生产厂家:默克
适应症:非小细胞肺癌
Bintrafusp alfa,也就是大名鼎鼎的M7824,是德国默克公司研发的一种双功能抗体蛋白,意味着一个药物可以同时有两个靶点,能同时拮抗TGFβ与PD-L1,这样就会极大地提升药物的有效率,并降低联合用药的副作用。在非小细胞肺癌患者群体中,这款创新疗法取得了卓越的临床效果——在PD-L1阳性患者群体(PD-L1不小于1%)中,该新药的总体缓解率(ORR)达到了37%。而在PD-L1高表达的患者群体(肿瘤细胞PD-L1表达≥80%中,M7824的客观缓解率(ORR)更是高达85.7%!
临床试验目前仍在美国,英国,加拿大,澳大利亚,欧洲,韩国,台湾和日本招收患者。以上临床试验详细信息可自行在https://clinicaltrials.gov/查询,也可致电全球肿瘤医生网医学部咨询。
非小细胞肺癌新药临床试验招募
1、有效率83.3%!创新型二代ALK抑制剂CT-707临床招募中!
由中国医学科学院肿瘤医院牵头,全国共计 36 家中心目前正在进行一项评价 CT一 707 治疗克唑替尼耐药的晚期 ALK 阳性非小细胞肺癌患者有效性和安全性的 二期多中心临床研究正在招募患者。
该研究已获得中国国家食品药品监督管理局(批件号 2015L03333 )和中国医学科学院肿瘤医院伦理委员会的批准,在各个中心进行患者招募。该研究将采用 C T 一 707 药物,观察 ALK 阳性的非小细胞肺癌患者的疗效及安全性。
主要入组标准
.年满 18 一 75 周岁,男女不限;
.克唑替尼耐药后
.近 4 周未参加过其他研究性药物临床研究;女性患者未处在怀孕期,试验期间同意采取避孕措施;
.既往细胞毒类化疗未超过 2 线;
.组织学或细胞学检查证实的 ALK阳性。
2、疾病控制率97.2%!肺癌新药伯瑞替尼临床试验招募进行中
我国药企自主研发的c-MET抑制剂药物伯瑞替尼(Bozitinib)获得了相当理想的疗效数据。
伯瑞替尼(Bozitinib)治疗非小细胞肺癌患者的Ⅰ期研究中共纳入37例非小细胞肺癌患者,所有患者均具有MET 14外显子跳跃突变、MET拷贝数扩增、MET过表达中的一种或以上突变类型。
所有患者总体客观缓解率30.6%,疾病控制率达到97.2%,其中MET过表达、MET拷贝数扩增和MET 14外显子跳跃突变患者的客观缓解率分别为35.7%、41.2%和66.7%。
目前,伯瑞替尼的Ⅱ期临床招募正在进行中,国内患者免费使用c-MET靶向药的机会来了!
一项在c-MET异常的晚期非小细胞肺癌患者中评估伯瑞替尼肠溶胶囊有效性和安全性的多中心、多队列、开放的Ⅱ期临床研究。
招募患者数量:85人
纳入标准:
1、年龄≥18岁,男性或女性;
2、经组织学或细胞学证实的晚期非小细胞肺癌患者;
3、EGFR wt、ALK重排阴性、ROS1重排阴性、KRAS突变阴性;
4、经证实存在c-Met异常,c-Met异常,包括以下两种类型:①c-Met外显子14突变;②c-MET扩增,GCN≥6;
5、ECOG评分0~1分;
6、预期生存期≥3个月等。
3、缓解率87.5%!TQ-B3101潜力非凡
一款由国内药企正大天晴药业集团自主研制的ROS1靶点新药TQ-B3101在Ⅰ期试验中展现出了卓越的疗效。
在发布于2020 ASCO年会上的数据中,TQ-B3101 Ⅰ期试验共纳入30例患者,其中27例为肺癌患者。根据患者接受的TQ-B3101治疗剂量不同,研究共将患者分为7个剂量递增组别和2个剂量扩展组别(350 mg bid/300 mg bid)。
在全部患者中,整体缓解率为62.5%;在接受350 mg bid治疗的8例患者中,整体缓解率达到了87.5%;此外,TQ-B3101同样具有通过血脑屏障的能力,在基线有脑转移的8例患者中,整体缓解率达到了62.5%。
不良反应方面,最常见的3级不良反应包括中性粒细胞降低(20%)、ALT升高(6.67%)、白细胞计数降低(3.33%)和QT间期延长(心律失常,3.33%);在接受350 mg bid治疗的患者中发生剂量限制毒性1例,为3级ALT升高。
与其他药物相比,TQ-B3101的主要优势在于:疗效显著、不良反应整体可控,对于脑转移患者有效,同时为国内自主研发药物,国内患者更容易获得。
试验名称:评价TQ-B3101胶囊单药治疗ROS1阳性非小细胞肺癌患者疗效和安全性的II期单臂、多中心临床研究
试验主要由由中国医学科学院肿瘤医院牵头,共28家临床机构参与,目前已经获得国家药品监督管理总局的批准(批件号:2016L06653),并通过伦理审查。
入组标准:(部分)
1、患者年龄≥18岁;
2、ECOG评分0~1分,预期生存期超过3个月;
4、通过组织学或细胞学证明诊断为局部晚期或转移性非小细胞肺癌;
5、提供ROS1阳性书面报告,或在入组前提供组织学标本、活检组织标本送中心实验室进行检测,并确认为ROS1阳性;
6、既往接受过不超过2个化疗方案(若接受超过2个化疗方案,则需再次进行检测,且检测结果确认为ROS1阳性)。
头颈部肿瘤,脑瘤临床试验招募
1、天价电场疗法招募多种实体肿瘤
电场疗法自从问世以来就备受关注,这种针对快速有丝分裂的癌细胞的抗癌黑科技曾被国际著名癌症期刊Clinical Cancer Research发表的一篇文章誉为肿瘤治疗的第四种新方式。这是有史以来最具科幻色彩的抗癌疗法,目前已被FDA批准用于治疗复发性胶质母细胞瘤,新诊断的胶质母细胞瘤以及恶性胸膜间皮瘤,并且在目前在六大实体肿瘤临床试验中都取得了惊人的数据。但是这款疗法在全球属于前瞻性研究,每天700美金,一个月的治疗费用为21000美元,并且只能以租用的形式每天前往医院进行治疗,堪称天价。我们在clinicaltrails的官网上为大家找到了电场疗法招募信息,目前针对各大实体瘤,如非小细胞肺癌,小细胞肺癌,胰腺癌,卵巢癌,肺癌脑转移,肝癌,胃癌,胶质母细胞瘤等都在招募。
有关资格标准的完整信息,请访问clinicaltrials.gov或咨询全球肿瘤医生网医学部。
纳入标准(部分内容):
1.22岁以上2.预期寿命≥3个月3.ECOG得分0-2
排除标准(部分内容):
1)疾病的脑转移或软脑膜扩散的存在
2)无法独立操作电场治疗设备或需要在照顾者的帮助下操作
3)孕妇
4)与原发疾病无关的重大疾病5、上躯干植入电子设备(如起搏器)
2、日本划时代疗法-BNCT将于7月招募国际患者
2020年3月初,世界上第一台BNCT设备正式获得了日本厚生劳动省的医疗设备批准。2020年3月25日批准了由STELLA PHARMA CORPORATION开发的全球首个硼药物Steboronine®也获得了日本厚生劳动省的批准,至此,硼中子俘获疗法正式获批上市,并在当天进行了首次治疗。
2020年5月27日,日本宣布硼中子俘获疗法正式接受患者,并预计将于2020年6月开始接收患有晚期无法手术或复发性头颈癌的国际患者。这是硼中子俘获疗法在世界上首次正式进入临床应用,是肿瘤治疗史上又一值得镌刻的里程碑。
近十年来,随着强流质子加速器技术的迅速发展,硼中子俘获治疗在医院的广泛应用成为可能。日本政府已将基于强流质子加速器的硼中子俘获治疗作为战略产业进行扶持,大步迈入产业化推广阶段。美国、英国、俄罗斯、韩国等国也正在加紧研发。
硼中子俘获治疗是当前最新的一种放射线疗法,是通过点滴注射含硼化合物,这种化合物和癌细胞有很强的亲和力,进入人体后迅速聚集于癌细胞内(相当于是我们做PET扫描时的显像剂),然后用一种超热中子射线照射1个小时左右。中子与进入癌细胞内的硼能产生很强的核反应,释放出一种杀伤力极强的射线,从而达到从癌细胞内部爆破癌细胞的效果。同时,因为中子线的特征是射程很短,只有一个癌细胞的长度,所以杀死癌细胞的时候不会伤害到周围组织。
据全球肿瘤医生网报道,日本目前有四家医院正在安装调试硼中子设备,其中两家调试完毕,可以稳定发射中子线。昨天,日本一家医院正式接收本国患者,预计将于2020年6~7月开始接收国际患者,咨询及预约申请BNCT治疗可致电全球肿瘤医生网医学部初步评估。(重要提示:非免费)
申请方式:
做过基因检测的病友,请将报告发送至全球肿瘤医生网医学部,我们的专家将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
1.请将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,医学部收到报告分析完毕后一个工作日内电话联系。
2.直接致电全球肿瘤医生网医学部400-666-7998咨询相关医生。
十五大癌症招募信息汇总

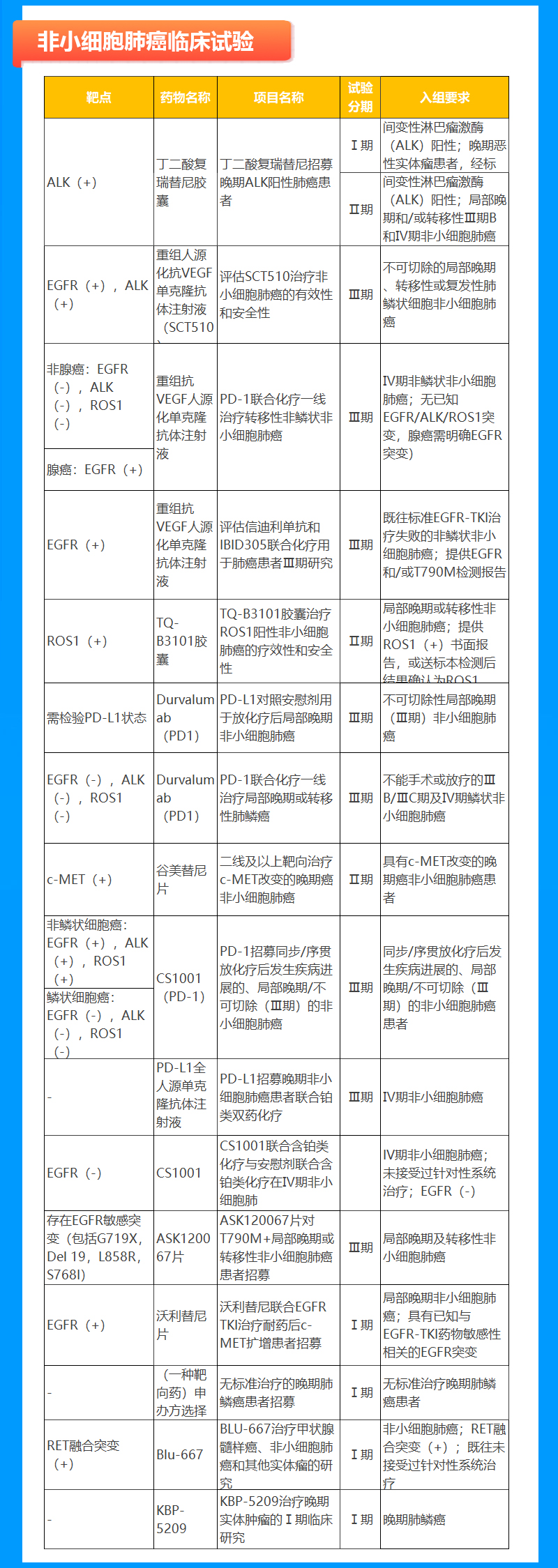
非小细胞肺癌临床试验
小细胞肺癌临床试验

肺癌临床试验
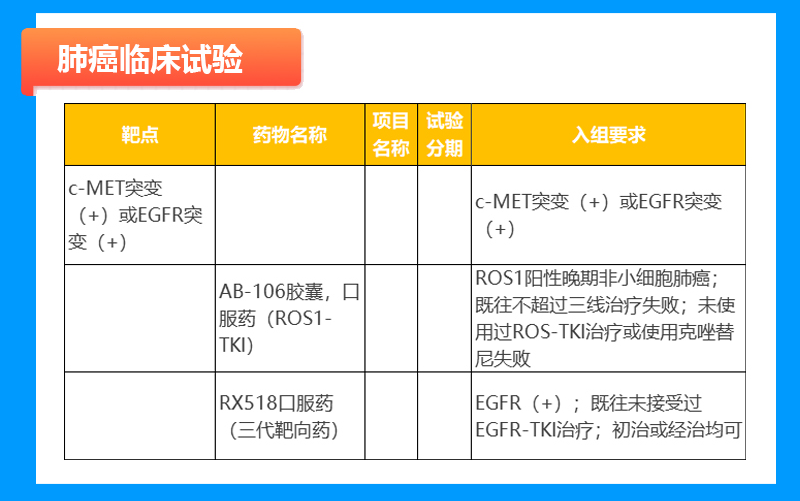
鼻咽癌临床试验
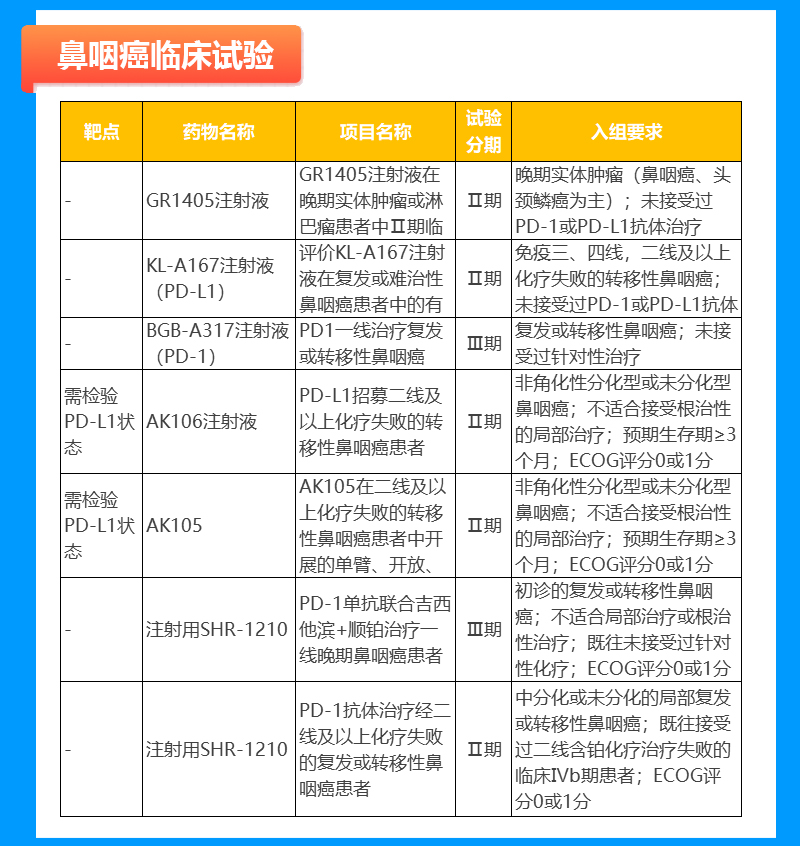
淋巴瘤临床试验
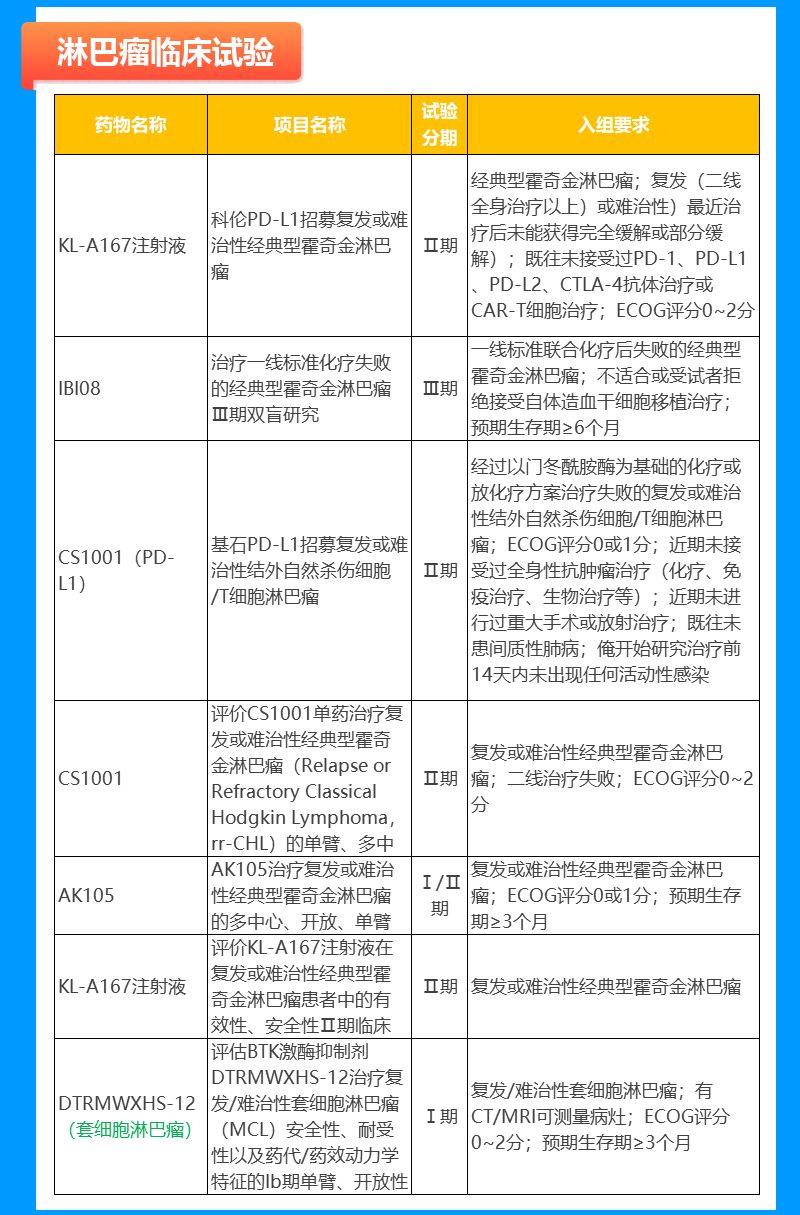
乳腺癌临床试验
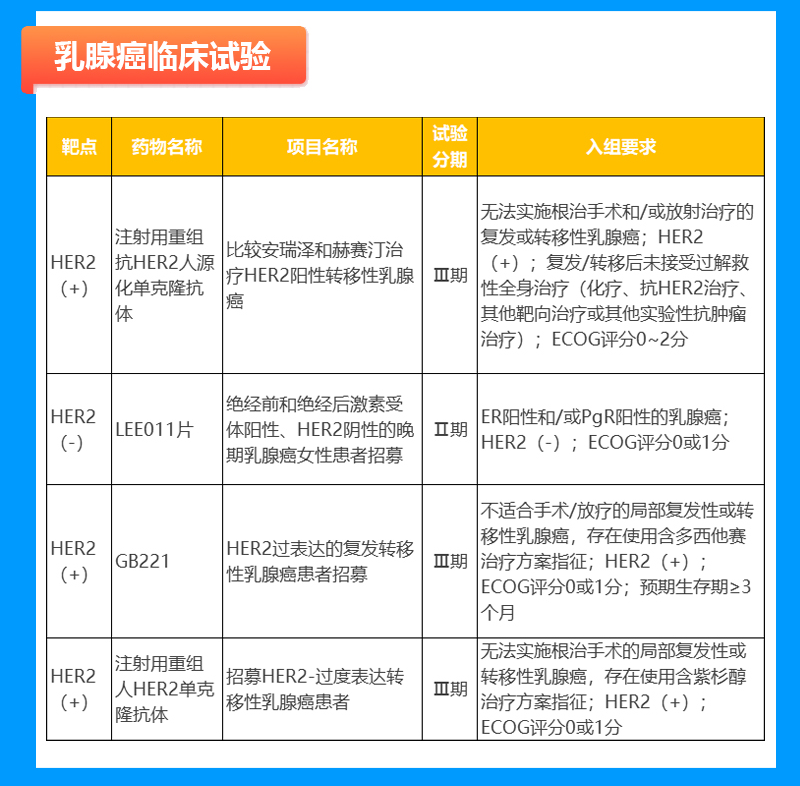
宫颈癌临床试验
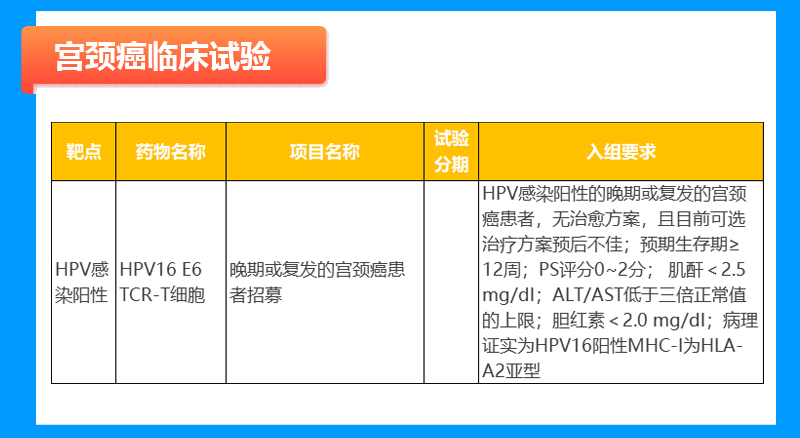
实体瘤临床试验
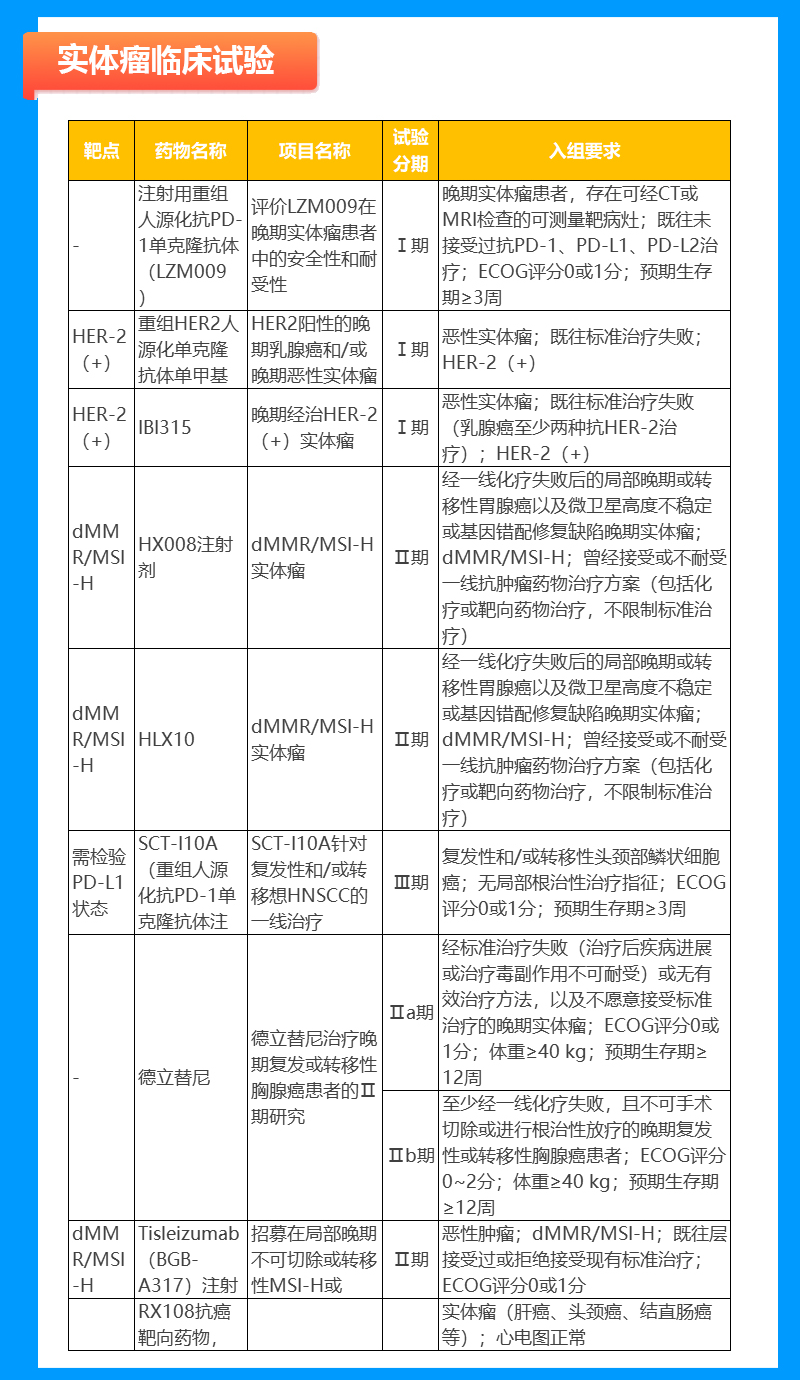
肝癌临床试验
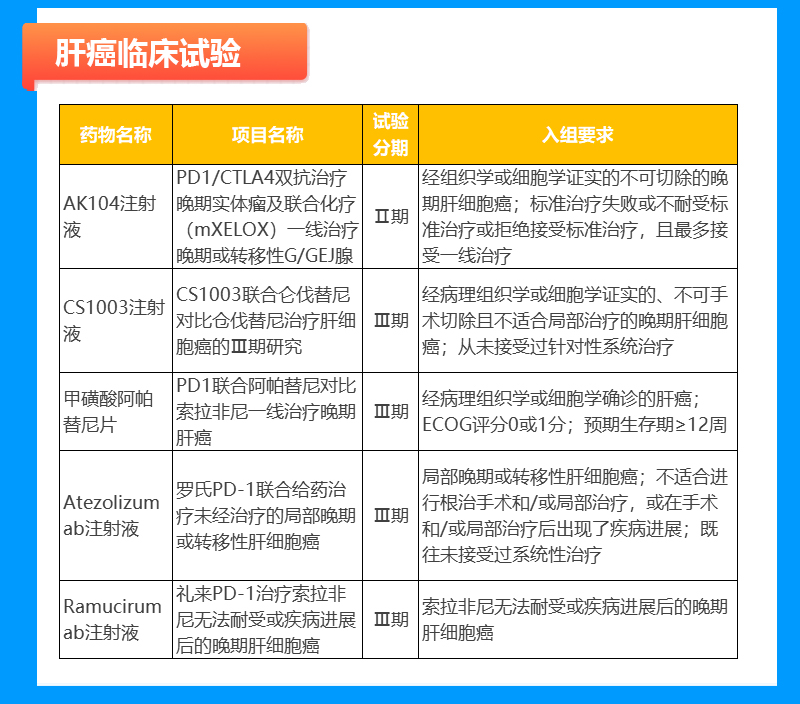
食管癌临床试验
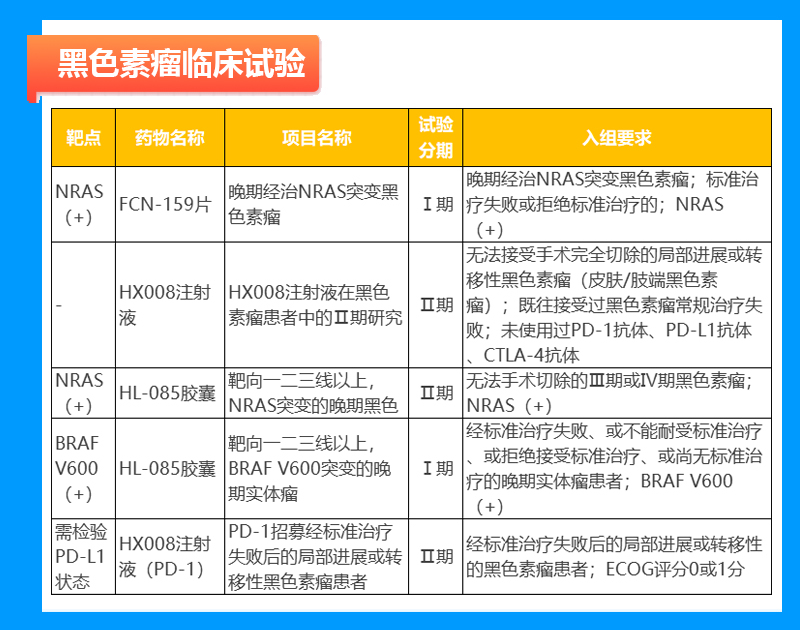
黑色素瘤临床试验
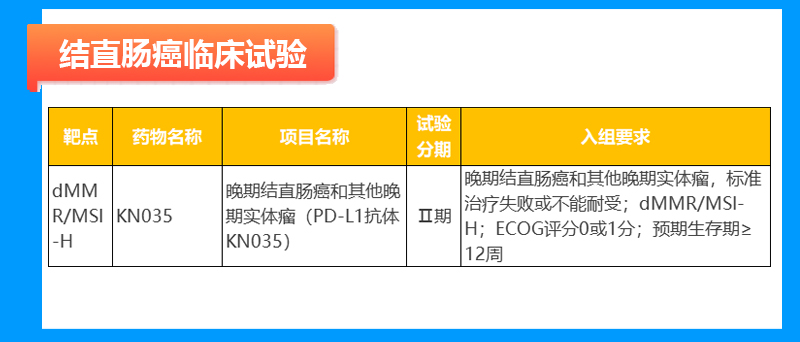
结直肠癌临床试验
胆道癌临床试验

白血病临床试验

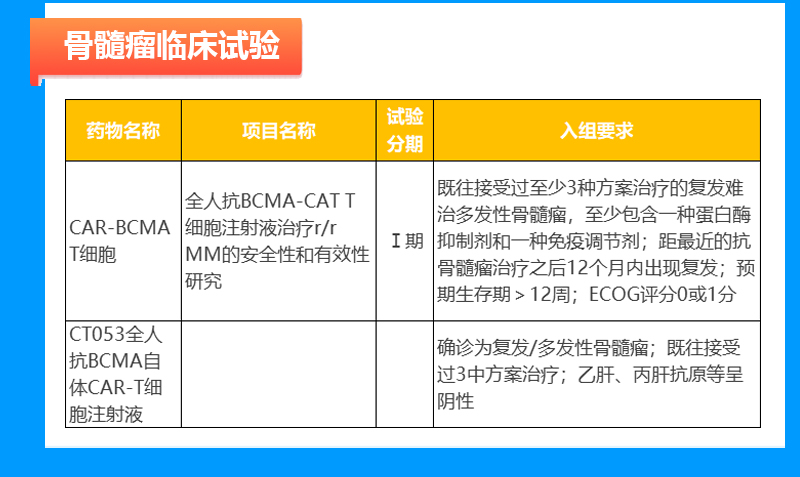
骨髓瘤临床试验

(注:该表格持续更新,建议大家添加文末医学顾问二维码,随时获取最新招募信息。)
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
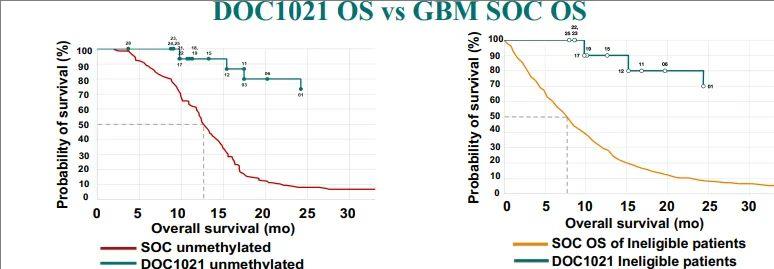
生存率提升至88%!新型树突细胞疫苗DO
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
绝境逆袭!传统化疗束手无策时,WT1 D
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
早期膀胱癌术后五年生存率高达90%,这5
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

探秘肺癌手术强院:医科院肿瘤医院-胸外科
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

首战告捷!WT1-DC疫苗联合多药化疗,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肺癌根治术后如何预防高危复发?五大疗法齐
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




