【临床试验招募】HTMC0435临床试验
招募标准
HTMC0435临床试验,评价HTMC0435片在晚期恶性实体瘤患者中的I期临床试验
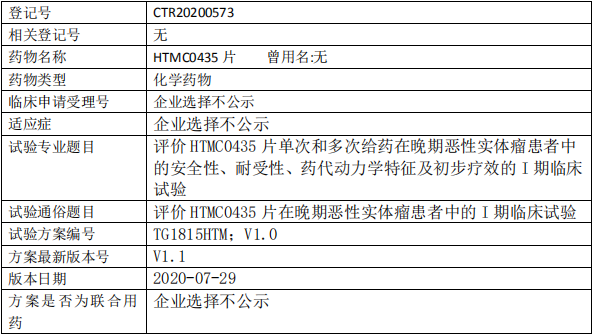
1、试验目的
主要目的:评价 HTMC0435 片单次和多次给药在晚期恶性实体瘤患者中的安全性和耐受性,探索最大耐受剂量(MTD)和剂量限制性毒性(DLT),明确 II 期临床推荐给药剂量(RP2D);
次要目的:评价 HTMC0435 片单次和多次给药的药代动力学特征;初步观察 HTMC0435 片在晚期恶性实体瘤患者的有效性;考察生物标志物的表达水平与 HTMC0435 抑瘤活性的关系。
2、试验设计
试验分类:安全性和有效性
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 81 岁(最大年龄)
性别:男+女
健康受试者:无
入排标准
入选标准
1.年龄≥18 周岁且<81 周岁,性别不限;
2.剂量递增阶段:标准治疗失败或缺乏标准治疗方案,经组织学
或细胞学确诊的晚期实体瘤患者;
3.剂量扩展阶段:标准治疗失败或缺乏标准治疗方案,经组织学或细胞学确诊的晚期卵巢癌、乳腺癌、前列腺癌、胰腺癌患者;
4.预期生存时间≥3 个月;
5.ECOG 体力状况评分为 0~1;
6.首次给药前 2 周内检查指标中,无严重的造血功能异常,心、肺、肝、肾功能基本正常;
7.理解并自愿签署书面知情同意书,有意愿和能力完成定期访视、治疗计划、实验室检查及其他试验过程。
排除标准
排除标准
1.既往接受过聚腺苷二磷酸核糖聚合酶抑制剂治疗者;
2. 在首次给药前 4 周内接受过化疗、放疗、生物治疗、内分泌治疗、免疫治疗等抗肿瘤治疗;
3. 既往抗肿瘤治疗的不良反应尚未恢复到CTCAE 5.0等级评价≤1级(脱发等研究者判断无安全风险的毒性除外);
4. 具有临床症状的中枢神经系统转移或脑膜转移,或有其他证据表明患者中枢神经系统转移或脑膜转移灶尚未控制,经研究者判断不适合入组者;
5. 患有严重心脑血管疾病史者;
6. 既往或当前诊断的骨髓增生异常综合征(MDS)或急性髓性白血病(AML);
7. 妊娠或哺乳期女性,或有生育计划的男性和女性受试者(包括男性受试者的育龄女性配偶);
8. 活动性感染性疾病,且需要系统性抗感染治疗者;
9. 存在严重的心理或精神异常,影响受试者参加本临床研究的依从性;
10. 研究治疗前 4 周内进行过大型手术且未完全恢复;
11. 研究治疗前 4 周内接受过任何临床试验药物治疗者;
12. 除上述情况外,研究者认为不宜入选本研究的患者。
研究者信息
1、主要研究者信息
姓名:李进
学位:医学博士
职称:主任医师
单位名称:上海市东方医院
2、各参加机构信息
机构名称:上海市东方医院
(主要)研究者:李进
国家:中国
省(州)-城市:上海市 -上海市








![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




