96.1%胃癌控制率,实现完全缓解奇迹!2025年全球首创实体瘤CAR-T疗法申报上市!
CAR-T细胞疗法CT041(舒瑞基奥仑赛注射液)治疗胃癌疾病控制率96.1%,实现完全缓解奇迹,有望2025年上半年申请上市
胃癌患者有救了!中国首创Claudin18.2 CAR-T舒瑞基奥仑赛注射液中国胃癌关键II期临床试验取得初步阳性结果,基于此,预计将于2025年上半年向国家药品监督管理局(NMPA)提交上市申请!这意味着,如果一切顺利,舒瑞基奥仑赛注射液(satri-cel)将成为全球首个上市的实体瘤CAR-T产品,造福中国及全球胃癌患者!
胃癌是中国最常见的恶性肿瘤之一,2022 年发病率约为 35.9 万,死亡人数约为 26 万,成为全球胃癌发病率最高的国家之一。大家谈胃癌“色变”的重要原因是胃癌的难治性,大部分患者在确诊时都为晚期,虽然近两年靶向及免疫治疗取得了重大突破,但无进展生存期也仅为6个月,总生存期在8-14个月左右,胃癌患者迫切需要更好的治疗方案。
终于,中国研究人员成功研发了国际上首个针对胃癌,胰腺癌等实体瘤特异性靶点 Claudin18.2 的 CAR-T 细胞疗法--CT041(舒瑞基奥仑赛注射液,Satri-cel )!
96.1%胃癌控制率,实现完全缓解奇迹!2025年全球首创实体瘤CAR-T疗法申报上市
2024 年 12 月 30 日,科济生物重磅宣布,satri-cel关键性 II 期临床试验 CT041-ST-01(NCT04581473)取得了积极结果:根据独立审查委员会 (IRC) 评估,接受 satri-cel 输注治疗的患者的 PFS 显著改善,而接受医生选择的治疗(紫杉醇、多西他赛、伊立替康、阿帕替尼或 nivolumab)的患者则没有改善。此外,已发表的临床数据显示出良好的安全性和有效性。
舒瑞基奥仑赛注射液是目前全球唯一一款在中国和美国获得临床试验许可(IND)的CLDN18.2 CAR-T细胞治疗,有望成为全球首创产品!
科济生物创始人、董事会主席、首席执行官兼首席科学官李宗海博士表示:“我们很高兴看到satri-cel在中国关键的II期临床试验中取得了积极成果。研究表明satri-cel为至少两种先前疗法失败的胃癌患者带来了显著益处。这是实体瘤CAR-T疗法领域的一个突破性里程碑。我们预计将于2025年上半年向NMPA提交NDA,并期待satri-cel成为全球首个实体瘤CAR-T产品,早日为更多患者带来希望。此外,我们将继续探索satri-cel在胃癌和胰腺癌辅助治疗中的潜力,旨在为患者带来更大的益处。”
登顶《Nature Medicine》!中国首创CLDN18.2 CAR-T实现疾病控制率96.1%
在2024年美国临床肿瘤学会(ASCO)上,北京大学肿瘤医院研究团队公布了“satri-cel治疗胃肠道肿瘤的1期临床试验(CT041-CG4006(NCT03874897))的最终结果”,引起巨大轰动!这是首个应用CLDN18.2-CAR-T细胞治疗实体瘤的临床研究数据,并同步发表在国际顶级期刊《Nature Medicine》杂志上。

这项研究共纳入98例CLDN18.2阳性晚期胃肠道肿瘤患者,包括胃和胃食管交界腺癌,胰腺癌,胆管癌等。入组接受不同剂量的satri-cel(即CAR-T细胞)回输治疗,回输剂量分别为2.5×10^8(89例患者)、3.75×10^8(6例患者)、5.0×10^8(3例患者)。
结果显示:在全部98例患者中:在基线时有目标病灶的90例患者中,70例患者的肿瘤出现了不同程度的缩小,总缓解率(ORR)为38.8%,疾病控制率(DCR)高达91.8%。
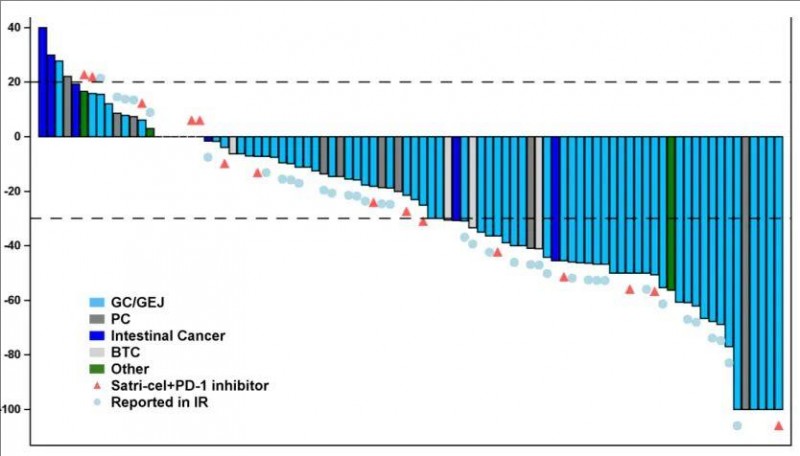
接受单药治疗(n=59)的胃/胃食管结合部(GC/GEJ)癌患者中:-51例患者有目标病灶:客观缓解率(ORR)为54.9%(28/51),疾病控制率(DCR)高达96.1%(49/51),中位持续缓解时间(mDOR)为6.4个月(95% CI:4.6,8.3)。中位无进展生存期(mPFS)为5.8个月(95% CI:4.1,8.0),中位总生存期(mOS)为9.0个月(95% CI:7.0,11.9)。
此外,satricabtagene autoleucel/CT041试验的长期随访显示,该疗法在经治CLDN18.2阳性晚期胃肠道(GI)肿瘤患者,特别是胃癌/胃食管结合部癌患者中,表现出高度有前景的疗效和可控的安全性。与传统抗肿瘤方法相比,它可能对现有的治疗格局产生重大影响,并推动更广泛的创新研究。
晚期胃癌获得完全缓解!中国CAR-T疗法造福全球患者
2020年7月,美国FDA正式批准了中国的CAR-T疗法CT041开展临床实验,这项1b 期多中心开放标签研究 ( NCT04404595 )正在美国 6 个地点开展临床试验,众多美国胃癌患者已成功入组。近期,美国两家知名的癌症中心分别报道了两位幸运的患者达到完全缓解和部分缓解,这意味着,中国CAR-T疗法正站在世界舞台绽放璀璨光芒,造福全球患者!
30岁年轻晚期印戒细胞胃癌患者CAR-T治疗后获得完全缓解
2019年12月,不到30 岁的M先生确诊为晚期胃印戒细胞癌,膀胱顶和腹膜壁转移。在接受了4种全身毒性化疗方案以及多次细胞减灭手术联合腹腔热灌注化疗 (HIPEC) 后,病情仍在在不断进展。
2021 年 5 月,M先生参加了CT-041 CAR-T细胞疗法在美国进行的临床试验,第一次CAR-T细胞回输后,他可以吃一些固体食物,并在约 5 个月后首次进行直肠排便。第二次回输后仅4 周,M先生的影像检查结果显示肿瘤靶病灶竟然全部消失,达到了完全缓解(CR),并且脾周结节和胃壁增厚完全消退,更让人无法相信的是,血液层面追踪体内残存细胞的ctDNA 检测结果显示为阴性,这意味着M先生体内已经没有分子残留疾病(MRD)!而且第二次回输M先生没有皮疹,他的精力水平显著提高,使他能够独立照顾孩子。在第一次 CT041 输注后 8 个月,M先生持续处于完全缓解状态!这也是海外报道的首例Claudin18.2 CAR-T治疗后达到完全缓解的胃癌患者!
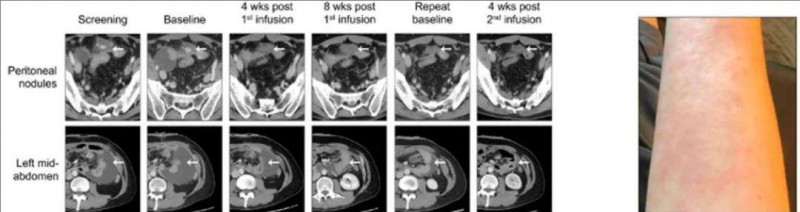
美国MD安德森公布治疗案例
全美癌症专科排名第一的MD安德森癌症中心在癌症免疫治疗学会(SITC)年会上公布了一例振奋人心的案例。
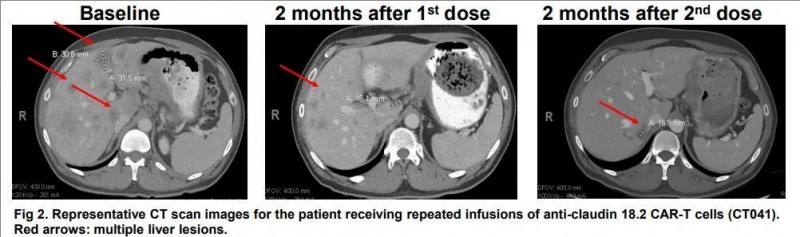
一名57岁男性的晚期胃癌(HER2阴性,PD-L1 CPS 10%)患者,肿瘤已经转移至肝脏,在接受5个周期的FOLFOX+Nivolumab方案和4个周期的FOLFIRI/Ramucirumab方案治疗后病情仍在不断进展。幸运的是,他在全美癌症专科排名第一MD安德森癌症进行了CLDN18.2的检测,显示为阳性,幸运的入组了全新的疗法--中国CAR-T的临床试验。
在预处理化疗后接受了第一次6亿个CT041细胞的治疗,影像显示肿瘤大小分别减小了19.2%、24.4%和26.9%。首次回输三个月后,患者接受了第二次6亿个CT041细胞的输注。CT扫描显示,与基线相比,肿瘤持续缩小,分别减小了34.6%(首次输注后4个月)和41.0%(首次输注后5个月)。
并且,这款CAR-T的安全性良好,截至目前,患者未报告发生严重不良事件,也未报告发生与胃肠道出血相关的不良事件(AE)。仅报告了短暂的3级或4级血液学毒性事件,其他所有AE均为1级或2级。
关于Satri-celSatri-cel
是中国科济生物自主研发的一款针对 Claudin18.2 的自体 CAR-T 细胞候选产品,用于胃癌/胃食管交界处癌 (GC/GEJ) 和胰腺癌 (PC)等 Claudin18.2 阳性实体瘤。正在全球进行多项临床试验:
●研究者发起的试验 (CT041-CG4006, NCT03874897);
●针对中国晚期 GC/GEJ 的确认性 II 期临床试验 (CT041-ST-01, NCT04581473);
●针对中国 PC 辅助治疗的 I 期临床试验 (CT041-ST-05, NCT05911217) ;
●针对北美晚期胃或胰腺腺癌的 1b/2 期临床试验 (CT041-ST-02, NCT04404595)。
2022 年 1 月,Satri-cel 获得美国 FDA 授予的再生医学先进疗法 (RMAT) 资格,用于治疗 Claudin18.2 阳性晚期 GC/GEJ 癌,并于 2021 年 11 月获得 EMA 授予的 PRIME 资格,用于治疗晚期胃癌。2020 年,Satri-cel 获得美国 FDA 授予的孤儿药资格,用于治疗 GC/GEJ,2021 年获得 EMA 授予的孤儿药资格,用于治疗晚期胃癌。目前,中国首创 Claudin18.2 CAR-T(Satri-cel)GC/GEJ 关键 II 期临床试验患者入组也已经完成,我们期待这款卓越的疗法能够早日上市,造福更多的患者!
胃癌患者一定要检测的新兴靶点--Claudin18.2
Claudin 18.2是一个泛肿瘤的靶点,在多种上皮肿瘤当中都有表达,尤其在胃癌和胰腺癌中存在较高的表达。在胃癌或胃食管结合部癌中,高达60%的患者检测到Claudin 18.2的高度表达,成为近两年最具潜力的热门靶点,已有大量药物取得卓越的临床数据,为胃癌患者带来新曙光!
2024年6月25日,FDA批准zolbetuximab上市,联合含氟嘧啶和铂类化疗用于一线治疗治疗 CLDN18.2 阳性、不可切除、晚期或复发性胃癌或胃食管交界腺癌患者。这是第一个也是唯一一个靶向治疗患有CLDN18.2 阳性这种毁灭性疾病的新选择!

除了上面获批的药物,还有更多的新药正在研发中,包括ADC药物、MET抑制剂、PD-1/PD-L1抑制剂等等,大家可以根据当前疾病的发展情况以及分子分型进行选择,也可联系医学部了解详细招募标准,进行入组评估。
M108
试验药组:LM302注射液
药物介绍:CLDN18.2ADCC单克隆抗体
适合患者:无法手术切除初治胃癌,需要CLDN18.2 表达阳性。HER-2 阴性的胃和胃食管结合部腺。
TQB2103
试验药组:TQB2103
药物介绍:Claudin 18.2ADC
适合患者:标准治疗后不耐受或进展,需要CLDN18.2 表达检测。HER-2 阴性的胃和胃食管结合部腺癌
相信上面这些在研药物给了晚期胃癌患者新的希望,同时也能看出,随着新型临床研究的推进,对检测提出了更高要求,需要全面了解患者的基因图谱 ,已经做了检测的病友可提交病历至全球肿瘤医生网医学部初步评估获得用药方案及临床试验推荐。相信胃癌患者的明天会越来越好。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




