全球首款靶向CLDN18.2抗体佐妥昔单抗在华获批,中位总生存期超1年!
2024年12月31日国家药监局批准Claudin18.2的IgG1单抗佐妥昔单抗(Zolbetuximab-clzb、Vyloy/威络益)用于一线治疗CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃/胃食管交界处腺癌
2024年12月31日,胃癌患者迎来了一个振奋人心的好消息,全球首款CLDN18.2的IgG1单抗——佐妥昔单抗,终于获得中国国家药品监督管理局(NMPA)批准上市,与含氟尿嘧啶类和铂类药物化疗联合,用于CLDN18.2阳性、HER2(人表皮生长因子受体2)阴性的局部晚期不可切除或转移性胃或胃食管交界处(GEJ)腺癌的一线治疗。
全球首款CLDN18.2的IgG1单抗——佐妥昔单抗震撼登陆中国
佐妥昔单抗(Zolbetuximab,zolbetuximab-clzb,Vyloy®,威络益®)是由安斯泰来研发的一款针对CLDN18.2的IgG1单克隆抗体,同时也是全球首个获批的靶向CLDN18.2的抗体,以及全球首款CLDN18.2的IgG1单抗!

▲截图源自“NMPA”
早在2024年10月18日,佐妥昔单抗就曾获美国食品药品监督管理局(FDA)批准,与化疗联合,作为局部晚期不可切除或转移性HER2-、CLDN18.2阳性的胃癌或胃食管结合部(G/GEJ)腺癌的一线治疗。本次获批主要基于一项SPOTLIGHT的III期临床试验结果,中位OS分别为18.2个月(佐妥昔单抗组) vs 15.5个月(安慰剂组);中位PFS分别为10.6个月(佐妥昔单抗组) vs 8.7个月(安慰剂组)。
如今在2025年伊始,这款胃癌新药终于在中国获批上市了,为晚期胃癌患者带来了新的希望与选择!
佐妥昔单抗暴击胃腺癌或胃食管连接部腺癌,中位总生存期超1年
近期,全球知名期刊《新英格兰医学杂志》报道了“佐妥昔单抗治疗胃腺癌或胃食管连接部腺癌的总体生存期最终分析结果,以及对SPOTLIGHT、GLOW两项试验的综合分析和其他疗效和安全性终点的最新分析结果”。
本次共入组1,072例胃腺癌或胃食管连接部腺癌患者,将其随机分为两组,即佐妥昔单抗组(537例)、安慰剂组(535例)。结果显示如下:
1、中位无进展生存期(PFS):中位PFS分别为9.2个月(佐妥昔单抗组)vs 8.2个月(安慰剂组)(95% CI,0.61~0.83,详见下图)。
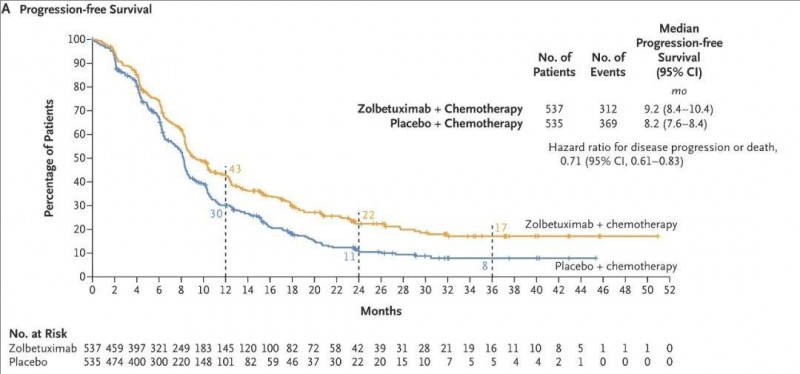
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、中位总生存期(OS):中位OS分别为16.4个月(佐妥昔单抗组)vs 13.7个月(安慰剂组)(95% CI,0.67~0.89,详见下图)。
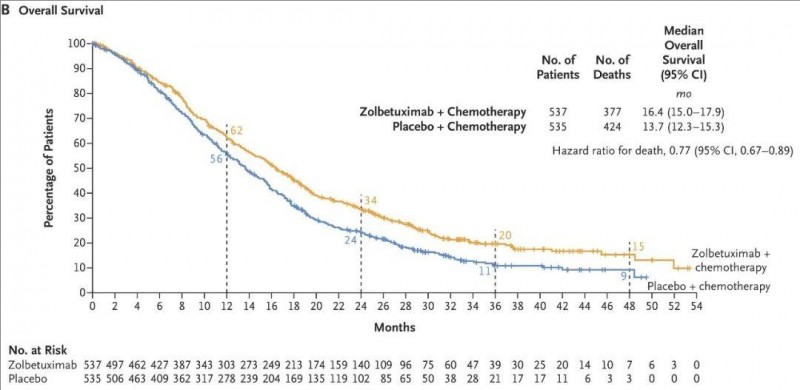
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、不良反应:佐贝妥昔单抗治疗期间最常见的不良事件是恶心(佐贝妥昔单抗组76.0%的患者、安慰剂组56.2%的患者),以及呕吐(佐贝妥昔单抗组66.8%的患者、安慰剂组34.2%的患者),与之前的统计结果相比,未观察到新的不良反应。
更多Claudin18.2的新药/新疗法正在招募中……
相信看了上面的数据,Claudin18.2阳性癌症患者,一定重燃了希望!好消息是,除了上面提到的佐妥昔单抗外,目前国内外还有多款针对Claudin18.2的新药获新疗法正在招募胃癌、胰腺癌等多款实体肿瘤患者,包括但不限于:
1、IMC002
IMC002是一种基于抗CLDN18.2VHH抗体的自体CAR-T细胞疗法,具有高特异性,与CLDN18.2无交叉反应。一项1期、开放标签、多中心、剂量递增研究旨在评估IMC002对CLDN18.2阳性胃肠道肿瘤患者的安全性、可行性和初步疗效,包括但不限于晚期胃癌、食管胃交界处腺癌和晚期胰腺癌(NCT05946226)。约9-18名CLDN18.2阳性晚期胃肠道肿瘤患者将依次纳入三个剂量递增队列,以评估自体IMC002治疗的安全性和可行性。患者入组后将接受白细胞分离术和IMC002产品制备。如果病情迅速进展,患者可按照研究者的决定接受桥接疗法。在接受环磷酰胺、氟达拉滨和白蛋白紫杉醇淋巴细胞清除治疗后,患者将被分配到三个剂量递增组接受CAR-T细胞治疗。
2、LM-302
LM-302(TPX-4589)是一种针对CLDN18.2而开发的新型ADC,由重组人源化抗CLDN18.2IgG1mAb(LM-102)与细胞毒性有效载荷MMAE偶联而成。根据临床前数据,在高表达和低表达的胃和胰腺CLDN18.2肿瘤模型中,LM-302体外有效抑制肿瘤细胞增殖,体内减少肿瘤生长。此外,在GC肿瘤模型中,与佐贝妥昔单抗相比,LM-302表现出更好的内化和疗效。目前,针对CLDN18.2阳性晚期实体瘤患者的LM-302的I期研究正在评估中(NCT05001516)。此外,目前正在进行一项I/II期、开放标签、多中心研究,旨在评估LM-302联合特瑞普利单抗(抗PD-1抗体)对晚期实体瘤患者的安全性和耐受性(NCT05188664)。
3、TQB2103
TQB2103是中国生物制药自主研发的针对CLDN18.2的ADC药物。TQB2103与表面表达CLDN18.2的肿瘤细胞结合后,被内化并运输到溶酶体,在溶酶体中释放细胞毒性有效载荷,从而通过脱氧核糖核酸(DNA)损伤选择性杀死肿瘤细胞。通过旁观者效应,它可以杀死相邻的阴性肿瘤细胞。目前正在进行一项I期临床试验,评估TQB2103注射液对晚期癌症患者的耐受性、安全性和有效性(NCT05867563)。
4、SYSA1801
SYSA1801是一种靶向CLDN18.2的ADC,可递送微管抑制剂MMAE。临床前研究表明,SYSA1801在表达CLDN18.2的胃癌、胰腺癌和肺癌的多种细胞系和PDX中表现出显著的体内和体外抗肿瘤活性。I期试验纳入的33名耐药复发性实体瘤患者中,26名(78.8%)患有胃癌。在第I部分中,患者接受了高达3mg/kg的SYSA1801。在17名可评估的胃癌患者中,ORR为47.1%(8名患者为PR),DCR为64.7%(3名患者为SD)。SYSA1801的最佳剂量正在探索中(NCT05009966)。
5、ASKB589
ASKB589是一种人源化抗CLDN18.2IgG1mAb,具有高亲和力和增强的ADCC。已公布ASKB589对晚期实体瘤患者的I/II期剂量递增和扩展研究的初步结果(NCT04632108)。本研究评估了ASKB589单药治疗(A部分)和与化疗联合治疗(B部分)的最大耐受剂量(MTD)、安全性和耐受性、PK、PD和疗效。在A部分9名可评估患者(≥10mg/kgASKB589)中,5名患者(45%)的肿瘤缩小,而2名患者获得部分缓解(PR)。此外,6名患者病情稳定(SD),疾病控制率(DCR)高达89%。在B部分12名可评估患者(≥6mg/kgASKB589)中,所有患者的肿瘤均缩小,9名患者获得PR,客观缓解率(ORR)高达75%,DCR疾病控制率(DCR)更是达到100%。综上,ASKB589显示出高达20mg/kg剂量的可控安全性和良好的抗肿瘤活性。
小编寄语
根据上述的研究数据,对于HER2阴性、局部晚期不可切除或转移性胃或胃食管连接部腺癌且肿瘤为 claudin 18.2阳性的患者,佐妥昔单抗联合化疗可延长无进展生存期和总生存期,优于安慰剂联合化疗,且未观察到严重不良反应。
未来,我们有望看到更多高效、低毒的CLDN18.2靶向治疗药物问世,并且在联合治疗模式的探索上取得更大突破,从而显著提高胃癌患者的治疗效果,改善患者的生存质量和预后,为胃癌的攻克迈出坚实的一步。想了解胃癌更多靶向药的患者,可将治疗经历、近期病理报告、基因检查结果等,提交至全球肿瘤医生网医学部,初步评估获得用药方案及临床试验推荐。
参考资料
[1]Shitara K,et al. Zolbetuximab in gastric or gastroesophageal junction adenocarcinoma[J]. New England Journal of Medicine, 2024, 391(12): 1159-1162.
https://www.nejm.org/doi/full/10.1056/NEJMc2409512#ap2
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




