又添一地!泛癌种靶向药恩曲替尼即将在欧洲上市,国内招募进行中!
广谱抗癌药,广谱靶向药恩曲替尼(Entrectinib)尼即将在欧洲上市,恩曲替尼临床试验国内进行中
继在日本、美国及加拿大等国获批上市之后,2020年6月1日,欧洲药品管理局人用药品委员会(CHMP)推荐将恩曲替尼(entrectinib,Rozlytrek)用于治疗NTRK融合突变阳性的≥12岁的成年及儿童患者,以及ROS1阳性且未使用过ROS1抑制剂药物的晚期非小细胞肺癌成年患者;接受治疗的患者应为局部晚期、转移性或无法接受手术治疗的患者,未接受过其他NTRK抑制剂治疗,且无其他有效的治疗方案。

这项建议基于Ⅱ期STARTRK-2试验、Ⅰ期STARTRK-1试验、Ⅰ期ALKA-372-001试验和Ⅰ/Ⅰb期1 / 1b期STARTRK-NG试验的数据,这些试验同样也是恩曲替尼在美国获批上市时的依据。目前,欧盟委员会已经开始审理这一推荐,并将在未来几个月内给出答复。
“泛癌种”的靶向药物,正在全球范围内开启一个癌症治疗的新时代
ESMO2018:横跨十大癌种,晚期患者整体缓解率57.4%
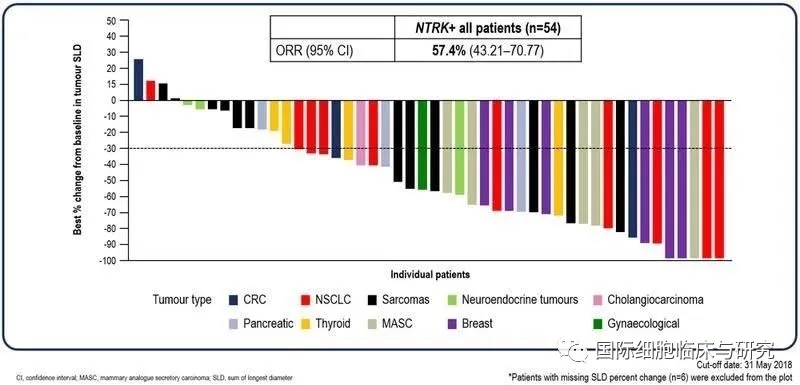
根据在2018年的ESMO(欧洲肿瘤内科学会年会)上发布的数据,Ⅱ期STARTRK-2试验、Ⅰ期STARTRK-1试验和Ⅰ期ALKA-372-001试验共纳入54例NTRK阳性患者。这些患者的肿瘤类型包括乳腺癌、胆管癌、大肠癌、妇科癌、神经内分泌肿瘤、非小细胞肺癌、唾液腺癌、胰腺癌、肉瘤和甲状腺癌等。其中22.2%的患者存在脑转移,42.6%的患者曾接受过二线及以上的治疗。

结果显示,所有患者客观缓解率达到了57.4%,仅有7.4%的患者病情持续进展;未发生脑转移的患者客观缓解率为59.5%,发生脑转移患者客观缓解率也达到了50.0%。
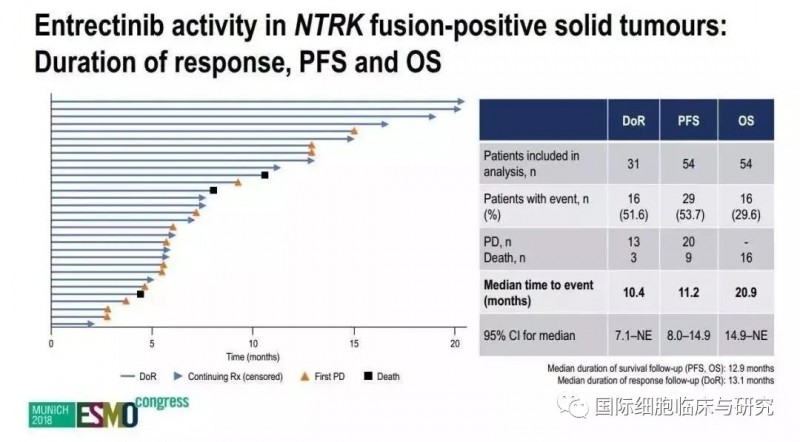
所有患者中位缓解持续时间为10.4个月,中位无进展生存期11.2个月,中位总生存期为20.9个月。对于药物有反应的患者,囊括了十个癌种。
在不良反应方面,多数不良事件均为1级或2级,均可通过对症治疗或调整剂量来缓解;仅有4%的患者因不可耐受的严重不良反应停止治疗。整体来说,恩曲替尼的安全性较好,患者耐受性较高。
ASCO2020:数据持续更新!缓解率63.5%,缓解持续23.9个月
在今年的ASCO大会上,研究者更新了恩曲替尼的疗效数据,在更长的随访期、更大的患者群体中,恩曲替尼同样取得了显著的疗效!
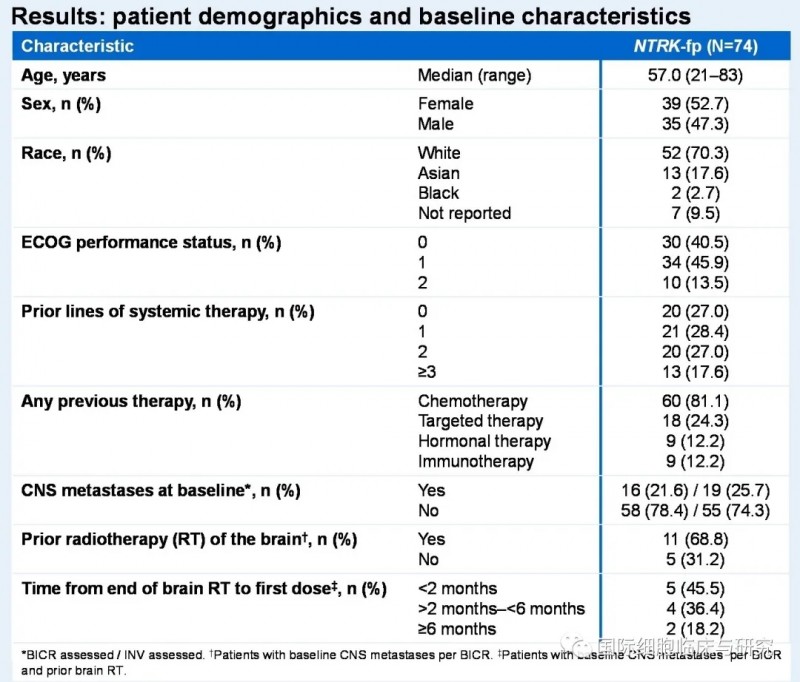
在多项Ⅰ/Ⅱ期研究(ALKA,STARTRK-1,STARTRK-2;EudraCT 2012-000148-88;NCT02097810;NCT02568267)中,共74例可评估患者,均为晚期实体瘤患者,所有患者中位随访时间14.2个月。
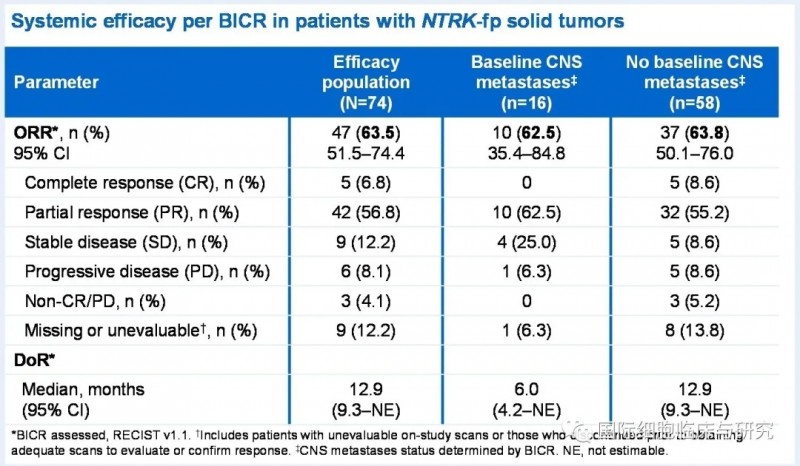
结果显示,整体临床缓解率63.5%,完全缓解率6.8%;中位缓解持续时间23.9个月。在没有中枢神经系统转移的患者中,临床缓解率达到65.5%;在有中枢神经系统转移的患者中,临床缓解率为57.9%。
在安全性方面结果与之前的报道一致,最常见的3级或以上的治疗相关不良事件为体重增加(7.1%)、贫血(7.1%)和疲劳(6.2%)。
与之前的数据相比,此次补充更新进一步地证实了恩曲替尼在实体瘤领域的疗效与安全性。
恩曲替尼的“身份履历”
商品名:Rozlytrek
通用名:Entrectinib
获批适应症:治疗NTRK基因融合阳性的晚期复发实体瘤的成人和儿童患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。
研发公司:由生物制药公司Ignyta研发,2017年年底被罗氏耗资17亿收购。
作用机制:
恩曲替尼是一种具有中枢神经系统活性的酪氨酸激酶抑制剂(TKI),能够穿过血脑屏障,是临床上唯一一种被证明针对原发性和转移性脑疾病具有疗效的TRK抑制剂,并且没有不良的脱靶活性(off-target activity,未达到预先设定的目标);
可以阻断ROS1和NTRK激酶活性,并可能导致ROS1或NTRK基因融合突变类型的癌细胞死亡。
上市时间及国家:
2019年6月18日,经PMDA批准在日本上市。
2019年8月16日,经FDA批准在美国上市。
2019年11月,获我国国家药品监督管理局许可进行临床试验。
剂型及规格:口服胶囊,100/200 mg
恩曲替尼的国内临床试验正式开始招募患者意味着,国内患者终于有机会免费参与临床试验、使用原本只有出国接受治疗才能使用的昂贵“特效药”了!
天价抗癌“神药”免费用,恩曲替尼临床试验招募进行中
使用Entrectinib(恩曲替尼)治疗携带NTRK1/2/3、ROS1或ALK基因重排的局部晚期或转移性实体瘤患者的开放性、多中心、全球性Ⅱ期篮式研究,研究目的为确定携带NTRK1/2/3、ROS1或ALK基因重排的每类实体瘤患者人群(篮子)接受Entrectinib治疗后的客观缓解率(ORR)。
试验分类:安全性和有效性试验
范围:国际多中心试验
分期:Ⅱ期
主要终点指标:由独立放射学审查委员会测定最佳总缓解率
入组条件(部分):
1. 经组织学或细胞学确诊为局部晚期或转移性实体瘤,而且根据Foundation Medicine, Inc.或CLIA认证或同等机构认可的当地诊断实验室采用任何核酸类诊断检测方法进行的检测,该肿瘤携带一种预计分别转化成具有一个功能性TrkA/B/C、ROS1或ALK激酶结构域的融合蛋白的NTRK1/2/3、ROS1或ALK基因重排,且不同时存在第二种致癌因素(例如EGFR、KRAS);
2. 对于通过当地实验室分子检测入组的患者,要求提交存档或新鲜的肿瘤组织(除非存在医学禁忌),在Foundation Medicine Inc.或该地区其他认可的中心实验室进行独立中心分子检测;
3. 根据当地采用RECIST v1.1进行的评估,疾病可测量。
如果您符合招募标准,且愿意参与临床试验、希望能够获得免费的药物与治疗,请您扫描下方二维码提交病历资料,我们将进行审核并安排顾问与您联系;
如果您尚未接受过基因检测,但仍然有需要、有意向参与,可以扫描文末二维码,全球肿瘤医生网将安排专业人士为您提供帮助。
↓扫描二维码申请↓

全球肿瘤医生网癌症临床试验招募中心
为了让更多的癌症患者免费用到新型抗癌药物,全球肿瘤医生网为广大病友提供免费入组临床试验的渠道,可以为癌症患者精准匹配最适合的临床试验。
招募中心发布的所有的招募信息均由药厂提供,感兴趣的病友可以扫描上方二维码填写基本信息,全球肿瘤医生网医学部招募团队将会协助您参加匹配的临床试验。
招募信息会不断更新,大家可以扫描文末二维码在线咨询或加入临床试验医患患者群,随时获取最新招募信息。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
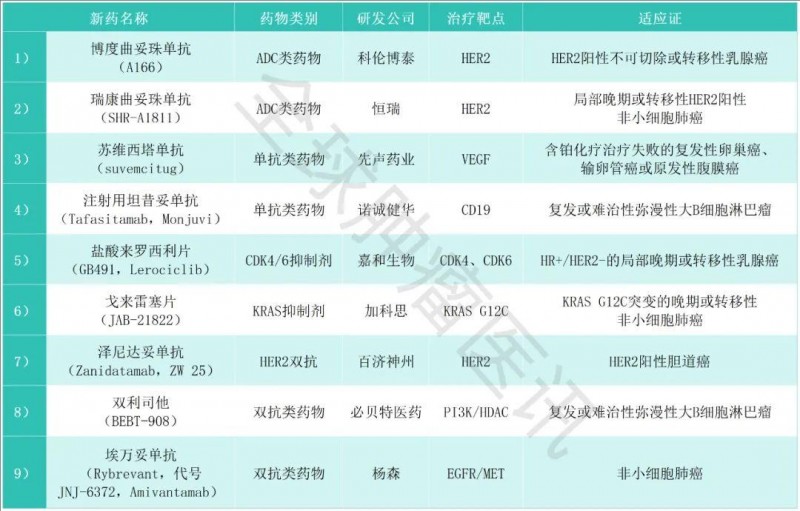
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




