新突破:港大双重抗癌疫苗研发成功,免疫细胞新贵吊打肝癌、肺癌、血癌,完全缓解率高达78%
新突破:港大双重抗癌疫苗γδ-T细胞外泌体疫苗研发成功,免疫细胞新贵吊打肝癌、肺癌、血癌,完全缓解率高达78%
据“香港大学官网”2024年3月13日报道,香港大学李嘉诚医学院研究团队发现源自γδ-T细胞的外泌体不但具有直接抗肿瘤作用,将其发展为肿瘤疫苗后,更能有效诱发肿瘤特异性免疫反应,以此为基础研发的γδ-T细胞外泌体疫苗,不仅具有双重抗肿瘤功效,还可能实现标准化生产,加速癌症疫苗的临床推广和应用,在癌症免疫疗法的研发领域具有重要意义!让我们拭目以待!
▲截图源自“香港大学官网”
γδ-T细胞与癌症疫苗的"完美碰撞"
▲截图源自“Wiley”
癌症疫苗可以放大抗原特异性的抗肿瘤反应,在肿瘤治疗中起着至关重要的作用,然而迄今为止,癌症疫苗主要基于树突状细胞(DC)和肿瘤细胞(TExos)的外泌体,其临床疗效及安全性方面存在一定的局限性。
γδ-T细胞是一类罕见的T细胞亚群,以直接的抗肿瘤活性和增强T细胞反应的能力而闻名。研究显示,源自γδ-T细胞的小细胞外囊泡(EV)(γδ-T-EVs)从其亲本细胞继承了双重抗肿瘤活性,通过携带细胞毒性和免疫刺激分子,可以直接杀死肿瘤细胞并刺激免疫系统。
γδ-T细胞外泌体疫苗是通过将肿瘤相关抗原(TAA)加载到γδ-T-EVs中设计的,具有双重抗肿瘤作用,既可直接对抗肿瘤,并诱导肿瘤细胞死亡;还可有效地传递肿瘤抗原,其抗癌效果优于传统DC-Exos(树突状细胞外泌体)的疫苗。
更为重要的是,来自健康供体的γδ-T细胞外泌体可用于治疗同种异体肿瘤患者,这将大大简化个性化疫苗制备的过程,并实现癌症疫苗的标准化生产的美好愿景,从而激素癌症疫苗的临床推广和应用,让更多的癌症患者获益!该研究成果已同步发表在国际著名科学期刊《细胞外囊泡杂志》中。
其实近年来各国针对γδ-T细胞治疗各类肿瘤的惊艳报道并不少见,这款癌症治疗领域的后起之秀究竟有何魅力呢?下面小编就来简单科普一下,帮大家揭开γδ-T细胞的神秘面纱。
γδT细胞:肿瘤治疗领域的"后起之秀"
γδT细胞是具有双重抗肿瘤活性的类先天性T细胞,约占所有T淋巴细胞的0.5%~5%,它们可以直接消灭肿瘤细胞,并作为免疫刺激细胞发挥作用,促进抗肿瘤免疫。
γδT细胞最早于1986年发现;1990年首次从肺癌患者肿瘤浸润淋巴细胞(TIL)中分离出来;2003年γδT细胞的临床试验首次在ClinicalTrials.gov上注册;截至2022年11月15日,该网站上注册的γδT细胞相关临床试验至少达48项,其中,中美两国的试验数量约占81%左右。
2017年之前,γδT细胞疗法主要用于实体瘤的治疗,但在CAR-γδT细胞疗法推出后,这种情况发生了变化。目前,γδT细胞已在恶性血液肿瘤、晚期肺癌、肾细胞癌、结直肠癌、乳腺癌、胰腺癌、卵巢癌、胆囊癌等多款癌症中,展现出不俗的治疗效果,是当之无愧的“免疫细胞抗癌新星”!
图1 目前已注册的γδ T细胞免疫治疗临床试验概览(按重量类型)
▲图源“frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:(图b)从左至右依次为:白血病、白血病/淋巴瘤、肝癌、乳腺癌、淋巴瘤、脑瘤、肺癌、多发性实体瘤、多发癌症、前列腺癌、胃癌、肾癌、平滑肌肉瘤、多发性骨髓瘤、多发性骨髓瘤/白血病、胰腺癌。
γδ-T细胞全面碾压多款癌种
γδ CAR-T细胞绝杀B细胞恶性肿瘤,完全缓解率高达78%
ADI-001属于一种靶向B细胞抗原CD20的首创同种异体γδ CAR-T细胞疗法,具有先天性和适应性细胞毒性效应功能,能够补充CAR的靶向作用,从而增强疗效,并降低因抗原丢失而导致的肿瘤逃逸可能性;此外,还可表达MHC独立的γδT细胞受体,因此无需进行基因编辑,即可降低移植物抗宿主病(GvHD)的风险。
“ADI-001治疗复发/难治性B细胞淋巴瘤的1期临床试验”,共入组9例可评估疗效的患者,中位年龄为62岁(范围45-75岁)。8名患者患有大B细胞淋巴瘤(LBCL),1名患者患有套细胞淋巴瘤(MCL)。其中4例患者既往接受过抗CD19 CART细胞治疗(2次Axi-cel、2次Liso-cel)。入组后,分别接受四种剂量水平(DL1、DL2、DL3、DL4)的ADI-001治疗。
结果显示:最佳客观缓解率(ORR)高达78%(7/9),完全缓解(CR)率也达到惊人的78%(7/9)。其中,4例既往接受过CD19 CAR-T细胞治疗的患者,客观缓解率(ORR)和完全缓解(CR)率竟然达到100%!值得一提的是,在1.2~8.8个月的随访期间,这4例患者仍处于完全缓解状态。
▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,ADI-001 γδ CAR T 细胞具有良好的安全性和疗效,初步研究数据显示,入组患者(包括既往接受过CAR-T治疗的患者)均出现了令人惊艳的完全缓解率。
想寻求γδT细胞、癌症疫苗或国内外其他抗癌新技术帮助的患者,可将近期病理报告、出院小结、治疗经历等资料汇总后,提交至医学部,详细评估病情。
γδT细胞介导的免疫疗法安全可行,淋巴系统恶性肿瘤病情稳定长达13个月
为了解决淋巴系统恶性肿瘤复发或对常规治疗(如放化疗等)产生耐药性的问题,开展了一项“IL-2联合帕米磷酸盐刺激γδT细胞,用于治疗淋巴系统恶性肿瘤”的临床研究”。本次研究入组了19例淋巴系统恶性肿瘤患者,包括低度B细胞非霍奇金淋巴瘤(B-NHL,11例)、多发性骨髓瘤(MM,8例)、慢性淋巴细胞白血病(CLL,4例)、边缘区淋巴瘤(MZL,2例)、滤泡中心淋巴瘤(FCL,4例)、免疫细胞瘤(IC,1例)。这些入组患者大多(74%)病情严重,接受帕米膦酸盐/IL-2作为第二次或后续挽救治疗。
结果显示:治疗后客观缓解率(ORR)达33%,有3例患者达到部分缓解(PR)。另有3例达到病情稳定(SD),其中2例患者病情稳定状态分别持续长达13个月、6个月。
值得一提的是,有1例获得部分缓解(PR)的患者(患者8B),确诊为复发性滤泡中心淋巴瘤,除多处淋巴结受累外,还出现多处皮下表现。开始帕米膦酸盐/IL-2治疗后,淋巴结表现消退缓慢,但皮下结节迅速消失(详见下图)(图 3)。
▼患者8B治疗前后CT图像对比
▲图源“Blood”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,帕米膦酸盐联合低剂量IL-2,在体内刺激γδT细胞是一种安全可行的免疫治疗方法,可用于多发性骨髓瘤、低度非霍奇金淋巴瘤等淋巴系统恶性肿瘤的治疗。该研究也首次证明了γδT细胞介导的免疫疗法是可行的,还可诱导客观的肿瘤反应!
γδT细胞助晚期肺癌/肝癌患者,生存期延长≥10个月
γδ T细胞无需树突状细胞(DC)的参与即可直接杀死靶细胞,并在抗肿瘤和抗感染免疫中发挥双重功能。其中,Vγ9Vδ2亚群是人类外周血中γδ T细胞中占主导地位的亚群,能以不依赖人类白细胞抗原(HLA)的方式识别靶细胞,被认为是细胞肿瘤免疫治疗的极具潜力的候选细胞。
一项关于“Vγ9Vδ2细胞治疗晚期癌症的临床研究”中,有18例患者(包括10例肺癌、8例肝癌)接受了≥5次细胞输注治疗。
结果显示:入组患者的生存期显著延长,γδ T细胞回输治疗使87.5%的肝癌患者、80%的肺癌患者生存期延长≥10个月。令人兴奋的是,在2020年6月的最新随访中,5例患者仍然存活,对应生存期为30~35个月!
1、对于肝癌组:接受γδ T细胞治疗的患者的中位生存时间为23.1个月,而未接受治疗的患者中位生存时间仅为8.1个月。值得一提的是,在2020年6月的随访中,3例患者仍存活,目前生存期长达30~35个月(详见下图)。
▲图源“Cell Mol Immunol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、对于肺癌组:接受γδ T细胞治疗的患者的中位生存时间为19.1个月,而未接受治疗的患者中位生存时间仅为9.1个月。在2020年6月的随访中,有2例患者的生存期也达到了30~35个月(详见下图)。
▲图源“Cell Mol Immunol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
总之,上述研究结果显示,接受≥5次Vγ9Vδ2 T细胞治疗的晚期癌症患者,大多延长了生存期,这也初步验证了同种异体Vγ9Vδ2 T细胞治疗的有效性。
小编寄语
γδT细胞因具有强大的肿瘤杀伤活性、卓越的免疫监视特性、独特的肿瘤抗原识别能力等优点,是治疗血液肿瘤和实体瘤的“新晋明星细胞”。更为惊喜的是,γδT细胞不仅能与传统抗癌手段(如分子靶向药物、化疗、手术等)联用;近年研究人员还将其与CAR-T细胞、癌症疫苗等“强强联合”,开辟新型抗癌手段,以尽可能增强抗癌疗效,改善癌症患者的预后,比如文中提到的香港大学正在研发的γδ-T细胞外泌体疫苗,就是将γδ-T细胞与癌症疫苗强强联合的产物,以实现双重抗癌疗效!
如果您对目前的治疗方案不满意,或想寻求γδT细胞、癌症疫苗等国内外新型抗癌疗法的帮助,可以将影像学报告、近期病理检查结果、出院小结、治疗经历等资料,提交至医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Wang X,et al.Tumor vaccine based on extracellular vesicles derived from γδ‐T cells exerts dual antitumor activities[J]. Journal of Extracellular Vesicles, 2023, 12(9): 12360.
https://isevjournals.onlinelibrary.wiley.com/doi/10.1002/jev2.12360
[2]Ma L,et al.A close look at current γδ T-cell immunotherapy[J]. Frontiers in immunology, 2023, 14: 1140623.
https://www.frontiersin.org/journals/immunology/articles/10.3389/fimmu.2023.1140623/full#f6
[3]Neelapu S S,et al.A phase 1 study of ADI-001: anti-CD20 CAR-engineered allogeneic gamma Delta1 (γδ) T cells in adults with B-cell malignancies[J]. Blood, 2022, 140(Supplement 1): 4617-4619.
https://ashpublications.org/blood/article/140/Supplement+1/4617/491178
[4]Wilhelm M,et al.γδ T cells for immune therapy of patients with lymphoid malignancies[J]. Blood, 2003, 102(1): 200-206.
https://ashpublications.org/blood/article/102/1/200/16804/T-cells-for-immune-therapy-of-patients-with
[5]Xu Y,et al.Allogeneic Vγ9Vδ2 T-cell immunotherapy exhibits promising clinical safety and prolongs the survival of patients with late-stage lung or liver cancer. Cell Mol Immunol. 2021 Feb;18(2):427-439.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8027668/
[6]https://www.hku.hk/press/news_detail_27134.html
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
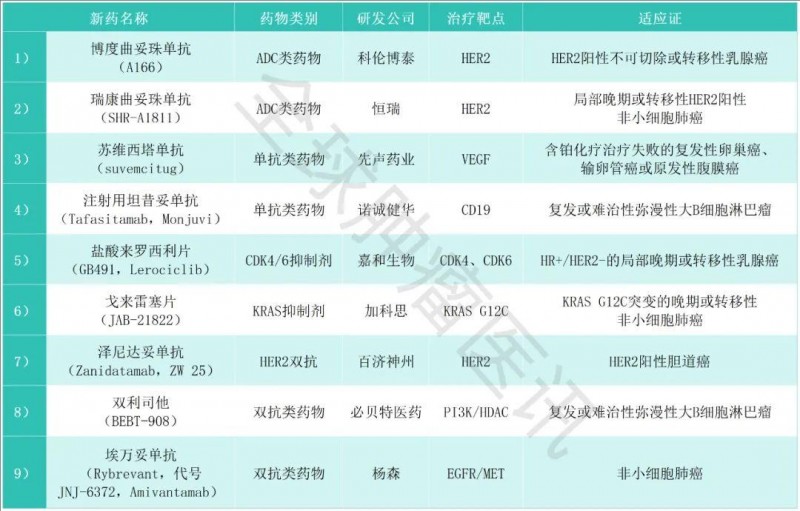
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




