全球首个BCMA CAR-T疗法在日本获批!国内第3款有望年后获批,更多癌症患者将获益!
全球首个BCMA CAR-T疗法在日本获批!国内第3款CAR-T细胞疗法有望年后获批,更多癌症患者将获益
对于癌症的治疗和攻克,我国的医学家们从未停止过研究创新的脚步,从最初的化疗药,再到现如今的靶向、免疫治疗,我们距离治愈癌症的目标也越来越近。而近期内最火的癌症疗法,当属于免疫疗法中的嵌合抗原受体T细胞(CAR-T)。
作为一种“活的”药物,CAR-T疗法与传统药物有着很大的区别。它是一种治疗肿瘤的新型精准靶向疗法。通过基因工程技术将T细胞激活,并装上定位导航装置CAR(肿瘤嵌合抗原受体),将T细胞这个普通“战士”改造成“超级战士”,即CAR-T细胞,专门识别体内肿瘤细胞,并高效杀灭肿瘤细胞,从而达到治疗恶性肿瘤的目的。与传统的化疗和造血干细胞移植相比,它对肿瘤细胞的杀伤更为精准,在提高疗效的同时大幅减轻了毒副作用。
随着阿基仑赛注射液、瑞基奥仑赛注射液前后在中国获批上市,癌症治疗领域火速掀起一阵“CAR-T热”,中国在2021年正式迎来细胞免疫治疗元年!
这一蜕变或许有望将“抗癌”变为“治癌”,迎来反击癌症的新时代。比起“治标不治本”经常会复发的传统疗法,调用患者体内自身免疫系统的CAR-T可以说是目前最先进的治疗手段。
目前CAR-T疗法的研究进展也可谓是日新月异。就在1月20日,百时美施贵宝(BMS)宣布,日本厚生劳动省已批准B细胞成熟抗原(BCMA)导向的CAR-T细胞疗法Abecma(idecabtagene vicleucel,ide-cel),用于治疗复发和难治性多发性骨髓瘤(R/R MM)成人患者。
具体适应症:先前已接受过至少3种治疗(包括免疫调节剂、蛋白酶体抑制剂、抗CD38抗体)且在最后一种治疗中经历疾病进展或治疗后复发的R/R MM成人患者。

全球首个BCMA CAR-T疗法在日本获批!针对多发性骨髓瘤!
Abecma是全球第一个获得监管批准的BCMA CAR-T细胞疗法,于2021年3月在美国、2021年8月在欧盟获得批准。
Abecma的上市,将为R/R MM患者提供一种新的、有效的、个性化治疗方案,仅需一次输液即可实现快速、深度、持久的缓解。在临床研究中,Abecma在接受治疗的患者中安全性已得到很好的证实,细胞因子释放综合征(CRS)和神经毒性(NT)大多数为低级,具有可预测的早期发病,并能快速消退。

此次日本批准,基于在日本、美国、欧盟、加拿大开展的一项全球2期临床研究BB2121-MM-001、一项在美国开展的1期研究CRB-401的数据。
研究数据
BB2121-MM-001中有128例非日本患者和9例日本患者接受了ide-cel输注治疗。结果显示,在128例非日本患者中,客观缓解率(ORR)为73.4%,与50%的阈值相比具有统计学意义。在9例日本患者中,客观缓解率为88.9%。
在CRB-401试验中,在62例患者中的客观缓解率为74.2%,在38例患者中的客观缓解率为84.2%。
据公开资料显示,在国内,进入临床阶段的CAR-T疗法多达36款,除了复星凯特阿基仑赛、药明巨诺瑞基奥仑赛以外。诺华的Kymriah正处于III期临床阶段,传奇生物BCMA CAR-T正处于II期临床阶段。而在CAR-T疗法市场,这种你追我赶的背后,也使得竞争进入白热化阶段,中国CAR-T细胞治疗行业必将迎来崭新的竞争格局。
其中,传奇生物的靶向BCMA(B细胞成熟抗原)CAR-T疗法西达基奥仑赛(LCAR-B38M/JNJ-4528,下称cilta-cel)一直备受关注,已经在治疗多发性骨髓瘤的临床试验中表现出卓越的抗癌活性。
此前cilta-cel曾在5月26日被美国FDA授予优先审评资格,然而西达基奥仑赛的审批却遭遇延迟,由2021年11月29日调整至2022年2月28日,相应的,西达基奥仑赛的上市日期也将延迟,据悉此次延迟与产品无关,而是FDA需要更多时间审查公司提交的更新信息。
也就是说,如果一切顺利,cilta-cel将有望成为国内第3款获批上市的CAR-T产品,也是首个靶向BCMA的CAR-T疗法!
总缓解率98%!BCMA CAR-T疗法cilta-cel疗效强劲!
6月1日,传奇生物公布了BCMA导向CAR-T细胞疗法cilta-cel(LCAR-B38M CAR-T细胞自体回输制剂/JNJ-4528)的最新研究数据。结果表明,在先前接受过多种疗法(过度预治疗)的复发/难治性多发性骨髓瘤(RRMM)患者中,cilta-cel显示出持续的疗效和持续缓解!

cilta-cel是一种研究性B细胞成熟抗原(BCMA)导向的CAR-T疗法,用于治疗复发或难治性多发性骨髓瘤(RRMM)。这些患者在治疗前平均接受过5种前期疗法,76%的患者接受过5种治疗,86%的患者对5种疗法耐药,其中包括CD38治疗,而且对蛋白酶抑制剂PI和免疫调节剂IMiD双重耐药。简单说就是复发难治、后续缺乏有效的疗法。
此款CAR-T疗法的原理与目前的PD-1/L1不同,它是直接利用患者体内的T细胞,将其在体外进行改造,大量复制后再会输到患者体内,以达到杀灭癌细胞的目的。
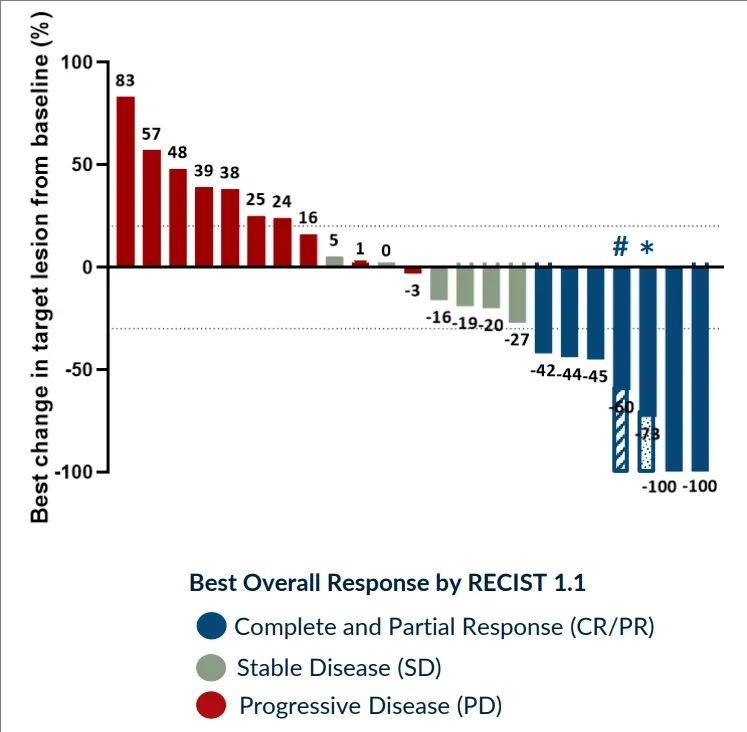
在2021年的ASH会议上,1b/2期CARTITUDE-1研究(n=97)的最新结果显示,中位22个月的长期随访,客观缓解率(ORR)达到了98%,83%的患者达到严格的完全缓解(sCR),强调随着时间的推移缓解加深(sCR从2020年ASH年会上报告的67%增加到83%)。在18个月时,有66%的患者存活且疾病无进展。在2021年ASCO年会上将要公布的最新研究结果显示,中位随访18个月,总生存(OS)率为81%,缓解率在全部预先指定的亚组和不同治疗线数患者中具有可比性。
其实早在今年3月27日,FDA就批准了首款以BCMA为靶点的CAR-T疗法,用于接受过4种以上疗法后复发/难治性多发性骨髓瘤(r/r MM)成年患者。
【传奇生物西达基奥仑赛(cilta-cel)所获国际认可概览】
●2017年12月,申报国内首个细胞治疗产品的药物临床试验申请(IND),并于2018年3月获得药物临床试验批件。
●2018年5月,获得美国FDA的IND许可
●2019年2月,FDA授予JNJ-4528孤儿药资格
●2019年4月,欧洲药品管理局( EMA)授予优先药物(PRIME)资格,成为中国首个获得欧洲药品管理局(EMA)优先药物(PRIME)资格的CAR-T产品
●2019年12月,美国FDA授予突破性疗法认定
●2019年12月,获国家“重大新药创制”科技重大专项支持
●2020年8月,纳入中国突破性治疗品种名单
●2020年12月,向美国食品和药物管理局(FDA)滚动提交生物制品许可申请
●2021年1月,欧洲药品管理局(EMA)的人类用药品委员会(CHMP)已接受对其上市许可申请(MAA)进行加速审评的请求
●2021年5月,欧洲药品管理局(EMA)接受关于申请批准西达基奥仑赛(cilta-cel)用于治疗复发或难治性多发性骨髓瘤成人患者的上市许可申请
●2021年5月,Cilta-cel获得美国食品药品监督管理局优先审查
目前,无癌家园有多款实体瘤及血液肿瘤的CAR-T临床试验正在进行招募,有意向者可咨询医学部具体评估病情!

新型CAR-T疗法固守血癌,进击实体瘤,不断突破瓶颈!
其实2021年10月19日,传奇生物在研发日活动上,介绍了最新的细胞疗法布局及动态,除了大家熟悉的cilta-cel外,而且还谈及在治疗实体瘤方面的重要研发项目及构建的同种异体CAR-T疗法技术平台方面的突破。
01、惊喜!首例CAR-T治愈的多发性骨髓瘤患者生存超5年!
国外的Emily在2021年成功迎来了无癌生存的9年,俨然成为全球CAR-T疗法的“代言人”。在中国也存在这样一位被CAR-T疗法彻底改变了命运的幸运儿。闵先生在54岁被确诊患有一种特殊的罕见病——多发性骨髓瘤。家庭经济贫困的他当时没有药物可用,有幸参加了CAR-T疗法的临床试验。虽然治疗的过程不是一帆风顺的,但经过3次的治疗后,闵先生身上的包块全部消失,疼痛没有了。
惊喜的是,截至2021年6月4日,闵先生无癌生活整整5年了,这才癌症治疗领域,就是理论上所说的临床治愈。

闵先生治疗前后对比图
02、治疗30天后,复发/难治性非霍奇金淋巴瘤患者病灶几乎完全消失
利用不依靠基因编辑阻断TCR信号的同种异体CAR-T技术平台,开发的CAR-T疗法LUCAR-20S已经进入1期临床试验。目前已经有5名复发/难治性非霍奇金淋巴瘤患者接受给药。其中3名患者(60%)获得部分缓解,尚未发现剂量限制毒性。其中一名患者在接受治疗30天后,放射性成像检测显示所有病灶几乎完全消失,骨髓活检仍为阳性,因此被判定为部分缓解。

接受LUCAR-20S治疗的案例报告
克服治疗实体瘤障碍,新型CAR-T经多种优化,不断突破
虽然,CAR-T疗法在实体肿瘤方面如肝癌、胃癌、胰腺癌等消化系统肿瘤中也取得了一定的疗效,但是少之又少,这主要是碍于靶点选择困难、CAR-T细胞进入肿瘤组织困难、CAR-T细胞进入肿瘤组织后容易被其他免疫抑制性的分子或细胞所阻挡无法发挥作用等。
但国内外的学者针对CAR-T进行了多种改造,不断地发现新靶点,以用于治疗多种实体肿瘤。
01、治疗胃癌和胰腺癌
传奇生物的LB1908是一款靶向Claudin18.2(CLDN18.2)的CAR-T疗法。CLDN18.2在胃癌、胰腺癌等癌症类型中表达,是目前抗癌药物开发的热门靶点。然而与它同源性很高的CLDN18.1在人体的肺组织中表达。这意味着,CAR-T疗法需要对CLDN18.2具有高度特异性,否则有可能攻击健康肺组织,导致严重毒副作用。
LB1908利用了VHH抗体设计(这种抗体因为没有传统的轻链,比人体产生的抗体更为小巧,但是可以和传统抗体一样与抗原紧密结合)确保了它对CLDN18.2具有高度的特异性。在临床前胃癌和胰腺癌的动物模型中,它都表现出强力的抗癌活性。

LB1908简介(图源传奇生物官网)
目前,这款在研CAR-T疗法已经进入剂量递增1期临床试验。在首例接受最低剂量LB1908治疗的患者中,它表现出良好的安全性和初步抗癌活性。在接受治疗180天后,患者疾病稳定,而且在骨盆的肿瘤缩小15%,位于身体其它部位的病灶显著缩小,患者的生活质量也获得显著提高。

接受最低剂量LB1908治疗患者表现出临床缓解征兆
02、治疗肝癌、肺鳞癌、生殖细胞癌
LB2101是一款靶向GPC-3的“武装”CAR-T疗法。它在表达靶向GPC-3的嵌合抗原受体(CAR)以外,还同时表达着一个被肿瘤微环境中的信号激活的跨膜蛋白。因此,它不会影响CAR-T细胞特异性,还能改善细胞的浸润、增殖和持久性。
在动物实验中,这款疗法与没有“武装”起来的CAR-T疗法相比,显示出更高的抗癌活性,而且在动物体内的细胞扩增幅度更大。

LB2101(紫色)显著改善CAR-T疗法功能
03、治疗小细胞肺癌
LB2102是一款靶向DLL3的CAR-T疗法。DLL3是一种在小细胞肺癌(SCLC)和某些神经内分泌肿瘤中广泛表达的潜在靶点。LB2102使用了VHH抗体技术和克服肿瘤微环境抑制因素的“武装”CAR-T技术。
临床前体内研究显示,这一疗法与传统CAR-T疗法相比,更有效地缩小肿瘤,而且外周血中的CAR-T细胞和浸润肿瘤的CAR-T细胞数目都显著提升。

LB2102(红色)的体内动物实验结果
CAR-T疗法的获批将为中国患者带来更多临床获益
阿基仑赛注射液、瑞基奥仑赛注射液的纷纷获批上市,首先对符合其适应症的患者又增加了一种新的治疗选择,也就多了一份治愈的希望。
其次,这两次的获批意味着CAR-T疗法已经被国内环境所接纳,未来更多CAR-T产品或适应症的研发及审批都将得到提速。
经过近30年的发展,CAR-T细胞疗法已然兴起,该领域不会孤立的发展。目前已经有一些试验表示,很可能最好的肿瘤响应需要特异性的CAR-T疗法结合小分子治疗、免疫调节、化疗和基于抗体的治疗等多种治疗的协同作用,这些试验不提供特定的CAR,而是针对一些可能的抗原靶点设计CAR,这些抗原靶点取决于病人疾病的免疫表型。
在个性化医疗的时代,无论是单一疗法还是联合疗法,CAR-T无疑是医药领域火热的研究对象,希望今后能够取得更多突破,在血液肿瘤和实体瘤的治疗上展现其独特的实力!
参考文献
https://news.bms.com/news/corporate-financial/2022/Bristol-Myers-Squibb-Receives-Approval-for-Abecma-idecabtagene-vicleucel-the-First-CAR-T-Therapy-Approved-for-the-Treatment-of-Multiple-Myeloma-in-Japan/default.aspx
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
肠癌患者找到"重生密码&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

绝境逆袭!NY-ESO-1 TCR-T疗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
结直肠癌六大治疗性疫苗重磅集结!最长控瘤
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




