《科学》重大突破:免疫细胞治疗实体瘤,“多弹头导弹”只杀癌细胞
肿瘤细胞治疗,肿瘤细胞疗法
我们都知道,免疫细胞通过癌细胞上的标记物来识别出癌症。但是,有些标记物既出现在癌细胞上,也出现在正常细胞上。那么,能不能有一种免疫细胞疗法,既能识别癌细胞和正常细胞共有的标记物,但是它只会杀死癌细胞,而不会伤害正常的细胞?
近期,发表在《科学》杂志上的研究告诉我们,这是有可能的。

这篇研究公布了CAR-T细胞疗法治疗实体瘤的新进展,研究人员通过新技术对T细胞进行改造,可以使得CAR-T细胞仅杀死癌细胞,而不会杀死与癌细胞具有相同标记蛋白的正常细胞,这有望解决CAR-T细胞疗法应用于实体瘤的一大难题,为其未来应用于乳腺癌、卵巢癌等实体瘤的治疗开辟新道路[1]。
"多弹头导弹",精准消灭"癌敌"
CAR-T细胞疗法在血液系统相关的恶性肿瘤中大展身手,但是在实体瘤上的应用却不尽人意,这是因为实体肿瘤细胞会营造属于自己的肿瘤微环境,防止CAR-T细胞直接攻击到自己。

此外,像乳腺癌、卵巢癌之类的实体瘤,这些肿瘤表面上的许多抗原也存在于正常组织中,导致CAR-T细胞不能很好地区分两者,作战过程中常不分青红皂白就将癌细胞和正常组织一锅端,所以针对这些癌症的CAR-T细胞疗法此前一直疗效不佳,患者治疗后不良反应较大,甚至死亡。
然而,在《科学》杂志刊登的这项研究中,研究人员声称这些难题都有望得到解决。美国和芬兰两国合作的这项研究开发了一种能精准识别HER2细胞蛋白标志物的CAR-T细胞疗法,此技术能使得CAR-T细胞只杀死癌细胞,而不会伤害到正常细胞,从而提升了CAR-T细胞疗法临床应用的安全性。

图片来自文献[1]
图为两步正反馈通路消灭癌细胞具体机制
HER2(人表皮生长因子受体-2)是乳腺癌、卵巢癌等实体肿瘤的特异蛋白标志物,由于基因扩增,HER2表达也在肿瘤中倍增,其大量存在于肿瘤细胞表面。此研究基于HER2的这一特点设计了一个两步正反馈调节机制,让T细胞根据HER2的表达程度来区分靶标,从而消灭高表达HER2的癌细胞,而不伤害低表达HER2的正常细胞。
目前研究团队正在进一步改进该技术,以将其应用于治疗卵巢癌等实体肿瘤。这一新技术就像“多弹头导弹”,能精准消灭敌人,癌细胞很难对其产生抗药性。
多种策略来攻克实体瘤
在CAR-T细胞治疗血液肿瘤取得重大突破后,人们对其治疗实体肿瘤也充满了期待。事实上,近年来,CAR-T细胞治疗实体肿瘤在不断克服难题,取得进展。

https://stm.sciencemag.org/content/13/586/eabb5191
在我国,清华大学的研究团队在2021年3月24号在《科学》子刊发表了CAR-T细胞治疗实体瘤的新结果[2]。设计并构建了一种新型嵌合受体——STAR,也叫做合成T细胞受体抗原受体(Synthetic T cell receptor and Antigen Receptor)。相比传统的CAR-T细胞,这种新型嵌合STAR受体T细胞在多种实体肿瘤模型中的效果更优,有望成为治疗实体肿瘤的新希望。


患者接治疗周期及影像学资料对比,可见治疗后肿瘤明显缩小(图片来源:文献[3])
今年2月18日,国际学术期刊《英国医药杂志》旗下《癌症免疫治疗杂志》报道了国际首个自分泌PD-1抗体CAR-T细胞联合疗法治疗一名晚期难治性卵巢癌患者[3],得到显著成效:患者无进展生存5个月,生存达17个月。这也是我国研究团队取得的成果。
CAR-T细胞治疗实体瘤还有多远
目前,在癌症的免疫疗法中,CAR-T细胞疗法已成为科学界的焦点,其通过激活患者自身免疫系统中的细胞攻击癌细胞,从而达到治疗癌症的效果。
科学家们从患者体内提取T淋巴细胞进行基因改造,再使用病毒载体将嵌合抗原受体(CAR)转运到细胞中,从而帮助T细胞更好地识别和杀死癌细胞。消灭癌细胞的冲锋战场上,当抗原受体细胞识别出特定的表面结构时,它们便开始扩增并杀死指定的靶细胞。
那么CAR-T细胞疗法治疗实体瘤离我们还有多远,多久才能应用到患者身上呢?其实,在科学家们的不懈推进之下,已经陆续有相关成功案例出现。
诚然,目前CAR-T细胞疗法应用于实体瘤治疗还有诸多不足,但值得高兴的是,随着相关临床试验的开展,好消息一个接一个,战胜病魔的患者也越来越多。相信在不久的将来,CAR-T细胞疗法定能在实体瘤治疗领域不断突破,造福大众。
参考文献:
[1]Hernandez-Lopez, R. A., Yu, W., Cabral,K., Creasey, O., Del Pilar Lopez Pazmino, M., Tonai, Y., De Guzman, A., Mäkelä,A., Saksela, K., Gartner, Z. J., Lim, W. A., & 15, *. (2021). T cellcircuits that sense antigen density with an ultrasensitive threshold. BioRxiv,March, 2021.01.21.427654.
[2]ChimericSTAR receptors using TCR machinery mediate robust responses against solid tumors
[3]αPD-1-mesoCAR-T cellspartially inhibit the growth of advanced/refractory ovarian cancer in a patientalong with daily apatinib
本文首发自博雅干细胞
作者:杭州师范大学 红枣
专家审核:江苏大学附属医院 李晶 教授
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
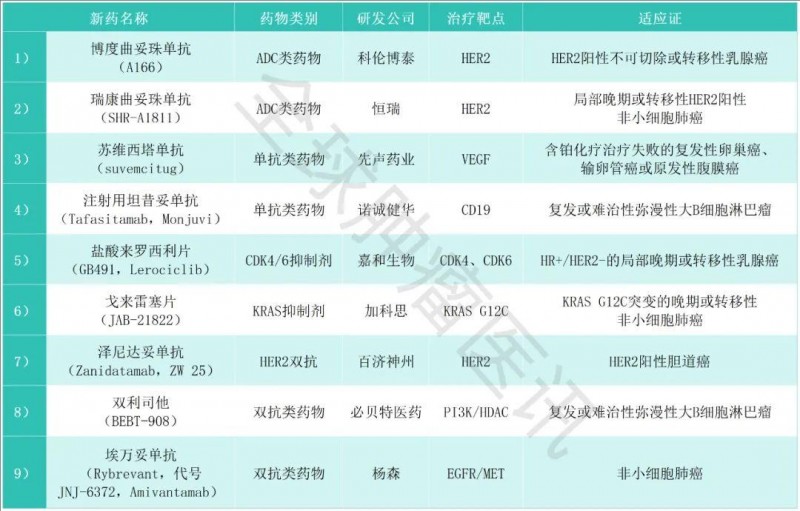
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05



 Qzone
Qzone



![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




