CAR-T 疗法新时代—通用型CAR-T细胞
新一代CAR-T细胞疗法,第五代CART,通用型CART治疗
CAR-T疗法
CAR-T(Chemeric Antigen Receptors T-cell Immunotherapy)疗法,全称嵌合抗原受体T细胞免疫疗法,其主要原理是,从癌症病人身上分离免疫T细胞,利用基因工程技术为T细胞引入一个能够识别肿瘤细胞并同时激活T细胞的嵌合抗体,然后将扩增好的CAR-T细胞回输到病人体内。
截至目前,全球共两种CAR-T产品获批上市,分别是来自诺华的Kymriah和Kite制药的Yescarta,它们分别用于治疗儿童和年轻成人的急性淋巴细胞白血病和特定类型大B细胞淋巴瘤。
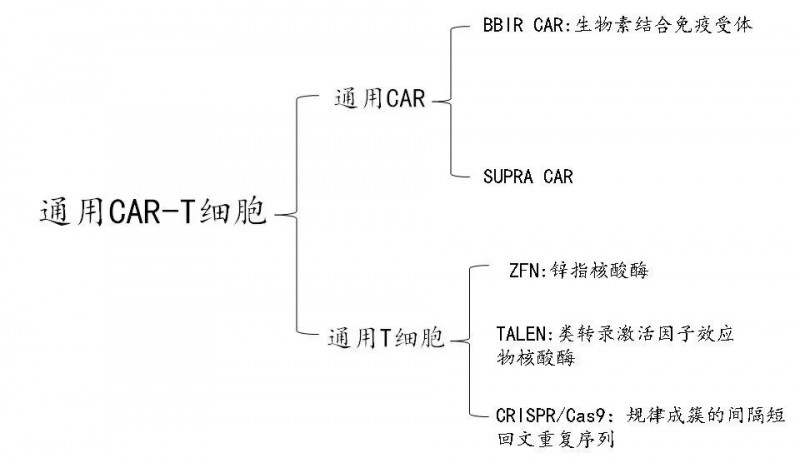
由于目前大部分的CAR-T细胞都是利用患者自身的T细胞来产生的,属于个体化产物,而患者与患者之间存在个体差异,产生定制T细胞是一个昂贵且耗时的过程。除此之外,每种CAR具有固定的抗原特异性,每种CAR-T制剂仅能靶向特定的表位,因此科学家们致力于开发一种通用型CAR-T细胞,生产一种现成的(off-the-shelf)即用型治疗剂。本篇文章作者总结了通用CAR、通用T细胞的设计原理和开发以及通用型CAR-T细胞临床应用的最新进展。
CAR结构
嵌合抗原受体(CAR)是CAR-T的核心部件,赋予T细胞HLA非依赖的方式识别肿瘤抗原能力,这使得经过CAR改造的T细胞相较于天然T细胞表面受体TCR能够识别更广泛的目标。
第1-4代CAR结构如图1所示。
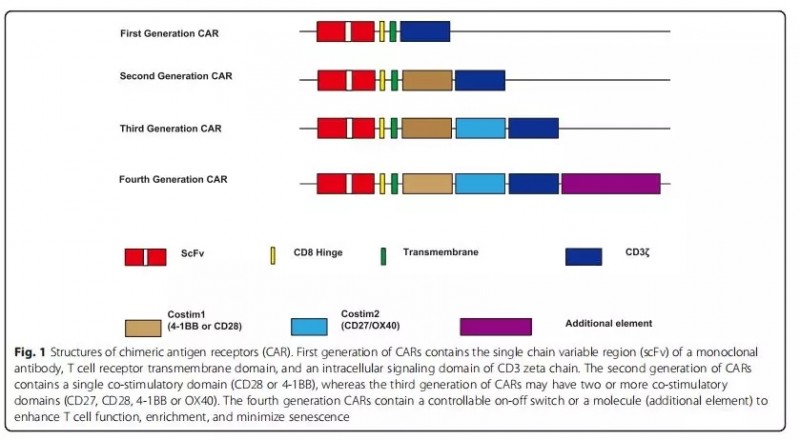
第一代CAR含有一个胞内信号组分,能够识别靶抗原并激活T细胞,但因为无共刺激分子,不能转导增值信号和诱导细胞因子产生,所以T细胞无法增殖而导致杀伤肿瘤效果不佳。
第二代CAR增加了一个共刺激分子或者可诱导共刺激分子,在没有外源性共刺激分子的情况下,T细胞也能持续增值并释放细胞因子。
第三代CAR包含了两个共刺激分子,提高T细胞的杀伤能力。
第四代CAR在此基础上将额外的分子原件插入到CAR中以表达功能性转基因蛋白,例如诸如白细胞介素基因的功能原件,可以提高杀伤能力,或者是调控开关、自杀基因,以提高CAR-T疗法的安全性和可控性。
通用CAR的设计原则
目前CAR-T疗法受到抗原特异性和可拓展性的限制,为了提高CAR的灵活性,希望能设计一种通用型CAR,以便能识别更多的抗原。通用型CAR使用“第三方”中间系统,拆分抗原靶向结构域和T细胞信号单位,以赋予CAR-T细胞识别多种抗原的能力,这种“第三方”中间系统有BBIR CAR和 SUPRA CAR。
BBIR CAR:生物素结合免疫受体
靶向生物素的免疫受体(biotin-bidingimmune receptor,BBIR)T细胞,是将活化的生物素与抗体相结合,亲和素结合在CAR-T细胞表面,通过亲和素和生物素之间非共价作用实现T细胞的靶抗原激活。BBIR系统含有二聚体亲和素,可以有效识别和结合多种生物素化抗原特异性分子,如scFV、mAbs或肿瘤特异性配体(图2)。
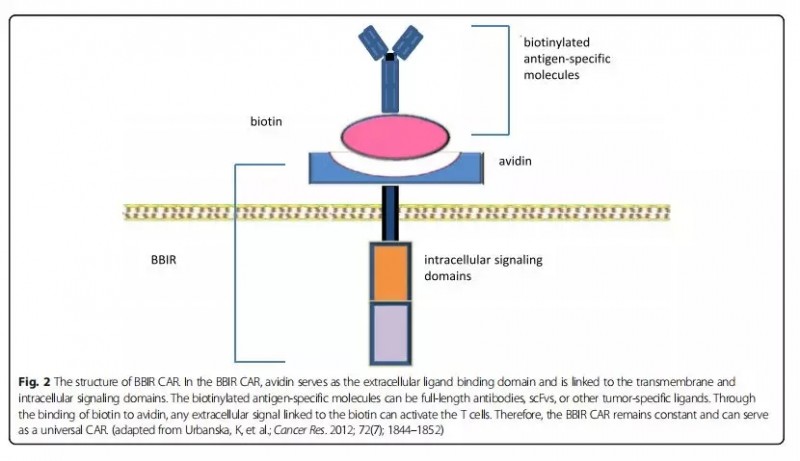
研究结果显示,在0.1ng/mL低浓度生物素化分子的情况下,BBIR T细胞仍能与靶向抗原发生特异性反应。通过在生物素上逐步添加相应的抗体,发现BBIR T细胞可以按顺序识别多种肿瘤相关抗原,说明BBIR系统可以拓展常规CAR方法,具有产生无限抗原特异性T细胞的潜力。
SUPRA CAR
为了增强CAR的灵活性和可用性,科学家发明了一种分离、通用、可编程式(split、universal、programmable, SUPRA)的CAR系统。SUPRA CAR是一种双组份受体系统,通用受体是带有亮氨酸适配器的T细胞(zipCAR),另一部分是带有亮氨酸适配器的能靶向特异性抗原的scFV(zipFV)(图3)。
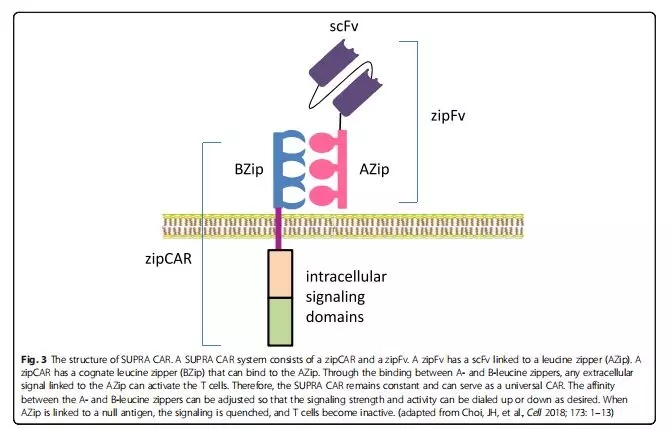
这种具有亮氨酸适配器的分体式SUPRA CAR的临床优势有:
1、自由切换zipFV: zipFV可以针对不同的肿瘤抗原进行切换,或者通过扩增组合成针对多种肿瘤抗原的CART细胞,而无需进一步修饰T细胞。
2、能控制细胞活性和毒性:SUPRA CAR系统可以通过两个亮氨酸适配器的结合强度来控制细胞的活性,从而调节T细胞活化的程度。还可以通过没有特异性抗原靶标的zipFV竞争结合通用系统上的亮氨酸适配器,减少T细胞的活化程度从而控制细胞毒性。
3、可改变信号域和效应细胞的类型:例如研究人员已经开发一种正交的SUPRA CAR系统,可以独立调节不同的T细胞亚群。
通用T细胞的设计原则
生产通用CAR-T细胞的设计原则是从同种异体健康受体产生肿瘤抗原特异性T细胞,通过基因编辑的方法破坏T细胞的TCR基因和HLAⅠ类基因,消除移植物抗宿主病(GVDH)。ZFN、TALEN和CRISPR/Cas9是比较常用的基因编辑手段。
ZFN:锌指核酸酶
ZFN是一种特异性DNA核酸内切酶,针对目的基因序列设计并合成ZFN,使之对DNA进行特异性切割,从而形成DNA双链断裂区,通过非同源末端连接或借助同源重组等方式完成DNA的修复连接,从而导致靶基因表达丧失。
使用这种基因编辑技术,破坏T细胞中TCRα恒定区的表达,使TCR功能丧失,从而不能对TCR特异性刺激做出反应。使用相同的方法,破坏HLA基因(图4),研究结果显示TCR-/HLA-缺陷型的T细胞在动物模型中不引起GVDH。
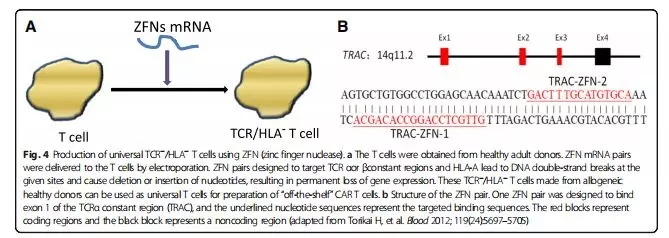
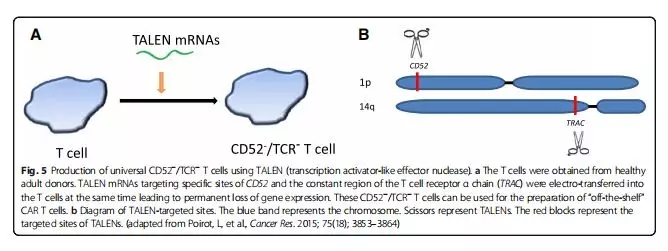
TALEN:类转录激活因子效应物核酸酶
TALEN也是一种位点特异性核酸内切酶,图5是应用TALEN基因编辑技术生产通用的CD52-/TCR- T细胞,同时破坏CD52和TCRα(TRAC)基因,CD52抗原是一个抗体依赖性补体靶点,所以切除CD52基因,可以更好地避免GVDH。
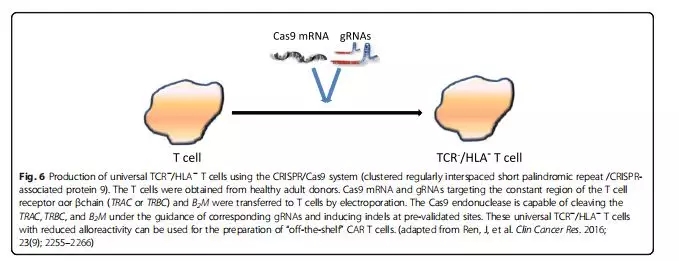
CRISPR/Cas9:规律成簇的间隔短回文重复序列
由于ZFN和TALEN都需要针对不同的基因设计特定的核酸酶对,导致该技术的广泛应用受到限制。CRISPR-Cas9系统于2012年被发现,科学家们利用靶点特异性的RNA引导Cas9核酸酶带到基因组上的具体靶点,从而对特定基因位点进行切割、修饰。如图6所示,通过CRISPR方案可以一次性切除内源性TCR和HLAⅠ类基因产生同种异体的通用CAR-T细胞。与ZFN和TALEN相比,CRISPR/Cas能够极快地测试任何新提出的基因改造。
CRISPR-Cas9已被成功用于CAR-T细胞的多重基因编辑,例如两种基因(TRAC和B2M)和三种基因(TRAC、B2M和PD-1),通过敲除人PD-1基因,阻断免疫检查点的抑制信号,可以增强CAR-T细胞的体内抗肿瘤活性。
FT819,IPSC CARIT cells
Fate Therapeutics公司开发了一款现成的CAR-T细胞产品FT819,FT819来自健康供试者,创建一个能诱导多功能干细胞(IPSC)主细胞系,并使用主细胞系生产大量不受患者限制的“通用型”CAR19T细胞。研究人员通过将CAR引导至TCRα(TRAC)基因座,确保完全消除GVDH,除此之外,CAR19T细胞含有CD19的基因,能靶向CD19阳性肿瘤细胞是能显示出高效的细胞毒性作用。
Fate Therapeutics公司下一步计划是开展人体临床实验,全面评估CARIT产品的安全性和有效性。
通用CAR-T细胞临床应用
TALEN基因编辑的TCR缺陷型CAR-T细胞处于临床试验阶段,两名患有高度复发难治性CD19+B-ALL的婴儿用通用CAR-T细胞治疗后,都得到了缓解,并成功接受了同种异体干细胞移植。
两种使用CRISPR-Cas9基因编辑的通用CAR-T细胞都启动了临床试验(NCT03166878,NCT03229876),但目前还没有详细的结果。
通用CAR-T细胞面临的挑战
通过破坏结合“第三方”中间系统的同种异体T细胞的TCR基因和HLAⅠ类基因,可以产生不引起GVDH并能广泛用于生产的通用CAR-T细胞。然而在实际应用中,仍存在一些关键性问题,例如微量TCR阳性的CAR-T细胞引起的GVDH反应、基因编辑过程存在的脱靶效应等,除此之外,还有许多问题需要进行进一步探索,例如:
1、需要更多的临床数据,以确定通用CAR-T细胞的有效性和毒性;
2、长期随访检测急性和慢性GVDH、排斥反应等副作用;
3、建立和统一CAR-T细胞疗法的临床、工业和监管标准。
总结:包括ZFN、TALEN和CRISPR-Cas9在内的基因编辑方法可以产生通用的T细胞,一种分离、通用和可编程的(SUPRA)CAR可以使CAR-T细胞灵活地针对不同的靶点,还能有效控制T细胞活性。新一代通用CAR-T细胞在临床试验中的应用,为癌症免疫治疗提供了新型的治疗手段。
参考文献:Juanjuan Zhao, Quande Lin. et al. Universal CARs, universal T cells, and universal CAR T cells. Journal of Hematology & Oncology.(2018)11:13
文章来源:生物制品圈 小文
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




