【临床试验招募】正大天晴TQB3558临床试验
招募标准
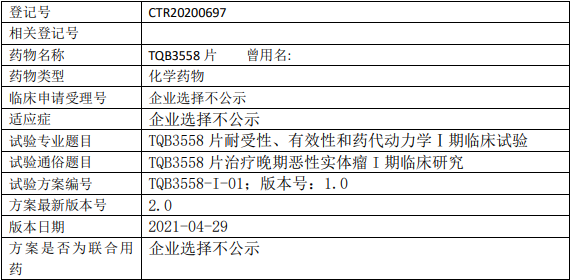
正大天晴TQB3558临床试验,TQB3558片治疗晚期恶性实体瘤I期临床试验
1、试验目的
评价TQB3558片在中国晚期恶性实体瘤成人受试者中的安全性和耐受性,确定最大耐受剂量(MTD)。
评价TQB3558片拓展组的抗肿瘤疗效。
评价TQB3558片在中国晚期恶性实体瘤成人受试者中的药代动力学特征;
评价TQB3558片初步抗肿瘤疗效,为后续临床研究推荐合适的用药剂量和给药方法; 与疗效、作用机制、安全性和/或病理机制相关的生物标志物的研究。
评价 TQB3558 片安全性;
2、试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 75 岁(最大年龄)
性别:男+女
健康受试者:无
入排标准
入选标准
1.经病理和/或细胞学明确诊断的晚期恶性实体肿瘤受试者,缺乏常规的有效治疗方法或常规方法治疗后失败或复发;
2.年龄为 18~75 周岁;ECOG 体力状况:0~1 分;预计生存期超过3 个月;
3.存在 RECIST 1.1 标准定义的可测量病灶;
4.Ⅰa 期优先纳入含 NTRK1、NTRK2 或 NTRK3 基因融合的受试者;Ⅰb 期受试者必须携带 NTRK1、NTRK2 或 NTRK3 基因融合且不含NTRK 基因点突变;
5.需采取有效方法避孕;
6.受试者自愿加入本研究,签署知情同意书,依从性好。
排除标准
排除标准
1.既往接受 TRK 抑制剂治疗(仅Ⅰb 期适用该条);
2. 在受试者首次用药日前 4 周内:参与过任何其他临床试验,或使用过其他抗癌药物,或接受过重大外科手术;
3. 在受试者首次用药日前 7 天内接受过局部放射性治疗;在受试者首次用药日前 4 周内接受过骨髓放疗(面积>30%),或扩野放疗;
4. 过去 2 年曾患其他恶性肿瘤,已治愈的或局部可治愈癌症除外,例如皮肤基底癌或鳞状细胞癌、浅表膀胱癌、子宫颈癌或乳腺原位癌;
5. 已知脊髓压迫、癌性脑膜炎;已知或新发中枢系统肿瘤或有中枢神经系统转移的受试者症状控制稳定小于 4 周;
6. 既往存在间质性肺病,药物性间质性肺病,需要类固醇治疗的放射性肺病史,或临床上有活动间质性肺病迹象严重的活动性感染;
7. 不能控制的需要反复引流的胸腔积液、心包积液或腹水;
8. 明显的心血管疾病,例如美国纽约心脏病协会(NYHA)分级为2 级及以上的心力衰竭、既往 3 个月内的心肌梗死、不稳定的心律失常(包括 QTC 间期≥480 ms)或不稳定的心绞痛;
9. 有免疫缺陷病史,包括 HIV 检测阳性或患有其它获得性、先天性免疫缺陷疾病,或有器官移植史者;
10. 无法控制的细菌、真菌、病毒感染;
11. 经一种药物治疗仍无法控制的高血压(收缩压≥ 140 mmHg,舒张压≥ 90 mmHg);
12. 糖尿病受试者血糖控制不佳(空腹血糖(FBG)>10 mmol/L);
13. 乙肝病毒复制活跃(DNA>500 cps/mL 或正常值上限),或有活动性肝炎;
14. 既往具有影响药物代谢的慢性或严重肝病史(仅 Ia 期适用该条);
15. 首次用药前存在既往抗肿瘤治疗引起的未恢复的毒性(不包括脱发);
16. 存在未愈合的伤口、溃疡或骨折;
17. 具有影响口服药物吸收的多种因素(例如无法吞咽、慢性腹泻、难以控制的恶心呕吐、胃肠道切除或手术史);
18. 具有精神类药物滥用史且无法戒除或有精神障碍者;
19. 正在使用 CYP3A 抑制剂或诱导剂或未超过 5 个药物半衰期者;
20. 处于哺乳期;
21. 根据研究者的判断,有严重的危害受试者安全或影响受试者完成研究的伴随疾病者。
4、研究者信息
1、主要研究者信息
姓名:沈赞
学位:医学博士
职称:主任医师
单位名称:上海市第六人民医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 上海市第六人民医院 | 沈赞 | 中国 | 上海市-上海市 |
| 2 | 上海长征医院 | 臧远胜 | 中国 | 上海市-上海市 |
| 3 | 上海市第一人民医院 | 李琦 | 中国 | 上海市-上海市 |
| 4 | 河南省肿瘤医院 | 陈小兵 | 中国 | 河南省-郑州市 |
| 5 | 青岛市市立医院 | 岳麓 | 中国 | 山东省-青岛市 |
| 6 | 浙江省肿瘤医院 | 方美玉 | 中国 | 浙江省-杭州市 |
| 7 | 浙江省肿瘤医院 | 张沂平 | 中国 | 浙江省-杭州市 |









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




