2021年第一季度FDA新闻回顾:17项重磅大新闻、多款末线“保底”新药上市!
2021年第一季度FDA新闻回顾:17项肿瘤治疗最新进展,多款末线治疗"保底"抗癌新药上市
随着清明假期结束,转眼间2021年的第一个季度也已经走到了尽头。不知道大家有没有什么值得纪念的收获?
在这过去的三个月,或者准确来说,在这过去的两年多里,全世界的医疗资源都集结起来,投入到了抗击新冠病毒的“战斗”当中。但与此同时,抗癌新药的研发进程也丝毫没有停滞,甚至与抗击新冠病毒的药物研发相得益彰、互相促进,进入了另一个快速发展期。
基因药物汇为大家总结了2021年第一季度FDA批准的重磅新药,以及上市药物最新获批的补充适应症或新适应症,希望能为患者们的抗癌路上拂去一些阴霾。
2021年1月14日
药物:克唑替尼(Crizotinib,Xalkori)
适应症:复发或难治的系统性间变性大细胞淋巴瘤
患者:ALK阳性,1岁以上的小儿患者和年轻患者
状态:FDA批准[1]
克唑替尼的一项全新适应症拉开了2021年抗癌药物获批的序幕,能将患者的整体缓解率提升到了88%,完全缓解率更是高达81%;22%的患者缓解持续超过12个月。
目前,ADVL0912试验(NCT00939770)验证了克唑替尼在1~21岁患者中的疗效,年龄较大的患者的安全性和有效性尚未验证。
2021年1月15日
药物:fam-trastuzumab deruxtecan-nxki(Enhertu,DS-8201)
适应症:局部晚期或转移性胃及胃食管交界处癌
患者:HER2阳性,曾接受过曲妥珠单抗治疗,成年患者
状态:FDA批准[2]
这是继乳腺癌之后Enhertu的又一项重磅适应症。作为HER2靶点最经典的ADC药物之一,Enhertu不仅能够作为曲妥珠单抗治疗失败后患者额方案,在一些前线治疗的临床试验中,还展现出了超越曲妥珠单抗的疗效,潜力非常值得期待。
DESTINY-Gastric01试验(NCT03329690)中,接受Enhertu治疗的患者中位总生存期为12.5个月,整体缓解率40.5%,超越了伊立替康或紫杉醇对照组的8.4个月和11.3%。
2021年1月15日
药物:达雷木单抗加透明质酸酶(Darzalex Faspro)
适应症:一线治疗轻链型淀粉样变性病
状态:FDA批准[3]
FDA批准了达雷木单抗加透明质酸酶(Darzalex Faspro)联合硼替佐米、环磷酰胺和地塞米松的联合用药方案,用于一线治疗轻链型淀粉样变性病患者。
ROMORDA试验(NCT03201965)中,联合用药组的患者血液学完全缓解率为42.1%,而接受硼替佐米+环磷酰胺+地塞米松治疗的患者血液学完全缓解率仅有13.5%。
2021年2月3日
药物:纳武单抗(Nivolumab,Opdivo)+博替尼(Cabozantinib,Cabometyx)
适应症:一线治疗晚期肾细胞癌
状态:FDA批准[4]
随着这一适应症获批,纳武单抗的适应症再次得到了拓展。根据CHECKMATE-9ER试验(NCT03141177)的结果,接受纳武单抗+卡博替尼治疗的患者中位无进展生存期16.6个月,整体缓解率55.7%,均显著超过了舒尼替尼治疗的患者的8.3个月和27.1%。目前两组患者的总生存期数据均不成熟,我们可以期待进一步的研究结果。
2021年2月3日
药物:特普替尼(Tepotinib,Tepmetko)
适应症:转移性非小细胞肺癌
患者:MET外显子14跳跃突变,成年患者
状态:FDA加速批准[5]
2月3日登场的重磅批准结果不仅有纳武单抗联合方案,还有重磅MET抑制剂特普替尼。这款药物曾于2020年3月在日本获批上市,此次获得FDA加速批准后,特普替尼成为了第二款获得FDA批准上市的MET抑制剂药物。
此项批准基于Ⅱ期VISION研究(NCT02864992)的结果。研究中共纳入99例患者,其结果显示,接受特普替尼治疗的患者客观缓解率达到42.4%,中位缓解持续时间为12.39个月。
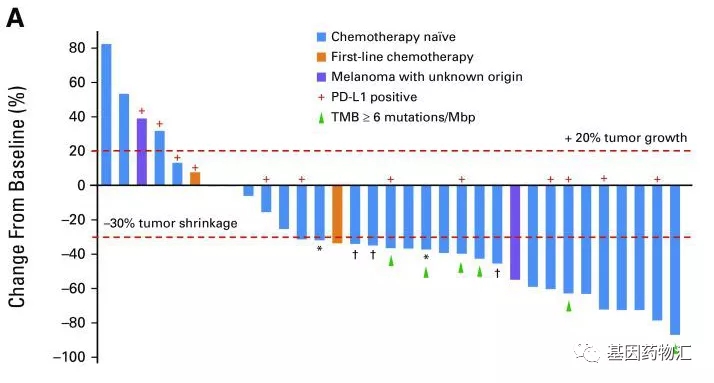
作为重要的非小细胞肺癌原发突变以及EGFR等抑制剂耐药突变,MET抑制剂的研究一直非常多。我们期待更多的新药,尤其是我国药企自主研发、能更容易地被国内患者获得的新药与临床试验项目,真正为国内患者带来帮助。
2021年2月5日
药物:Umbralisib(TGR-1202)
适应症:复发或难治性边缘区淋巴瘤;复发或难治性滤泡性淋巴瘤
患者:曾经接受过至少一种抗CD20疗法的复发或难治性边缘区淋巴瘤(MZL)患者;至少接受过3线全身治疗方案的复发或难治性滤泡性淋巴瘤患者
状态:FDA加速批准[6]
该批准基于UTX-TGR-205试验(NCT02793583)的结果,Umbralisib治疗边缘区淋巴瘤患者的整体缓解率为49%,其中完全缓解率16%,中位缓解持续时间尚未达到;Umbralisib治疗滤泡性淋巴瘤患者,整体缓解率为43%,其中完全缓解率3%,中位缓解持续时间11.1个月。
Umbralisib是一款PI3Kδ与CK1-ε双靶点抑制剂,曾经在边缘区淋巴瘤和滤泡性淋巴瘤两个适应症上获得孤儿药称号,并在边缘区淋巴瘤适应症获得了突破性疗法指定。
2021年2月5日
药物:Liso-Cel(Lisocabtagene Maraleucel,Breyanzi,一种CAR-T细胞疗法)
适应症:大B细胞淋巴瘤
患者:成年患者,在接受至少2种其它类型的全身治疗方案无反应或在治疗后复发
状态:FDA批准[7]
Liso-Cel是一款基于患者自身T细胞的抗CD19疗法。根据TRANSCEND NHL 001试验的结果,接受Liso-Cel治疗的患者,整体缓解率为73%,其中完全缓解率高达53%;患者的中位无进展生存期为6.8个月,中位总生存期为21.1个月;患者的1年生存率为58%。
2021年2月9日
药物:Cemiplimab-rwlc(Libtayo)
适应症:局部晚期基底细胞癌
患者:曾经接受过HHI治疗病情仍进展,或不适合接受HHI治疗
状态:FDA批准[8]
根据1620试验(NCT03132636)的结果,接受治疗的晚期基底细胞癌患者整体缓解率为29%,中位缓解持续时间尚未达到;在达到临床缓解的患者中,超过79%的患者缓解持续超过6个月。
2021年2月9日
药物:Cemiplimab-rwlc(Libtayo)
适应症:转移性基底细胞癌
患者:曾经接受过HHI治疗病情仍进展,或不适合接受HHI治疗
状态:FDA加速批准[9]
根据1620试验(NCT03132636)的结果,接受治疗的转移性基底细胞癌患者,整体缓解率21%,中位缓解持续时间尚未达到;所有达到了临床缓解的患者缓解持续时间均超过了6个月。
2021年2月22日
药物:西米普利单抗(Cemiplimab,Libtayo)
适应症:一线治疗晚期非小细胞肺癌
患者:PD-L1表达水平不低于50%
状态:FDA批准[10]
根据Ⅲ期的EMPOWER-Lung 1试验(NCT033088540)的结果,接受西米普利单抗治疗的患者,中位总生存期为22个月,中位无进展生存期6.2个月,整体缓解率37%;接受化疗的患者,中位总生存期为14个月,中位无进展生存期5.6个月,整体缓解率21%。
在PD-L1表达水平≥50%的患者(共563例)的分析中,接受西米普利单抗治疗时总生存期优势更加显著,中位无进展生存期达到8个月,整体缓解率为39%;接受化疗的患者,中位无进展生存期为6个月,整体缓解率为20%。在PD-L1表达水平≥90%的患者亚组中,整体缓解率更是达到了46%。
2021年2月26日
药物:Melphalan Flufenamide(Pepaxto)
适应症:复发或难治性多发性骨髓瘤
患者:既往接受过4线以上方案治疗,至少一种蛋白酶体抑制剂、一种免疫调节剂和一种CD38单克隆抗体治疗无效
状态:FDA加速批准[11]
2020年8月时FDA曾为Melphalan Flufenamide授予优先审查资格。该批准基于HORIZON研究(NCT02963493)的结果,整体缓解率23.7%,中位缓解持续时间4.2个月。
作为一种末线治疗手段,Melphalan Flufenamide为已经接受过多种治疗方案的患者带来了全新的选择。
2021年3月3日
药物:劳拉替尼(Lorlatinib,Lorbrena)
适应症:一线治疗转移性非小细胞肺癌
患者:ALK阳性
状态:FDA批准[12]
劳拉替尼曾于2018年11月获加速批准,用于ALK阳性转移性非小细胞肺癌的二线或三线治疗,此次补充适应症正式将劳拉替尼提升至一线,大幅度地拓展了其适用范围,同时为ALK阳性的非小细胞肺癌患者开拓了全新的治疗手段。
此项批准基于关键性的Ⅲ期CROWN试验(NCT03052608)的结果。尤其在治疗脑转移患者方面,劳拉替尼取得了突破性的结果,治疗基线存在脑转移的患者,整体缓解率为82%,其中完全缓解率高达71%。
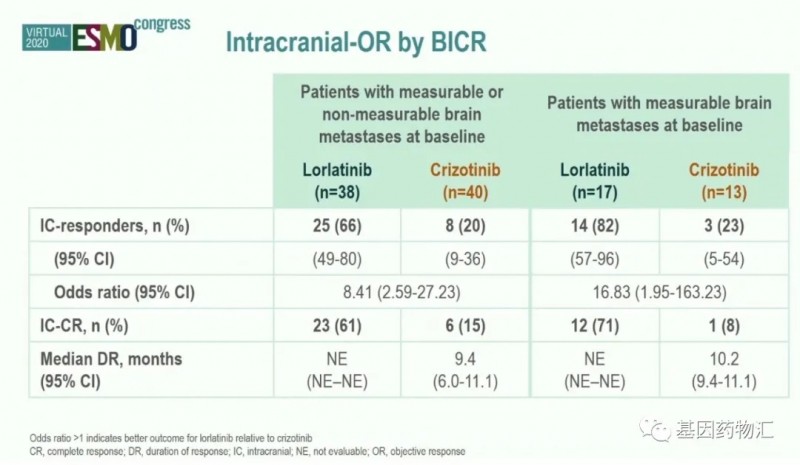
接受克唑替尼治疗的患者,中位无进展生存期9.3个月,接受劳拉替尼治疗的患者,中位无进展生存期尚未达到。接受劳拉替尼治疗的患者中,79%的患者颅内缓解持续时间超过了12个月,这一数据在接受克唑替尼治疗的患者中为0。
我们都知道,尽管克唑替尼治疗ALK突变的非小细胞肺癌患者整体疗效非常出色,但这款药物的入脑性并不好,脑转移疾病的治疗仍是一个亟待突破的领域。劳拉替尼的强势登场让我们看到了这一领域突破的曙光,相信在不远的未来,会有越来越多有效的药物走入临床或临床试验,为患者们带来新的选择。
2021年3月5日
药物:Yescarta(Axicabtagene Ciloleucel,Axi-Cel,一款CAR-T细胞疗法)
适应症:复发或难治性滤泡性淋巴瘤
患者:成年患者,经过两次或以上全身治疗
状态:FDA加速批准[13]
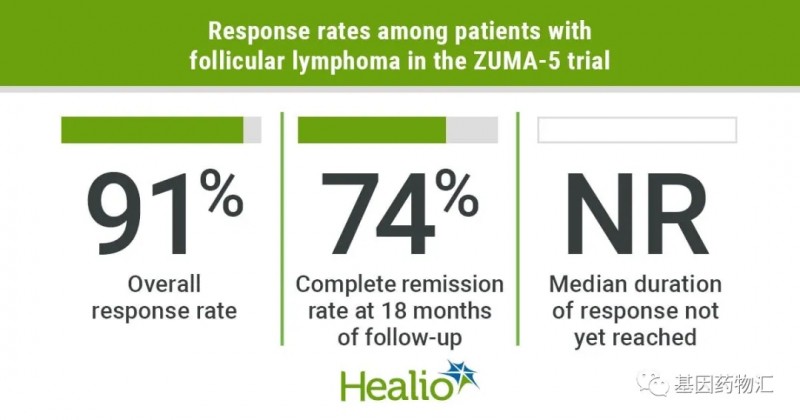
Yescarta是一款CAR-CD19 T细胞疗法,曾经在滤泡性淋巴瘤适应症上获得FDA授予的突破性疗法指定和优先审查资格。此前,FDA曾经批准过Yescarta的大B细胞淋巴瘤适应症。此次获批后,Yescarta成为了滤泡性淋巴瘤的首款CAR-T细胞免疫疗法。
该批准基于Ⅱ期的ZUMA-5试验结果,研究共纳入146例患者,其中81例患者为可评估的复发或难治性滤泡性淋巴瘤患者。
在这部分患者中,Yescarta治疗的整体缓解率达到了91%,完全缓解率高达60%;中位随访14.5个月时尚未达到中位缓解持续时间,74%的患者缓解持续时间超过18个月。
2021年3月10日
药物:Tivozanib(Fotivda)
适应症:复发或难治性晚期肾细胞癌
患者:成年患者,曾经接受过2种或以上全身治疗方案
状态:FDA批准[14]
该批准基于Ⅲ期TIVO-3试验的结果,接受Tivozanib治疗的患者中位无进展生存期为5.6个月,显著超过了索拉非尼治疗的3.9个月;在缓解率方面,Tivozanib治疗的部分缓解率为18%、整体缓解率为34%,同样超过了索拉非尼治疗的8%和24%。
在总生存期方面,两种药物治疗方案的中位总生存期差异不具有统计学意义。Tivozanib治疗的中位总生存期为16.4个月,索拉非尼治疗的中位总生存期为19.2个月。
Tivozanib是一款VEGF抑制剂,属于靶向治疗药物中的抗血管生成类药物,此次获批的肾细胞癌是其首个正式获得FDA批准的适应症。与现有的索拉非尼方案相比,Tivozanib治疗患者的无进展生存期取得了显著的延长,但总生存期差别不大、稍有缩短。
参考既往的研究数据,各类抗血管生成药物通常很难取得具有突破性的疗效,但在与其它药物,如免疫治疗药物及其它靶向药物的联合应用时,却能够发挥更好的效果。因此,我们更希望看到未来Tivozanib与其它药物联合应用的临床试验数据,也许能够成为肾细胞癌治疗的全新突破点。
2021年3月22日
药物:派姆单抗(Pembrolizumab,Keytruda)
适应症:一线治疗局部晚期不可切除或转移性的食管及胃食管连接处癌
状态:FDA批准[15]
此项批准基于KEYNOTE-590试验(NCT03189719)的结果。根据2020年ESMO虚拟大会上公开的数据,派姆单抗+化疗的疗效显著超过了安慰剂+化疗。
接受派姆单抗+化疗治疗的患者,中位总生存期12.4个月,而接受安慰剂+化疗治疗的患者仅为9.8个月。接受派姆单抗+化疗治疗的患者,12个月生存率51%,24个月生存率28%;接受安慰剂+化疗治疗的患者,12个月生存率39%,24个月生存率16%。
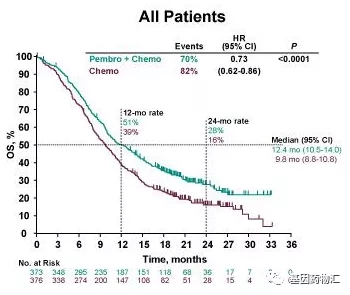
所有患者中位总生存期对比
在无进展生存方面,接受派姆单抗+化疗的患者,中位无进展生存期6.3个月,12个月和18个月无进展生存率分别为25%和16%;接受安慰剂+化疗治疗的患者,中位无进展生存期5.8个月,12个月和18个月无进展生存率分别为12%和6%。
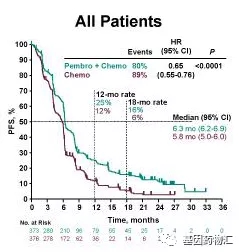
所有患者中位无进展生存期对比
同时,亚组分析结果也显示,PD-L1表达水平更高的患者,从联合方案中获益更加显著。在PD-L1 CPS≥10的患者中,派姆单抗+化疗的中位总生存期为13.5个月,中位无进展生存期7.5个月;安慰剂+化疗仅为9.4个月和5.5个月。
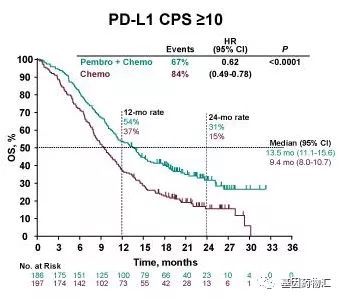
PD-L1 CPS≥10患者中位总生存期对比
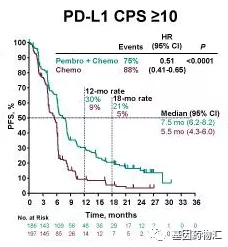
PD-L1 CPS≥10患者中位无进展生存期对比
2019年7月时,FDA曾批准将派姆单抗的用药方案作为复发性局部晚期或转移性食管鳞状细胞癌的二线治疗方案,患者PD-L1表达水平(CPS)≥10。此次的补充新适应症将派姆单抗的应用提升至一线,相比常规化疗具有非常显著的优势,为食管癌患者带来了全新选择。
2021年3月26日
药物:Idecabtagene Vicleucel(Abecma,一种CAR-T细胞疗法)
适应症:复发或难治性多发性骨髓瘤
患者:成年患者,曾接受过4线或更多方案治疗,包括免疫调节剂、蛋白酶体抑制剂和CD38单靠如龙抗体
状态:FDA批准[16]
该批准基于一项多中心的研究结果,共纳入127例患者。所有患者整体缓解率72%,其中完全缓解率28%;在达到了临床完全缓解的患者中,65%的患者缓解持续了超过12个月。
Abecma是一种基于患者自身T细胞进行定制的嵌合抗原受体(CAR)T细胞疗法,此前曾经获得FDA授予的突破性指定及孤儿药称号。其在后线甚至末线患者中的表现,为复发及难治的多发性骨髓瘤患者带来了全新的希望。
2021年3月31日
药物:Isatuximab-irfc(Sarclisa)
适应症:复发或难治性多发性骨髓瘤
患者:成年患者,已经接受过1~3线治疗
状态:FDA批准[17]
该批准基于IKEMA试验(NCT03275285)的结果。Ⅲ期IKEMA试验的结果显示,接受Sarclisa联合卡非佐米和地塞米松三联疗法的患者整体缓解率为86.6%,与卡非佐米和地塞米松二联疗法的82.9%相近;三联疗法的完全缓解率为39.7%,稍高于二联疗法的27.6%;总生存期和无进展生存期的数据尚不成熟。
我们查阅了前期公开的研究数据,接受二联疗法治疗的患者中位无进展生存期为19.15个月,而接受三联疗法治疗的患者,至24个月时仍有超过70%的患者保持无进展生存。
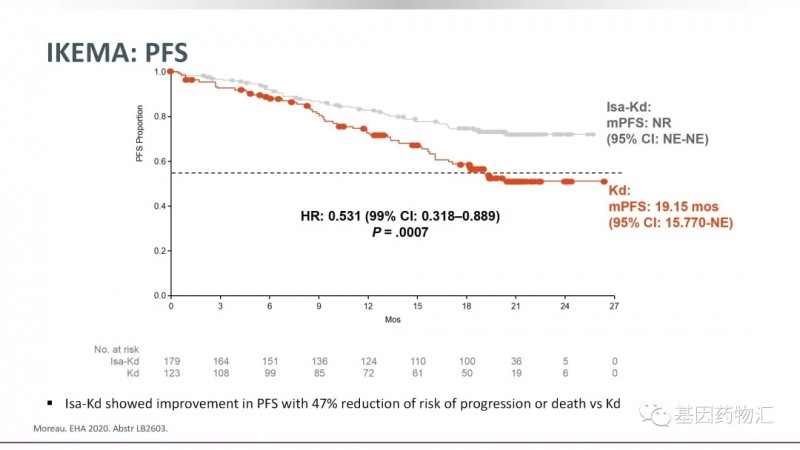
此前于2020年3月,Sarclisa曾经获得FDA批准用于治疗至少接受过2种治疗方案(包括来那度胺和一种蛋白酶抑制剂)的复发或难治性多发性骨髓瘤成年患者。
小汇有话说
纵观这一季度的FDA批准信息,我们可以发现几个特点。
首先,多款去年下半年内获得优先审批资格的药物正式获得了批准,这位我们带来了许多重磅的新药,有效填补了现有药物的治疗空白。
通常情况下,标准的审批周期为10个月,而获得了优先审批资格的项目,周期仅为6个月,甚至可能更短,提前得到批准。能够获得FDA授予的优先审批资格的药物或疗法,通常在疗效、安全性方面取得显著的突破,或能够在一个新的患者亚群中展现出良好的安全性与有效性,为现有方案做出补充。
其次,几款实力强劲的后线治疗药物冲击一线成功,对现有方案做出了效果卓越的补充。例如劳拉替尼冲击ALK非小细胞肺癌一线成功,脑转移患者的疗效终于迎来了质的飞跃。
第三,克唑替尼、Enhertu及纳武单抗、派姆单抗等经典药物,以及西米普利单抗等新生代药物再次拓展新适应症。对于患者们来说,这意味着不必再冒着风险尝试跨适应症用药,可以尝试接受一些已经上市的药物的新适应症临床试验。
除此以外,这一季度内获批的CAR-T细胞疗法比较多,主要用于各类血液系统肿瘤,包括淋巴瘤及多发性骨髓瘤等。尤其是作为末线方案时,各类CAR-T细胞疗法仍有令人赞叹的超高缓解率与完全缓解率,可以说是为这部分患者带来了全新的“保底”希望。
临床试验:沟通患者与新药的桥梁
看过这些报道,相信患者们已经迫不及待地希望能够用上新药、新方案。但等待这些新药获批进入国内市场是一个非常漫长的过程,需要数月甚至数年的时间。
参与新药临床试验是一个提前接受新药治疗的可行方案。基因药物汇为大家总结了正在招募各癌种患者的国内中心临床试验项目,为各位癌症患者提供申请临床试验的渠道。正在招募患者的项目很多,大家先行可以咨询全球肿瘤医生网医学部(400-666-7998),在专业医学顾问的指导下进行选择和申请。
参考文献
[1]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-crizotinib-children-and-young-adults-relapsed-or-refractory-systemic-anaplastic-large
[2]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-fam-trastuzumab-deruxtecan-nxki-her2-positive-gastric-adenocarcinomas
[3]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-darzalex-faspro-newly-diagnosed-light-chain-amyloidosis
[4]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-nivolumab-plus-cabozantinib-advanced-renal-cell-carcinoma
[5]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-tepotinib-metastatic-non-small-cell-lung-cancer
[6]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-umbralisib-marginal-zone-lymphoma-and-follicular-lymphoma
[7]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-lisocabtagene-maraleucel-relapsed-or-refractory-large-b-cell-lymphoma
[8]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-cemiplimab-rwlc-locally-advanced-and-metastatic-basal-cell-carcinoma
[9]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-cemiplimab-rwlc-locally-advanced-and-metastatic-basal-cell-carcinoma
[10]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-cemiplimab-rwlc-non-small-cell-lung-cancer-high-pd-l1-expression
[11]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-melphalan-flufenamide-relapsed-or-refractory-multiple-myeloma
[12]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-lorlatinib-metastatic-alk-positive-nsclc
[13]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-grants-accelerated-approval-axicabtagene-ciloleucel-relapsed-or-refractory-follicular-lymphoma
[14]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-tivozanib-relapsed-or-refractory-advanced-renal-cell-carcinoma
[15]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-pembrolizumab-esophageal-or-gej-carcinoma
[16]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-idecabtagene-vicleucel-multiple-myeloma
[17]https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-isatuximab-irfc-multiple-myeloma
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




