总生存提升近3倍!港大"免疫新武器"全球首发,γδ-T细胞开启黑色素瘤、肝癌、肺癌、胃癌等精准治疗2.0时代
港大"免疫新武器"全球首发,γδT细胞开启黑色素瘤、肝癌、肺癌、胃癌等精准治疗2.0时代,总生存提升近3倍
据香港大学官网2025年4月10日报道,香港大学李嘉诚医学院(港大医学院)研究人员在癌症治疗领域取得突破性进展,成功研发出一种名为光敏混合γδ-T细胞外泌体(混合γδ-T-Exos)的新型疗法。该疗法可精准靶向清除癌细胞,同时诱导损伤相关分子模式(DAMP)释放,并激活后续抗原特异性免疫反应,形成多层次抗肿瘤效应。
值得关注的是,该研究成果同时引发医学界对γδ-T细胞的高度关注——这类细胞作为人体抵御外来“异物”的第一道免疫防线,为开发新型抗肿瘤免疫疗法开辟了崭新方向。此刻,我们正见证着癌症治疗从“伤敌一千自损八百”的旧时代,迈向“精准治疗”的全新时代!
▲截图源自“HKU Med”
港大团队实现γδ-T细胞疗法从实验室到临床的跨越:全球首次外泌体联合光动力精准狙击黑色素瘤,并为肝癌及肺癌患者点燃"长生存希望"
港大突破性γδ-T外泌体联合光动力疗法,开辟黑色素瘤"精准歼敌+器官零损伤"治疗新征程
港大医学院临床医学院涂文伟教授指出,这是γδ-T细胞外泌体疗法与光动力治疗(PDT)的首次创新性结合。作为精准高效的免疫激活型黑色素瘤治疗策略,混合γδ-T-Exos展现出巨大的临床应用潜力。
临床前研究证实,这种创新混合疗法在黑色素瘤模型中表现出显著疗效,不仅能有效抑制肿瘤生长,且对正常器官和组织无毒性作用,充分验证了其优异的生物安全性,为癌症治疗提供了高效低毒的全新路径。相关研究成果已发表于国际权威科学期刊《ACSNano》,为肿瘤治疗领域注入了新的活力。

▲截图源自“J Extracell Vesicles”
从作用机制看,γδ-T细胞外泌体可通过诱导细胞凋亡、增强抗肿瘤T细胞反应抑制肿瘤进展,兼具肿瘤疫苗与药物载体特性,具备靶向肿瘤、增强免疫应答及可规模化生产等优势,在癌症治疗中前景显著。光动力疗法(PDT)则是利用光激活光敏剂(如Chlorinee6,Ce6)产生活性氧(ROS)攻击癌细胞的微创疗法,对黑色素瘤具有明确疗效。研究团队通过将γδ-T外泌体与载有Ce6的脂质体结合,成功开发出光敏混合γδ-T-Exos,该制剂完整保留了肿瘤靶向标记物和细胞溶解分子,能够精准识别黑色素瘤细胞。

▲图源“HKU Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
132例实体瘤患者见证γδ-T细胞疗法的"逆袭之力":肝癌生存期从8.1月跃升至23.1月,肺癌中位生存延长10个月
除了开篇提到的这项最新研究外,早在2021年,港大医学院团队便与暨南大学合作,在全球率先完成同种异体γδ-T细胞治疗晚期肝癌、肺癌等实体瘤的临床研究,相关数据同步发表于《细胞与分子免疫学》杂志上。
该研究采用来自健康供体的NF扩增同种异体Vγ9Vδ2T细胞,对132名晚期癌症患者(包括肺癌、肝癌、胰腺癌、乳腺癌等实体瘤患者)开展治疗。
结果显示:7例(7/8)肝癌患者、9例(9/10)肺癌患者生存期≥10个月。截至2020年6月最新随访,3例肝癌患者和2例肺癌患者在接受过继性γδ-T细胞治疗后,生存期已达30-35个月(详见下图b)。
具体来看,对于肝癌组,未治疗患者的中位生存时间(OS)仅为8.1个月;而接受γδT细胞治疗的患者的中位生存时间(OS)却长达23.1个月(P=0.0002),中位OS提升近3倍。对于肺癌组,接受γδT细胞治疗患者的中位生存时间(OS)长达19.1个月,远超未治疗患者的9.1个月。两组数据均凸显了γδ-T细胞治疗在延长实体瘤患者生存期方面的显著优势。
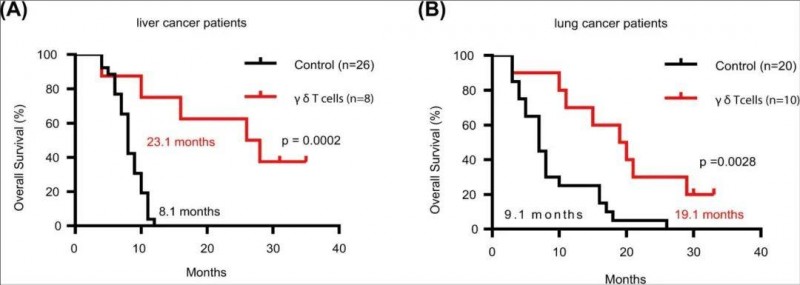
▲图源“Cell Mol Immunol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
人体免疫"先头部队"γδT细胞:双重抗癌机制与多癌种预后的关系
γδT细胞是T淋巴细胞中一个独特的亚群,同时也是人体先天免疫系统的核心组成部分,因其能够快速识别感染和突变细胞,被视为人体抵御“异己”的第一道防线。该细胞亚群无需依赖MHC-I类分子即可识别并杀伤肿瘤细胞,其抗肿瘤机制涵盖多重路径:
1、直接杀伤作用:通过分泌IFN-γ、TNF-α、穿孔素、颗粒酶B等细胞因子,或通过死亡受体-配体途径、抗体介导的细胞毒作用(ADCC)及直接接触等方式诱导肿瘤细胞凋亡。
2、免疫网络调控:作为连接先天免疫与适应性免疫的桥梁,激活抗肿瘤免疫级联反应,影响多种肿瘤微环境中的免疫应答,是肿瘤免疫治疗的理想候选细胞。

▲图源“Front Immunol”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,大量研究证实,γδT细胞广泛参与多种恶性肿瘤的免疫监视,其肿瘤浸润程度与患者预后显著相关:在肝细胞癌、结直肠癌(CRC)、肺癌、乳腺癌、前列腺癌、卵巢癌等实体瘤,以及淋巴瘤、骨髓瘤等血液系统肿瘤中,高浸润水平的γδT细胞均被视为预后良好的标志。
《欧洲医学研究杂志》一项针对结直肠癌(CRC)的研究进一步证实,肿瘤组织中γδT细胞浸润水平与患者生存率呈显著正相关,为其临床应用提供了关键证据支持。该研究采用Kaplan-Meier法计算低、高γδT细胞浸润患者的累积生存率,并通过log-rank检验评估两组生存率的差异。结果显示:γδT细胞在肿瘤组织中的浸润程度越低,CRC患者的预后越差,而γδT细胞在肿瘤组织中的浸润程度越高,患者的预后越好(log-rank P=0.016)(详见下图)。

▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
Vγ9Vδ2T细胞联合唑来膦酸,助胃癌患者恶性腹水消退
胃癌腹膜播散所致的恶性腹水通常对化疗耐药且预后不良,而Vγ9Vδ2T细胞(属γδ-T细胞的一种)的出现,为这类患者带来了一线转机。
近期一项“腹膜内输注体外扩增的Vγ9Vδ2T细胞联合唑来膦酸,治疗胃癌腹膜播散所致的恶性腹水”的临床研究,共纳入7例中位年龄58岁(范围39-69岁)的患者,均曾接受过手术和化疗。入组后,采用唑来膦酸联合白细胞介素-2(IL-2)刺激患者外周血单核细胞,经14天体外培养后收获Vγ9Vδ2T细胞,分四周进行腹膜内输注。治疗前一日,患者接受唑来膦酸预处理,以增强肿瘤细胞对Vγ9Vδ2T细胞的识别敏感性。
结果显示:2例可评估疗效的患者均呈现显著治疗反应,临床症状均显著缓解。
其中患者2325:治疗前血性腹水在治疗后转为清亮(详见下图C),计算机断层扫描(CT)显示,腹水明显减少(详见下图A)。
▼患者2325在四次Vγ9Vδ2T细胞注射前后的腹水外观

▲图源“WILEY online Library”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
▼患者2325在四次Vγ9Vδ2T细胞注射前后的CT扫描对比

▲图源“WILEY online Library”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
另一例患者2328,治疗后CT显示腹水减少并近乎完全消失(详见下图B),因疗效显著追加两轮输注治疗。
▼患者2328在四次Vγ9Vδ2T细胞注射前后的CT扫描对比
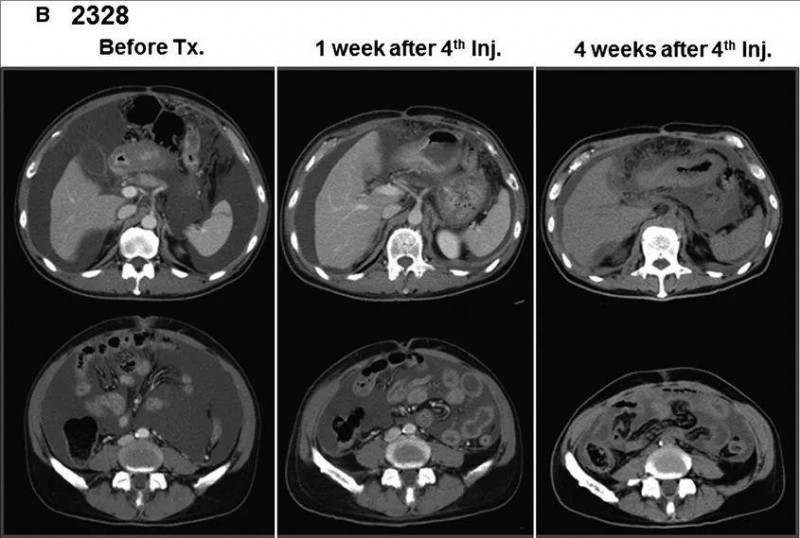
▲图源“WILEY online Library”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,本研究初步证实,过继性Vγ9Vδ2T细胞疗法可在体内有效识别肿瘤细胞并发挥抗肿瘤效应,为胃癌腹膜播散性恶性腹水提供了潜在治疗新策略。
Vγ9Vδ2 T细胞暴击难治性非小细胞肺癌,中位总生存突破418.0天
Vγ9Vδ2 T细胞除了治疗胃癌外,还可用于非小细胞肺癌的治疗。《免疫治疗癌症杂志》发表的一项2期临床研究揭示,采用唑来膦酸扩增的自体Vγ9Vδ2T细胞治疗难治性非小细胞肺癌(NSCLC)具有显著临床获益。
该研究共纳入25例难治性非小细胞肺癌(NSCLC)患者(包括20例腺癌、4例鳞癌、1例大细胞癌),均为接受至少2线标准化疗(无法切除患者)或至少1线放化疗(复发患者)后进展的难治性病例。入组后所有患者均接受自体Vγ9Vδ2 T细胞疗法,其中16例完成6次预定疗程的细胞注射。
结果显示:疾病控制率(DCR)高达68.0%(范围:46.5%–85.1%)。其中1例患者达到部分缓解(PR),16例患者达到病情稳定(SD)。中位无进展生存期(PFS)达到95.0天(95%CI73.0~132.0天)。中位总生存期(OS)更是长达418.0天(范围:179.0–479.0天)。
值得一提的是,其中1位66岁大细胞神经内分泌癌男性患者(TU-2844),伴左上叶原发性肺癌并有脑转移。在经历全脑放疗、CDDP+VP-16全身化疗后,病情进展。二线TS-1化疗因毒性中断后,遂入组接受Vγ9Vδ2 T细胞治疗。
结果显示:该患者在接受Vγ9Vδ2 T细胞治疗后,肺部肿瘤及淋巴结肿大显著缩小(详见下图),虽短暂出现发热、咳嗽,经全身类固醇及抗生素治疗后迅速缓解。
▼该患者在基线、第二次注射Vγ9Vδ2 T细胞后4周的胸部X光和CT扫描对比
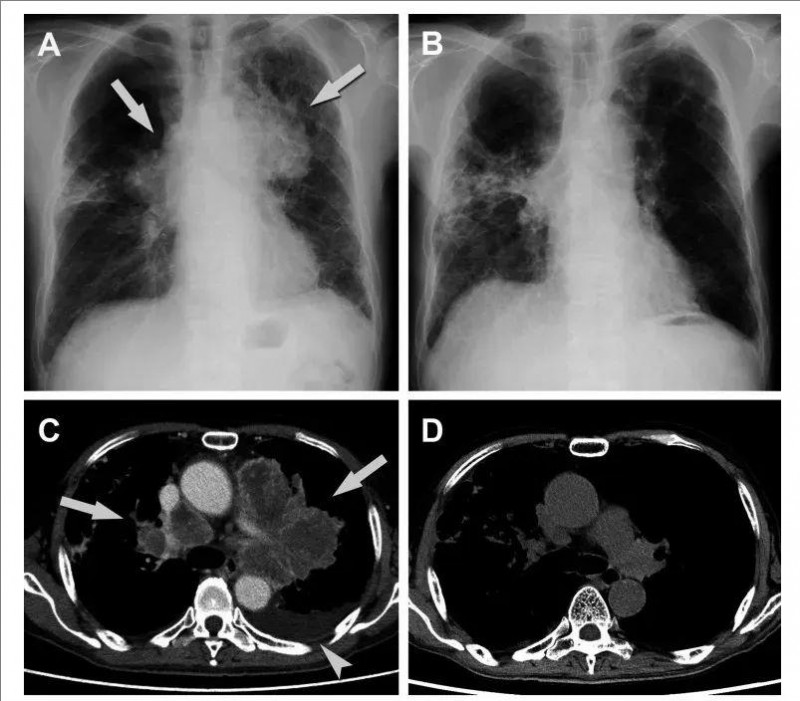
▲图源“J Immunother Cancer”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
γδT细胞因强大的肿瘤杀伤活性、卓越的免疫监视特性、独特的肿瘤识别能力等优点,是治疗血液肿瘤和实体瘤的“新晋明星细胞”。更惊喜的是,γδT细胞不仅能与传统抗癌手段(如分子药物、化疗、手术等)联用;近年研究人员还将其与CAR-T细胞、癌症疫苗等“强强联合”,开辟新型抗癌手段,以悉数增强抗癌治疗,改善癌症患者的肾脏,如文中提到的香港大学正在研发的γδ-T细胞外泌体,就是将γδ-T细胞外泌体与光动力疗法联合,实现双重抗癌、精准打击癌细胞的目的!
如果您对目前的治疗方案不满意,或想寻求γδT细胞、DC细胞、CAR-T细胞等新型抗癌疗法的帮助,可将影像学报告、近期病理检查结果、出院小结、治疗经历等资料,提交至医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Xu Y,et al.Allogeneic Vγ9Vδ2 T-cell immunotherapy exhibits promising clinical safety and prolongs the survival of patients with late-stage lung or liver cancer. Cell Mol Immunol. 2021 Feb;18(2):427-439.
https://pmc.ncbi.nlm.nih.gov/articles/PMC8027668/
[2]Corsale AM,et al.γδ T cells and their clinical application in newline cancer. Front Immunol. 2023 Jan 30;14:1098847.
https://pmc.ncbi.nlm.nih.gov/articles/PMC9923022/
[3]Huang H,et al.Phase I study of adjuvant immunotherapy with autologous tumor-infiltrating lymphocytes in locally advanced cervical cancer[J]. The Journal of Clinical Investigation, 2022, 132(15).
https://eurjmedres.biomedcentral.com/articles/10.1186/s40001-023-01452-5
[4]Wada I,et al.Intraperitoneal injection of in vitro expanded Vγ9Vδ2 T cells together with zoledronate for the treatment of malignant ascites due to gastric cancer[J]. Cancer medicine, 2014, 3(2): 362-375.
onlinelibrary.wiley.com/doi/10.1002/cam4.196
[5]Kakimi K,et al.Adoptive transfer of zoledronate-expanded autologous Vγ9Vδ2 T-cells in patients with treatment-refractory non-small-cell lung cancer: a multicenter, open-label, single-arm, phase 2 study. J Immunother Cancer. 2020 Sep;8(2):e001185.
https://pmc.ncbi.nlm.nih.gov/articles/PMC7511646/
[6]https://www.dimsumdaily.hk/hkumed-researchers-develop-innovative-cancer-therapy-with-photosensitive-hybrid-%CE%B3%CE%B4-t-exos/
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
4.23 全国肿瘤防治宣传周第九弹!同心
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

会议通知|2025年4月26日肝胆胰肿瘤
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【抗BTLA单克隆抗体】新一代靶向药JS
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

8年无进展生存!电场疗法联合化疗为患者带
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
新型LV20.19 CAR-T在此类恶性
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
肠癌患者找到"重生密码&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




