3.5年持久完全缓解!双基因编辑TIL疗法启动临床,横扫肺癌、肠癌、黑色素瘤、前列腺癌等
双基因编辑的TIL疗法临床实验启动,横扫肺癌、肠癌、黑色素瘤、前列腺癌等
2025年4月9日,KSQ Therapeutics官网发布重磅消息:基于CRISPR前沿技术的肿瘤浸润淋巴细胞(TIL)疗法KSQ-004EX,正式开启晚期实体瘤治疗的新纪元!首位由德克萨斯大学MD安德森癌症中心招募的受试者顺利完成给药,标志着这项改写癌症治疗格局的1/2期临床试验已扬帆启航。
作为创新疗法的先锋,KSQ-004EX运用CRISPR/Cas9技术精准靶向,实现SOCS1与Regnase-1双基因失活,犹如为肿瘤浸润淋巴细胞(TIL)安装超强动力引擎。临床前数据亮眼证实:这一突破性双基因编辑策略,正推动抗癌效能呈指数级飞跃!
此次开放标签剂量递增研究聚焦六大癌种——黑色素瘤、非小细胞肺癌、头颈部鳞癌、结直肠癌、胰腺癌与宫颈癌。当希望穿透晚期阴霾,KSQ首席执行官满怀热忱宣告:"TIL疗法的未来充满无限可能!尽管挑战严峻,KSQ-004EX以基因增强之力锻造抗癌利剑,必将开辟实体瘤治疗新路径,为万千患者重燃生命曙光!"此刻,人类抗癌征程的冲锋号已然吹响,让我们共同见证这场改写命运的医学革命!

▲截图源自“KSQ”
过继细胞疗法的"三驾马车":TIL、CAR-T、TCR-T的优势与突围之路,开启癌症免疫治疗新时代
回溯至1986年,一袋乳白色的肿瘤浸润淋巴细胞(TIL)制剂从实验室启程,抵达美国国立卫生研究院临床中心,完成了全球首例转移性癌症患者的人体输注。这一开创性尝试与后续数百次临床实践,共同推动TIL疗法逐渐走向成熟。
如今,TIL疗法已成为实体瘤治疗的标志性突破,以高应答率与长生存期为患者点亮新希望。其核心策略是从肿瘤组织提取免疫细胞,经体外扩增后回输体内,精准识别并清除癌细胞。通过捕捉癌症新抗原激活T细胞免疫反应,借由机体自身的"细胞毒性"实现肿瘤杀伤。
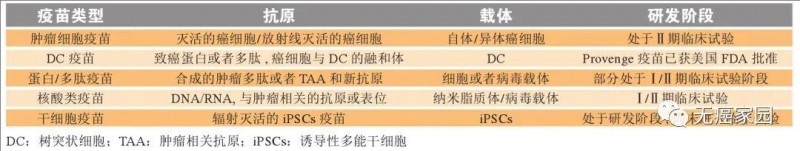
以TIL为代表的过继细胞疗法(涵盖TIL、CAR-T、TCR-T),正引领癌症治疗的前沿探索。这些创新技术利用免疫系统的潜力靶向并杀死肿瘤细胞,但各有优势与局限:
1、CAR-T疗法:在B细胞急性淋巴细胞白血病、非霍奇金淋巴瘤等血液系统恶性肿瘤中战绩卓越,多款产品获监管批准上市,但对实体瘤疗效尚待突破。
2、TCR-T疗法:凭借靶向细胞内抗原的特性,在实体瘤治疗中展现潜力;不过,特异性抗原靶点稀缺及HLA配型需求仍是当前挑战。
3、TIL疗法:直接从自体肿瘤组织提取免疫细胞,天然具备肿瘤识别能力,经扩增后实现个体化精准打击,显著降低移植物抗宿主病(GVHD)风险,尤其在黑色素瘤及多种实体瘤治疗中表现优异(详见下表)。
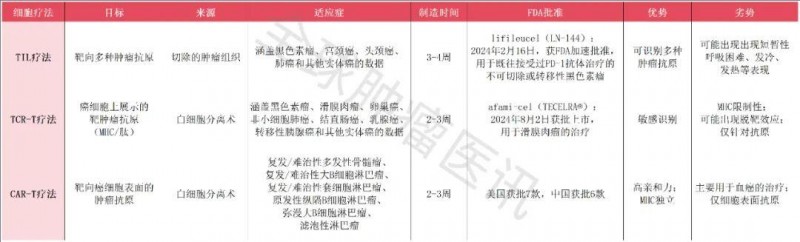
▲数据源自“Cancer Immunol Immunother”,医学部整理汇总
总之,这三种疗法彼此协同,共同构建起癌症免疫治疗的前沿阵地。尽管技术挑战依然存在,但它们为战胜癌症开辟了多元路径,承载着生命的新希望。
TIL细胞助前列腺癌患者达完全缓解,肿瘤清零超3.5年
纽约食管鳞状细胞癌抗原1(NY-ESO-1)是一种高免疫原性的癌睾抗原,可在多数表达该抗原的晚期肿瘤患者中,同时激活细胞与体液免疫,被视为癌症免疫治疗的潜力靶点。
《癌症免疫治疗》杂志报道了一则突破性案例:一位70多岁的男性患者,2004年确诊前列腺癌后,接受根治性切除术及盆腔淋巴结清扫,后续针对骨转移放疗,并持续抗激素治疗。然而遗憾的是,疾病依然进展,癌细胞侵及尿道、软组织及淋巴结,因该患者拒绝标准化疗,遂入组基于同情用药的实验性肿瘤浸润淋巴细胞(TIL)治疗,治疗方案为体外扩增的TIL细胞+白细胞介素-2(IL-2)+免疫检查点阻断疗法联合治疗。
结果显示:三次TIL输注后,前列腺特异抗原(PSA)水平持续下降,第3次输注2个月后,PSA降至0.01µg/L,同时所有肿瘤表现为完全缓解(CR)。治疗期间,患者基线高水平的NY-ESO-1血清抗体滴度持续下降(详见下图)。
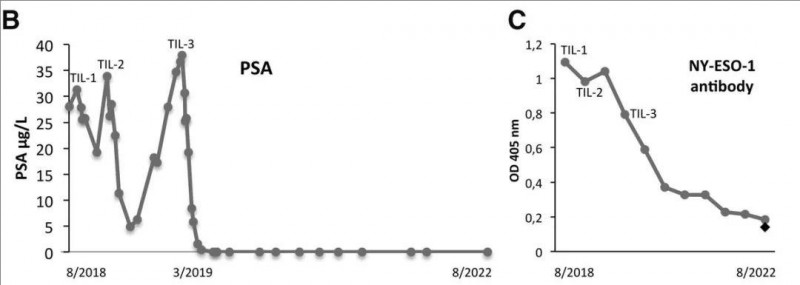
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
MRI影像证实,TIL第三次输注2个月后,肿瘤负荷显著减轻。截至最新评估,患者已维持CR状态超3.5年(详见下图)。
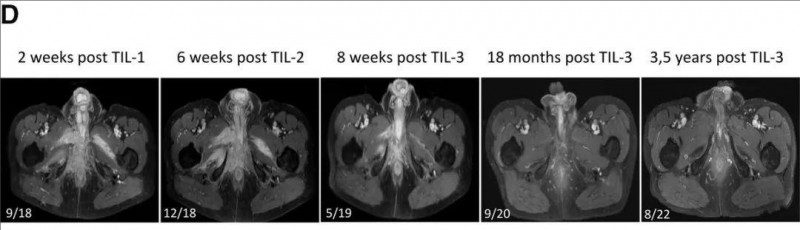
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
· 温馨提示 ·
99%的肿瘤患者都不知道,自己手术切除的肿瘤组织中深藏着杀癌能力最强的一群免疫细胞,肿瘤浸润淋巴细胞(TIL)。
然而,令人遗憾的是,以往许多患者在手术切除肿瘤组织后,通常仅会提取一小部分用于制作病理蜡块以进行病理诊断,而其余大部分肿瘤组织则会被当作医疗垃圾丢弃,这无疑致使患者体内潜藏的抗癌能力极强的肿瘤浸润淋巴细胞(TIL)被白白浪费。
此外,值得关注的是,TILs 细胞数量会随着肿瘤的进展而逐渐减少,并且在术后接受辅助性治疗(如放疗、化疗)时,不仅癌细胞会受到杀伤,体内的免疫细胞也可能受到影响。
因此,建议患者务必珍惜这或许仅有一次的宝贵抗癌机会。在术前应积极与主治医师进行沟通,尽可能地保留新鲜的肿瘤标本组织,并联系专业机构对 TIL 细胞进行分离和冻存,以便在手术后或癌症复发时扩增回输到体内,这将是战胜癌症最宝贵的机会之一。具体的冻存流程大家可致电医学部,了解详情。
TIL疗法精准锁定KRAS突变!晚期结直肠癌患者7处肺转移全消,实现持续缓解
全球知名期刊《新英格兰医学杂志》报道了一则突破性案例:一名转移性结直肠癌女性患者(50岁,编号4095)经肿瘤浸润淋巴细胞(TIL)治疗后,7个肺部转移病灶全部消退,实现持续9个月的部分缓解。
该患者入组2期临床试验(NCT01174121),研究旨在验证体外扩增的TIL(含靶向个体化癌症新表位的T细胞)对转移性实体癌的疗效。研究人员在该患者肿瘤浸润淋巴细胞中,发现针对KRASG12D突变的多克隆CD8+T细胞应答,遂筛选由4种特异性识别该突变的T细胞克隆组成的HLA-C*08:02限制性TIL进行扩增。治疗前,患者接受环磷酰胺+氟达拉滨的非清髓性淋巴细胞清除化疗,随后输注靶向KRASG12D的TIL细胞,并接受白细胞介素-2(IL-2)治疗。
结果显示:在TIL细胞治疗后40天进行的首次随访中,该患者所有7个肺转移灶均已完全消退;依据实体瘤疗效标准,患者维持9个月的部分缓解(PR),直至单个病灶(病灶3)进展。病灶切除后,患者持续4个月保持临床无病状态。
▼该患者在输注TIL细胞前、输注6周、9个月后,胸部的增强计算机断层扫描
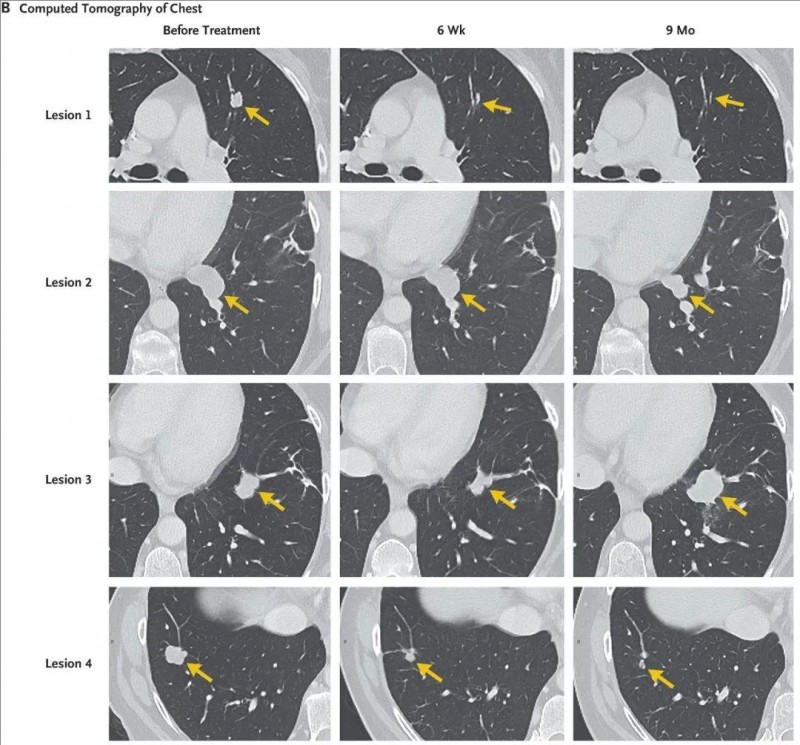
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:其中至少75%的细胞对突变型KRAS G12D具有特异性。箭头突出显示治疗前后的肺部病变。图中显示了七个病变中的四个;其余三个病变(未显示)在9个月时完全消退。
TIL细胞+低剂量IL2依然抗打:晚期黑色素瘤客观缓解率高达42%,CR持续长达32个月
《临床癌症研究》发表了一项“自体肿瘤浸润淋巴细胞(TIL)联合低剂量IL2,治疗进展期难治性转移性黑色素瘤的I/II期临床试验(NCT00937625)”,数据令人振奋!该研究共纳入25例年龄在25~68岁之间的进展期难治性转移性黑色素瘤患者,均伴有至少一处可切除转移灶。入组后,先接受标准淋巴细胞清除化疗,随后输注TIL细胞,并序贯静脉注射递减剂量的IL2,中位随访时间为28.1个月。
结果显示:所有25例入组患者的中位无进展生存期(PFS)3.9个月,中位总生存期(OS)21.8个月;1年、3年生存率分别达72%和40.8%(详见下图)。
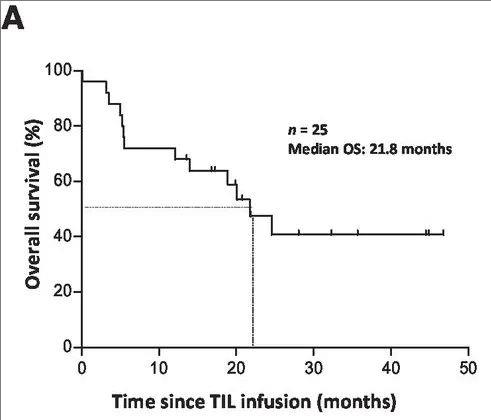
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
按RECIST1.0标准,24例可评估患者中10例(42%)获客观缓解(ORR),包括3例完全缓解(CR)、7例部分缓解(PR);11例病情稳定超4-6个月。CR及4例PR持续6-45个月,多数患者抗肿瘤免疫反应维持达2年。出现典型IL-2相关毒性,但在普通病房即可控制,无需重症监护。
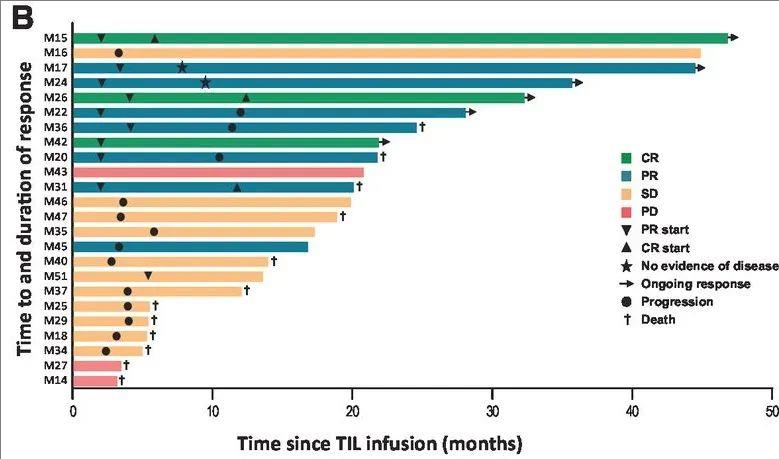
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,患者M26在治疗2个月后即达到部分缓解(PR),因疤痕组织吸收缓慢,FDG-PET/CT仍见残余病灶;13个月后确认完全缓解(CR),完全缓解(CR)持续长达32个月(≈2.6年)(详见下图)。
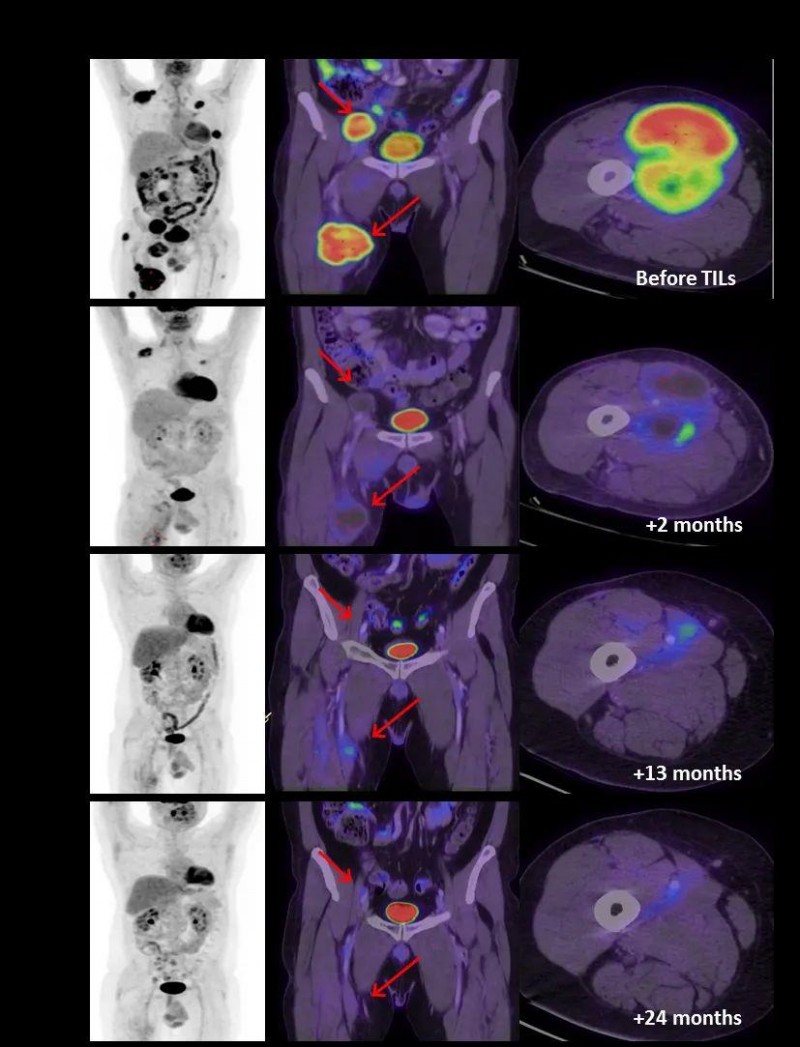
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
全球首款TIL疗法Lifileucel再战肺癌:近半数患者病情稳定,1例完全缓解
Lifileucel 作为全球首款获批上市的自体肿瘤浸润淋巴细胞(TIL)疗法,已被证实可用于治疗经 PD-1 阻断抗体治疗后进展的不可切除或转移性黑色素瘤。最新研究显示,其在转移性非小细胞肺癌(mNSCLC)治疗领域同样具有不俗的疗效。
《Cancer Discovery》杂志公布的 2 期临床数据显示,针对免疫检查点抑制剂(ICI)耐药的晚期 mNSCLC,Lifileucel 疗法疗效惊艳。该研究共纳入 28 例中位年龄 61 岁(40-74 岁)的患者,既往接受过包括抗 PD-1/PD-L1 抗体在内的多线治疗(中位治疗线数 2,范围 1-6)。
结果显示:客观缓解率(ORR)达到21.4%(6/28),79.2%(19例)的患者肿瘤负荷减少(以目标病变的SOD衡量)(详见下图)。部分缓解率(PR)达到17.9%(5/28),42.9%(12/28)的患者达到病情稳定(SD)。其中1例患者(患者3B-02),更是奇迹般获得了完全缓解(CR)。
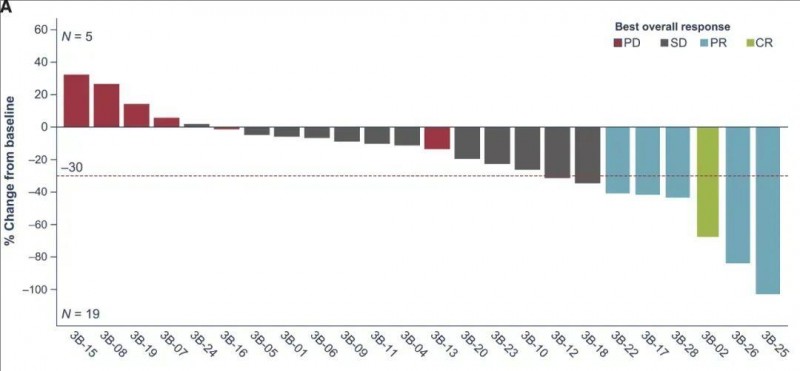
▲图源“Cancer Discov”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,其中一位41岁IV期携带KRAS G12D突变的粘液性肺腺癌男性患者,TMB为3.3mut/Mb,PD-L1表达为0%。接受 Lifileucel 治疗后12 周,根据RECISTv1.1标准,部分缓解(PR)率高达81%(详见下图)。
▼该患者接受TIL治疗前、治疗后6周的CT扫描对比
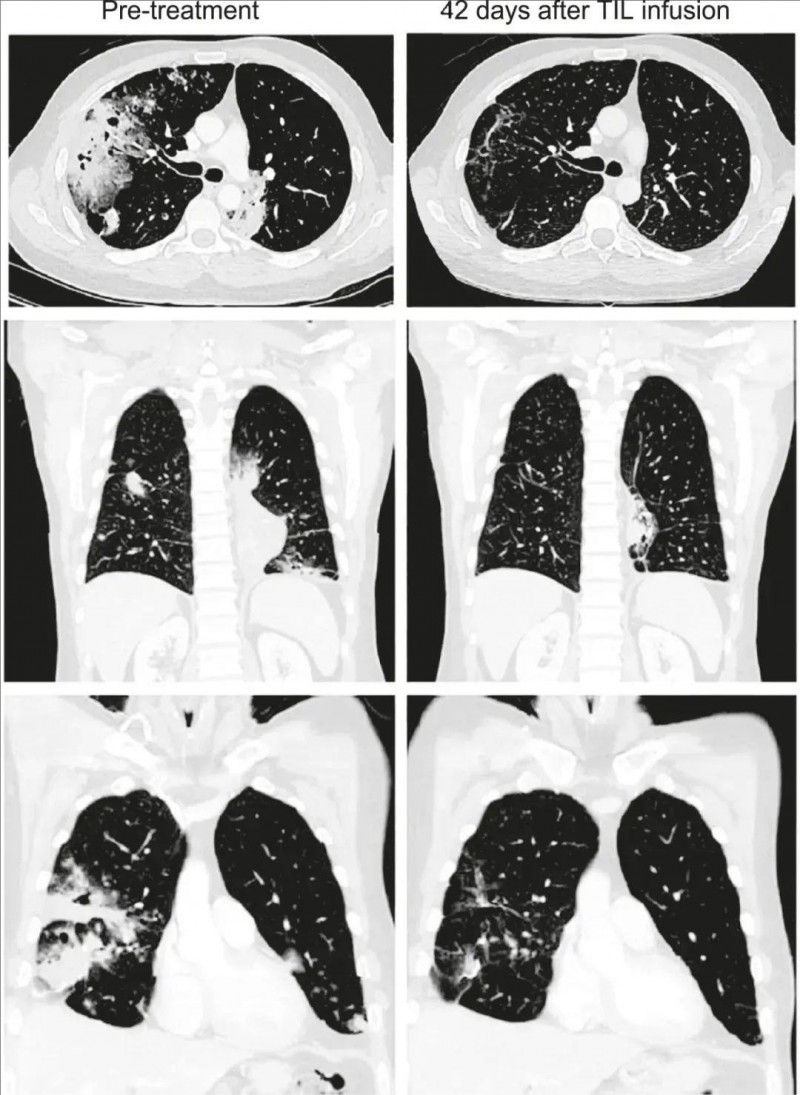
▲图源“Cancer Discov”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
TIL疗法自1988年初次尝试用于临床以来,已有30多年的发展历程,凭借其独特的优势,在黑色素瘤、肺癌、宫颈癌、乳腺癌、头颈部肿瘤等多种实体瘤领域,取得了显著的疗效,是当之无愧的实体瘤“大杀器”!
不过,癌症作为一种高度突变且极度复杂的疾病,很难仅靠单一治疗手段达到预期效果。目前仍以手术、放化疗等传统治疗手段为主。在此基础上,存在TIL细胞制备条件的患者,可在初次手术及放化疗前,及时冻存TIL细胞,用于后续治疗,以预防复发/转移,或在癌症晚期其他措施束手无策时,作为末线补救措施,为患者赢得“一线生机”。想寻求TILs疗法或国内外其他抗癌新技术(如CAR-T、TCR-T、NK细胞疗法等)帮助的患者,可将近期病理报告、治疗经历等资料,提交至医学部,进行初步评估。
参考资料
[1]Matsueda S,et al.Recent clinical researches and technological development in TIL therapy. Cancer Immunol Immunother. 2024 Sep 12;73(11):232.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11393248/
[2]Karbach J,et al.Tumor-infiltrating lymphocytes mediate complete and durable remission in a patient with NY-ESO-1 expressing prostate cancer[J]. Journal for Immunotherapy of Cancer, 2023, 11(1): e005847.
https://jitc.bmj.com/content/11/1/e005847.long
[3]Tran E,et al.T-Cell Transfer Therapy Targeting Mutant KRAS in Cancer. N Engl J Med. 2016 Dec 8;375(23):2255-2262.
https://pmc.ncbi.nlm.nih.gov/articles/PMC5178827/
[4]Andersen R,et al.Long-lasting complete responses in patients with linkstatic melanoma after adoptive cell therapy with tumor-infiltrating lymphocytes and an attenuated IL2 regimen[J]. Clinical cancer research, 2016, 22(15): 3734-3745.
https://aacrjournals.org/clincancerres/article/22/15/3734/79342/Long-Lasting-Complete-Responses-in-Patients-with
[5]https://ksqtx.com/press-releases/ksq-therapeutics-announces-first-patient-dosed-in-phase-1-2-study-for-ksq-004ex-a-crispr-cas9-engineered-tumor-infiltrating-lymphocyte-etil-therapy/
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

早期前列腺癌术后五年生存率超99%,但防
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
67%的肝癌患者生存期超2年!国产实体瘤
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【ADC药物】新一代靶向药SYS6002
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
全球首创双特异性抗体!格菲妥单抗新适应证
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

超2年持久无癌!癌症疫苗重拳出击,胃癌完
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
早期前列腺癌术后五年生存率超99%,术后
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




