73%总缓解率引爆话题!全球首个双特异性第三代CAR-T印度获批!同步深挖中国六大救命CAR-T疗法
全球首个双特异性第三代CART细胞疗法在印度获批,73%总缓解率引爆话题!同步深挖中国六大救命CAR-T疗法
据《印度时报(THETIMES OF INDIA)》2025年3月20日消息,全球首款印度本土双特异性第三代嵌合抗原受体T(CAR-T)细胞——Talicabtagene autoleucel(NexCAR19™)取得令人惊喜的突破性进展,反应率达73%。该研究结果于今年3月13日同步发表于《柳叶刀血液学》杂志。在密切监测的51名患者中,有73%的患者呈现积极反应,体内癌症或有所缩小,或进入缓解期。
据悉,Talicabtagene autoleucell(NexCAR19™)目前已在印度获批,用于治疗复发/难治性B细胞淋巴瘤以及复发/难治性B细胞急性淋巴细胞白血病,虽然其反应率和我国自研CAR-T还存在一定的差距,但其30,000美元(约21万人民币)的价格仍存在一定优势,与之相比,其他国家的类似疗法价格在373,000~475,000美元(270万~340万人民币)之间。
《柳叶刀》:全球首款印度本土双特异性第三代CAR-T(NexCAR19™),亮剑复发或难治性B细胞恶性肿瘤,总缓解率达73%
B细胞在免疫系统中发挥着关键作用,承担着产生抗体的职责。然而,一旦出现不受控制的生长时,就可能引发严重的并发症,比如B细胞肿瘤等。遗憾的是,对于那些缓解后复发,或者对初始治疗没有反应的难治性B细胞肿瘤患者而言,治疗选择往往极为有限。而CAR-T细胞疗法的出现,有望逆转这一困境。CAR-T细胞和正常T细胞一样,能在体内长时间停留,有助于预防肿瘤复发。在实验室中,对患者自身免疫细胞进行重新编程,使其能更精准地瞄准并摧毁癌细胞,这一做法已取得令人欣喜的成果。
《柳叶刀》报道的这项关于“Talicabtagene autoleucell(NexCAR19™)治疗复发或难治性B细胞恶性肿瘤”的1/2期临床研究,在印度的六家三级癌症中心开展,共招募了64例复发或难治性B细胞急性淋巴细胞白血病或B细胞淋巴瘤患者,中位年龄为44岁(IQR27–57),且均尝试过常规治疗。
结果显示:在51名可评估疗效的患者中(包括B细胞淋巴瘤36例、B细胞急性淋巴细胞白血病15例),总缓解率达到73%(37/51;95%CI 59~83)(详见下图)。
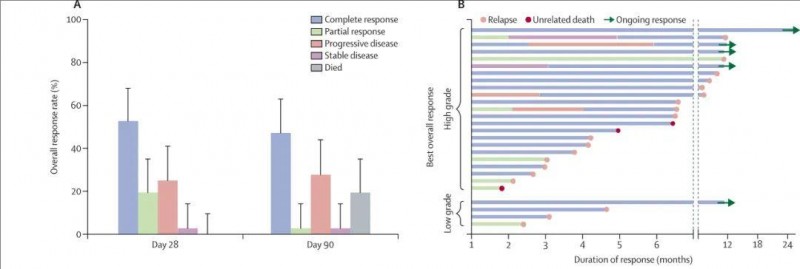
▲图源“The Lancet Haematology”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
史上最全!全面梳理中国已获批的六大救命CAR-T细胞疗法,为癌症患者带来生存新曙光
01、阿基仑赛注射液
简介
①药物名称:阿基仑赛注射液(奕凯达,Axicabtagene ciloleucel,YESCARTA®)。
②研发公司:复星凯特。
③上市时间:2021年6月1日。
药物详情
阿基仑赛注射液作为一款CD19CAR-T产品,于2021年6月22日在中国获批上市,用于治疗成人复发或难治性大B细胞淋巴瘤(r/rLBCL),它是中国首个以药品途径获批上市的CAR-T细胞治疗产品!在复发难治性非霍奇金淋巴瘤的治疗中,阿基仑赛表现出色,12个月总生存(OS)率高达84.3%,最佳完全缓解率(CRR)为58.4%,最佳总缓解率高达83.2%。
02、瑞基奥仑塞注射液

简介
①药物名称:瑞基奥仑赛注射液(倍诺达,relma-cel,JWCAR029)。
②研发公司:药明巨诺。
③上市时间:2021年9月1日。
药物详情
瑞基奥仑赛注射液是一款靶向CD19的自体CAR-T治疗产品,于2021年9月1日在中国获批上市,适用于治疗既往经过二线或以上系统性治疗后复发或难治的大B细胞淋巴瘤。
在2020年美国血液学会(ASH)年会上公布的数据显示,在58例可评估疗效的复发或难治性大B细胞淋巴瘤(r/r LBCL)患者中,治疗3个月时,客观缓解率(ORR)达到58.6%,完全缓解率(CR)达51.7%;治疗6个月时,无进展生存(PFS)率为54.2%,中位总生存(OS)率高达90.8%。
03、伊基奥仑赛注射液
简介
①药物名称:伊基奥仑赛注射液(福可苏®,Equecabtagene Autoleucel Injection)。
②研发公司:驯鹿生物和信达生物。
③上市时间:2023年6月30日。
药物详情
伊基奥仑赛注射液是一款全人源B细胞成熟抗原特异性CAR-T细胞产品。2023年6月30日,国家药品监督管理局(NMPA)批准其上市,用于治疗复发/难治性多发性骨髓瘤(R/R MM)。伊基奥仑赛注射液意义非凡,它不仅是中国首款获批的BCMACAR-T疗法,更是全球首款全人源BCMA靶向的CAR-T疗法。
1/2期临床研究数据显示,该疗法的总体缓解率(ORR)高达96.0%!阅读原文了解详情:驯鹿生物和信达生物在2023 ASCO年会上壁报展示BCMA CAR-T(伊基奥仑赛注射液)的长期随访数据更新
04、纳基奥仑赛注射液
简介
①药物名称:纳基奥仑赛注射液(源瑞达®,CNCT19细胞注射液,Inaticabtagene Autoleucel Injection)。
②研发公司:合源生物。
③上市时间:2023年11月8日。
药物详情
纳基奥仑赛注射液是一款靶向CD19的CAR-T细胞治疗产品,2023年11月8日在中国获批,用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)。它是中国首款治疗白血病的CAR-T细胞产品,临床疗效显著!
治疗3个月时,总体缓解率(ORR)高达82.1%。在治疗3个月内,获得ORR的32例患者中,完全缓解(CR)率达66.7%。治疗时间≤3个月时,达到CR的患者,微小残留病(MRD)阴性率为92.0%;而达到CR/CRi(完全缓解但计数不完全恢复)的患者,MRD阴性率更是高达100%!
05、泽沃基奥仑赛
简介
①药物名称:泽沃基奥仑赛(zevor-cel,Zevorcabtagene Autoleucel,赛恺泽®,产品编号CT053)。
②研发公司:科济药业。
③上市时间:2024年3月1日。
药物详情
泽沃基奥仑赛是一款自体BCMA靶向的CAR-T细胞产品。2024年3月1日,国家药品监督管理局批准了其新药上市申请,用于复发或难治性多发性骨髓瘤的治疗。泽沃基奥仑赛意义重大,它是我国第五款上市的CAR-T细胞产品,通顺也是国内第二款靶向BCMA的CAR-T产品!
LUMMICARSTUDY1临床数据显示,泽沃基奥仑赛疗效十分显著:在所有患者中,总缓解率(ORR)竟达到惊人的100%(14/14),其中78.6%的患者达到了完全缓解(CR)或严格完全缓解(sCR)。并且,全部患者的中位无进展生存期(PFS)长达25.0个月。
06、西达基奥仑赛
简介
①药物名称:西达基奥仑赛(Carvykti,cilta-cel)。
②研发公司:传奇生物、强生创新制药。
③上市时间:2024年8月27日(中国)、2024年4月5日(美国)。
药物详情
西达基奥仑赛是一种靶向BCMA的CAR-T细胞疗法。2024年4月5日,获美国FDA批准,用于治疗成人复发或难治性多发性骨髓瘤(R/RMM);同年8月27日,中国国家药品监督管理局(NMPA)也批准了西达基奥仑赛,用于既往接受过1种免疫调节剂和1种蛋白酶抑制剂治疗的复发或难治性多发性骨髓瘤的治疗。西达基奥仑赛具有里程碑式的重要意义,它不仅是首款获得FDA批准的国产CAR-T疗法,也是我国获批的第6款CAR-T产品,更是全球目前唯一获批用于多发性骨髓瘤二线治疗的BCMA靶向疗法!
根据CARTIFAN-1临床研究,西达基奥仑赛效果显著:客观缓解率(ORR)高达89.6%(95%CI,77.3~96.5),77.1%的患者在治疗后达到完全缓解(CR)或更好状态。在生存数据方面,18个月的无进展生存(PFS)率为66.8%(95%CI,49.4~79.4),18个月的中位总生存(OS)率为78.7%(95%CI,64.0~88.0)。
中国患者如何寻求CAR-T疗法帮助
目前我国正有多款CAR-T临床试验正在招募中,主要针对B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、非霍奇金淋巴瘤、急性淋巴细胞白血病、胰腺癌、胃癌、肝癌、结直肠癌、间皮瘤、卵巢癌等癌种!想参加的病友,可按如下流程进行申请:
1、按要求将病历资料、近期病理检查报告等资料,提交至医学部;
2、医学部进行初步评估后,会为患者匹配合适的临床试验;
3、向相应的试验中心,提交患者病历资料;
4、评估通过后,协助患者参加临床试验。
中国多款在研CAR-T蓄势待发,剑指血液肿瘤、肝癌、胃癌、胰腺癌等
除了上面提到的已在我国获批上市的六款CAR-T疗法外,还有诸多在研的新型CAR-T疗法,正在蓄势待发,以驯鹿医疗、复星凯特、科济生物、传奇生物等一众领军企业,积极投身CAR-T的研发浪潮,且已取得令人瞩目的成果。下面小编针对其中的几款佼佼者,展开详细介绍,以坚定癌友们的抗癌信心。对此感兴趣的病友可将近期影像学检查、病理检查、治疗经历等资料,提交至医学部,进行初步评估或了解详细的入列标准。
CD19/20 CAR-T疗法:非霍奇金淋巴瘤完全缓解率高达70%
近期,全球知名期刊《Nature》子刊《Blood Cancer Journal》报道了我国深圳大学总医院开展的一项临床研究(NCT04723914),该研究旨在探究“应用双特异性CD19/20CAR-T细胞,治疗复发/难治性非霍奇金淋巴瘤(NHL)”。
研究结果显示:在9例有反应的患者中,7例达到最佳反应,完全缓解(CR)率高达70%,另外2例患者达到部分缓解(PR)。中位缓解持续时间为11.83个月(范围:4.70-18.50个月)。12个月的总生存(OS)率高达81.82%(95%CI 52.30%~96.77%),12个月的无进展生存(PFS)率达60%(95%CI 31.27%~83.18%)。
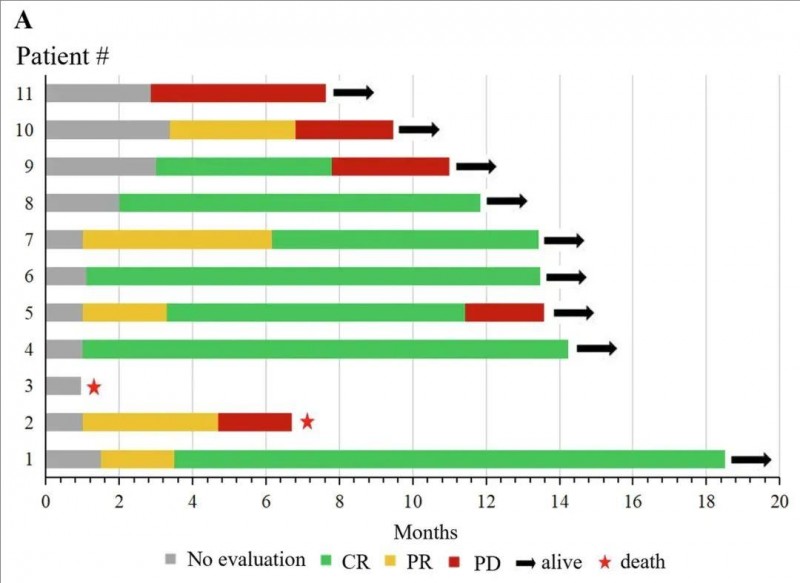
▲图源“Blood Cancer Journal”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
下图展示了3名代表性患者在CAR-T治疗前以及输注后,达到最佳缓解时的PET-CT图像。
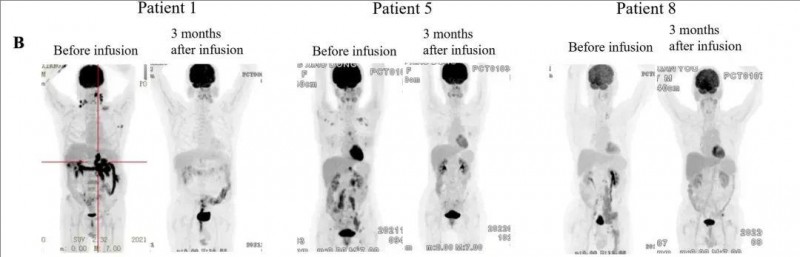
▲图源“Blood Cancer Journal”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
中国首创satri-cel(CLDN18.2 CAR-T疗法),胃肠道肿瘤疾病控制率超70%
satri-cel(satricabtagene autoleucel,编号CT041)是一款针对蛋白质Claudin18.2的自体CAR-T细胞候选产品,旨在治疗Claudin18.2突变的胰腺癌(PC)、胃/胃食管交界处癌(GC/GEJ)等实体瘤。
2024年的ASCO大会上,公布了其治疗胃肠道肿瘤1期临床试验的最终结果。本次研究共入组98例CLDN18.2阳性晚期胃肠道肿瘤患者,包括73例胃癌、10例胰腺癌、8例肠癌、4例胆道癌、3例其他肿瘤。
结果显示:全部入组患者(N=98)的客观缓解率(ORR)达到37.8%,疾病控制率(DCR)高达75.5%,中位无进展生存期(PFS)为4.4个月(95% CI:4.0, 6.0),中位总生存期(OS)为8.4个月(95% CI:7.0, 10.0)。

▲图源“ASCO ” ,版权归作者所有,如无意中侵犯了知识产权,请联系我们删除
C-CAR031 CAR-T细胞,肝细胞癌疾病控制率高达90.9%
C-CAR031 CAR-T是一款针对肝癌细胞的“黄金”靶标——GPC3的新型CAR-T细胞疗法,2024年美国临床肿瘤学会(ASCO)大会上,公布了其治疗肝细胞癌的1期临床数据(NCT05155189)。
本次研究共入组24例晚期肝细胞癌(HCC)患者,几乎所有患者(95.8%,23名)都接受了免疫检查点抑制剂(ICI)、酪氨酸激酶抑制剂(TKI)治疗。入组后,接受了4个剂量水平(DL)的C-CAR031输注。
结果显示:全部入组患者的疾病控制率(DCR)高达90.9%,客观缓解率(ORR)达50.0%(详见下图)。在22例可评估疗效的患者中,90.9%的患者出现肿瘤缩小,不仅肝内病变,肝外病变也有所缩小,中位缩小率高达44.0%(范围:3.4%-94.4%)。中位无进展生存期(PFS)为4.27个月(95%CI,2.86-8.90)。
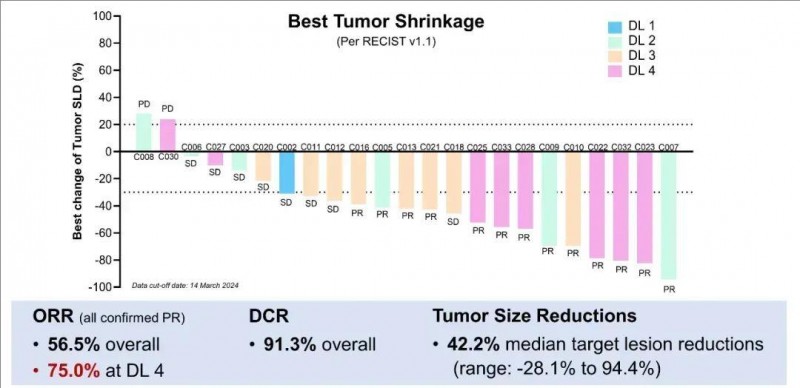
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
时至今日,CAR-T 细胞疗法在血液系统恶性肿瘤的治疗领域已取得突破性进展,众多患者从中受益。然而,在实体瘤治疗方面,其效果仍存在一定局限性。这主要是因为实体瘤内部 T 细胞浸润程度较低,同时免疫抑制性的肿瘤微环境也在从中作梗,阻碍了 CAR-T 细胞疗法充分发挥作用。令人欣慰的是,近年来全球的研究人员从未停止探索的脚步,持续钻研各种新型策略,致力于降低肿瘤抗原异质性,打破免疫抑制的困境,为实体瘤患者带来更多希望!
想寻求CAR-T细胞或国内外其他前沿抗癌技术(如TIL、TCR-T、NK细胞、益生菌等)的患者,可将出院小结、详尽的病理报告、治疗经历等资料,提交至全球肿瘤医生网医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Jain H,et al.Talicabtagene autoleucel for relapsed or refractory B-cell malignancies: results from an open-label, multicentre, phase 1/2 study[J]. The Lancet Haematology, 2025.
https://www.thelancet.com/journals/lanhae/article/PIIS2352-3026(24)00377-6/abstract
[2]QI C,et al.Claudin18. 2-targeted chimeric antigen receptor T cell-therapy for patients with gastrointestinal cancers: Final results of CT041-CG4006 phase 1 trial[J]. 2024.
https://meetings.asco.org/abstracts-presentations/232455
[4]Ouladan S,et al.Chimeric Antigen Receptor-T Cells in Colorectal Cancer: Pioneering New Avenues in Solid Tumor Immunotherapy[J]. Journal of Clinical Oncology, 2025: JCO-24-02081.
https://ascopubs.org/doi/10.1200/JCO-24-02081
[3]Wang L,et al.Bispecific CAR-T cells targeting CD19/20 in patients with relapsed or refractory B cell non-Hodgkin lymphoma: a phase I/II trial[J]. Blood cancer journal, 2024, 14(1): 130.
https://www.nature.com/articles/s41408-024-01105-8?fromPaywallRec=false
[4]https://timesofindia.indiatimes.com/city/pune/indias-first-homegrown-car-t-cell-therapy-shows-73-success-rate-against-cancer/articleshow/119224745.cms
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

国研四代靶向药横空出世!EGFR肺癌患者
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【EGFR药物】新一代靶向药WSD092
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

早期肾癌术后五年生存率超95%?这么做预
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
近1/3患者长生存突破4.5年!AGS-
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

早期肾癌术后五年生存率超95%,五大防复
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

早期肾癌术后生存率超95%!预防复发的关
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




