美国TIL开出370万天价?中国自研TIL来了,剑指肺癌、宫颈癌、卵巢癌等,疾病控制率超83%
美国TIL疗法开出370万天价?中国自研的TIL细胞疗法来了,剑指肺癌、宫颈癌、卵巢癌等,疾病控制率超83%
经过35年的不懈探索,号称“一针清除癌细胞”的肿瘤免疫治疗领域的王牌军团TIL疗法,终于在2024年2月16日,获美国FDA批准。这款刚刚获批的“Lifileucel(Amtagvi)”的TIL细胞产品,也在同年4月,完成了世界上第一位患者的顺利回输。至此开启了肿瘤免疫治疗,尤其是实体瘤治疗的新时代,在细胞和基因治疗领域具有里程碑式的重要意义!然而,对于大多癌症患者来说,接受这种治疗的机会仍然很有限,51.5万美金(约370万人民币)的“天价”,让很多患者望而却步。
值得欣慰的是,近年来,特别是在《2024产业结构调整指导目录》实施后,中国在TIL治疗发展方面取得了令人瞩目的进步,多款国产TIL产品纷纷涌现,并表现出了出色的临床疗效。根据中国国家药品监督管理局药品审评中心(NMPA)官网公示,近期多款我国自研的TIL疗法的新药上市申请(IND),获得中国NMPA的临床试验默示许可。这也意味着中国癌症患者,终于也有机会接受这款全球领先的免疫疗法了!
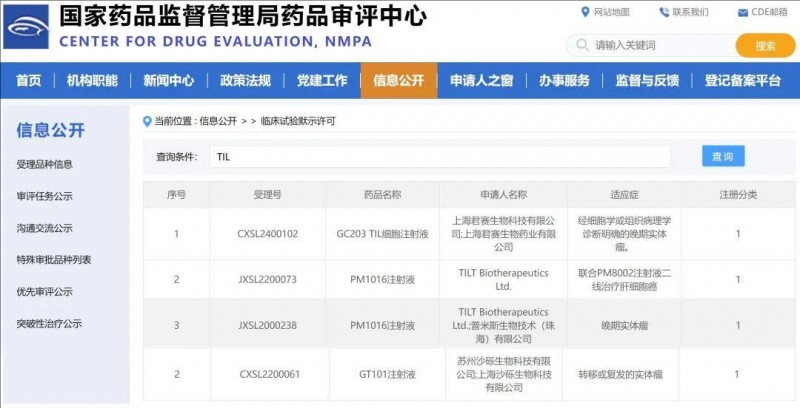
▲截图源自“NMPA”
TIL细胞:蛰伏在癌细胞周围的最强抗癌战队
“TIL疗法”即“肿瘤浸润淋巴细胞疗法”(tumor-infiltrating lymphocytes,TIL),与CAR-T、TCR-T疗法不同,TIL疗法并非从外周血,而是从患者自身的肿瘤活检组织中,分离出肿瘤细胞周围浸润的淋巴细胞,这些细胞号称埋伏在癌细胞周围、识别杀伤能力最强的一支“抗癌敢死队”,这些数量不多但极其珍贵的免疫细胞经过体外扩增、培养后,就能得到数十亿个数量暴增、战斗力升级的TIL大军。一旦回输到患者体内,就可持续寻找并有效地摧毁癌细胞,而且还减少对正常细胞的损害,具有更大的治疗潜力和更少的副作用。值得一提的是,这种“活的”细胞可持续发挥作用,当体内再次出现癌细胞时,这些免疫细胞可快速识别并及时发动攻击。
TIL疗法是治疗实体瘤的“大杀器”,既可作为早期癌症患者术后的辅助治疗手段,消灭放化疗或手术后残留的癌细胞,从而预防肿瘤的复发及转移;又可作为晚期癌症患者的末线补救治疗措施,尽可能延长患者的生存时间。目前可用于黑色素瘤、结直肠癌、非小细胞肺癌、卵巢癌、乳腺癌、宫颈癌、头颈癌等多款实体瘤的治疗(详见下图)。
▼TIL疗法研究中的癌症类型分布

▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
TIL疗法助转移性乳腺癌患者,皮下病变完全消退
肿瘤浸润淋巴细胞(TIL)疗法已被证明可以介导持久的癌症消退,不仅在转移性黑色素瘤中,产生了持久的客观反应;而且在转移性上皮癌(包括乳腺癌)的治疗方面,也取得了不俗的疗效。
《临床肿瘤学杂志》近期报道了一个“转移性乳腺癌患者经TIL细胞治疗后,皮下病变完全消退”的案例。本例患者(4355号患者)确诊为转移性乳腺癌(mBrCa),医生从该患者切除的病变组织中,分离并培养TIL细胞,在接受了针对10种已确定的自体新抗原的7.2e10 TIL细胞回输,同时联合派姆单抗(≤4次剂量)治疗后,结果显示如下:
1、CT扫描显示:TIL治疗后转移性沉积物消退,左锁骨上病变(红色圆圈)消退,这种部分反应(减少69%)持续了10个月。
2、连续摄影显示:该患者左乳和左锁骨上及右腋窝淋巴结病变的广泛皮下病变完全消退(详见下图)。
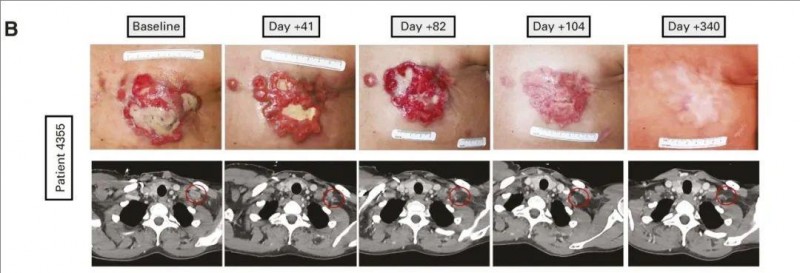
▲图源“JCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
我国自研TIL产品群雄逐鹿,重拳出击多款实体瘤
GT101暴击肺癌、黑色素瘤、宫颈癌,已有患者获完全缓解
GT101注射液是由砂砾生物研发的一款TIL细胞疗法,2022年4月22日,获中国NMPA的临床试验默示许可(受理号:CXSL2200061),它也是我国首个获批临床的TIL细胞产品!
GT101在2024年美国临床肿瘤学会(ASCO)大会上,公布了1期临床研究(NCT05430373)的惊艳数据。本次共入组14例中位年龄为46.9岁的实体瘤(包括小细胞肺癌、黑色素瘤、宫颈癌)患者,给予淋巴细胞清除+GT101回输治疗。
结果显示:总体(n=14)客观缓解率(ORR)达到35.7%,其中,7.1%(1例)患者幸运地获得完全缓解(CR),部分缓解(PR)率达部分缓解(4例),57.1%(8例)的患者达到病情稳定(SD)。值得一提的是,在宫颈癌患者中(11/14),客观缓解率(ORR)高达45.5%,其中1例患者获得完全缓解(CR),4例患者获得部分缓解(PR)。
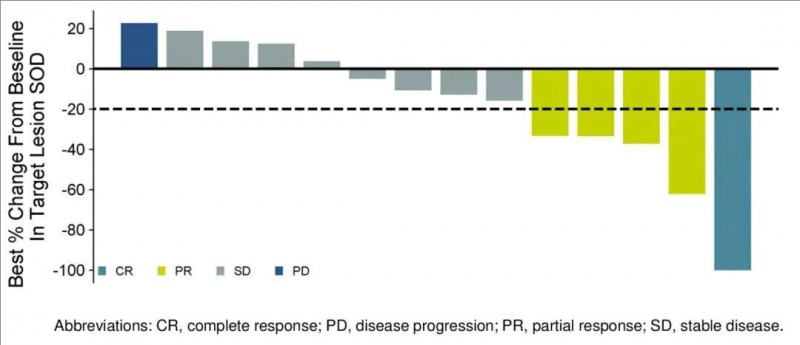
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
除了ASCO大会上公布的数据外,《莫尔生物医学》还报道过“一位晚期复发及转移性宫颈癌患者,经GT101治疗28天,即达部分缓解,且淋巴结转移灶明显消退”的案例。
该患者确诊为复发/多发性转移性宫颈癌,计算机断层扫描显示,该患者左下腹部(详见图a,红色箭头)、左锁骨上淋巴结(详见图c,绿色箭头),均存在皮下转移。此时临床已无适合她的治疗方法了。
但好在天无绝人之路,医生顺利从她的腹股沟淋巴结转移灶中,扩增到了TIL细胞,这也使得她能够成功入组,接受IL-2(白细胞介素-2)+ICI(免疫检查点抑制剂)+GT101 TILs细胞回输治疗。并个最终在TILs回输后仅28天,幸运地达到了部分缓解(PR)。复查计算机断层扫描提示,锁骨上淋巴结萎缩(详见图b,黄色箭头)。
▼该患者在TILs回输前后,计算机断层扫描对比
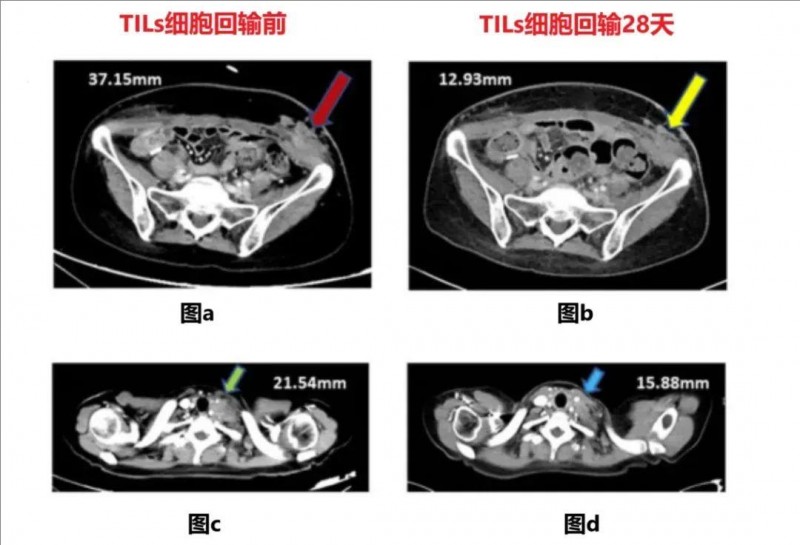
▲截图源自“BMC官网”
注:
①图a红色箭头:代表左下腹部淋巴结;
②图c绿色箭头:代表左锁骨上淋巴结;
③图b黄色箭头:代表锁骨上淋巴结,TIL回输后可见明显萎缩;
④图d蓝色箭头:代表左下腹部皮下转移,与左侧一致。
我国自研首款无需清淋的GC203,卵巢癌疾病控制率超83%
GC203是由上海君赛生物研发的全球首款非病毒载体基因修饰的TIL细胞疗法,并于2024年4月28日,获中国NMPA的批准进入临床研究阶段。与美国上市的Lifileucel不同,这款我国自研的TIL产品,在回输TIL细胞前,无需接受高强度非清髓性清淋预处理;TIL细胞回输后也无需输注任何剂量的IL-2。这极大避免了美国Lifileucel产品黑框警告的相关不良反应(如严重感染、持续性严重细胞减少症、心肺肾功能损伤等),所有患者仅需入住普通病房即可接受治疗,大幅提高了TIL疗法的安全性、可及性、便捷性。
在2024年ASCO大会上,公布了GC203一期临床研究(NCT05468307)的最新数据。本次共入组18例可评估疗效的复发性卵巢癌患者,既往接受过中位2.5线化疗方案(包括免疫检查点抑制剂、多聚ADP核糖聚合酶抑制剂)。入组接受GC203 TIL细胞治疗后,结果显示:
1、疾病控制率(DCR):DCR高达83.3%(95%CI:60.8%~94.2%),其中2例患者幸运地获得完全缓解(CR),4例达到部分缓解(PR),9例达到病情稳定(SD)。
2、客观缓解率(ORR):ORR达到33.3%(95%CI:16.3%~56.3%)(详见下图)。
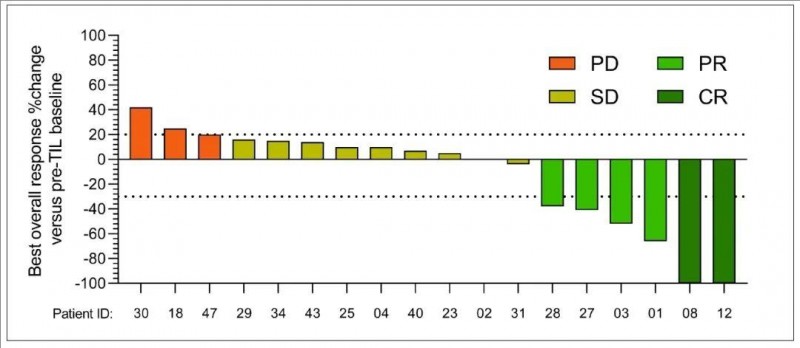
▲图源“JUN CELL官网”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、总生存(OS)率:6个月的OS率高达75.6%(范围:57.4%~99.6%);12个月的OS率达到68.8%(范围:49.3%~95.9%)。
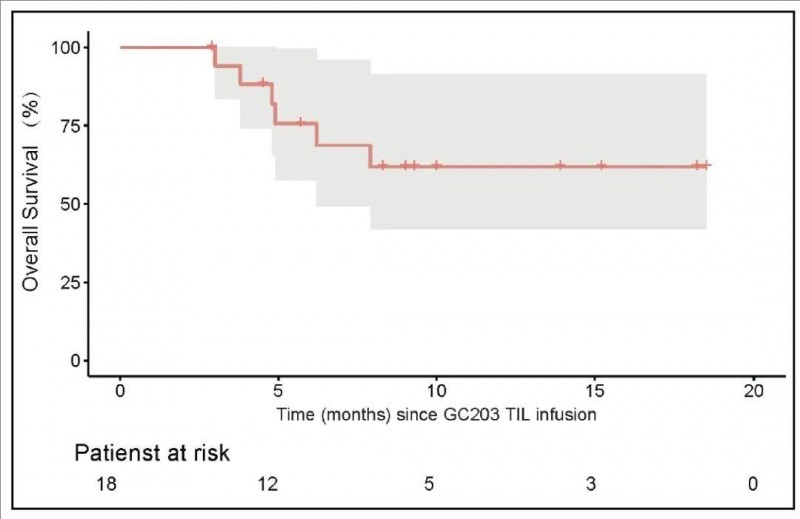
▲图源“JUN CELL官网”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
其中一位卵巢子宫内膜样癌患者在GC203治疗后,幸运地达到部分缓解。该患者既往曾接受过5种全身治疗(包括化疗、PARP抑制剂),但病情仍持续进展。最终入组接受GC203 TIL细胞回输治疗,治疗后(2022年6月)复查影像学显示,肝脏及肺部的转移病灶明显缩小;2022年7月再次复查显示,肿瘤靶病灶显著缩小了66%,该患者达到部分缓解(PR)!
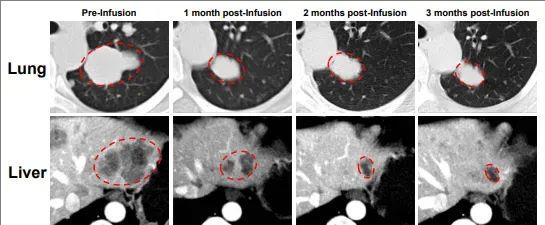
我国其他在研的TIL产品
除了上面提到的两款TIL产品外,我国还有多款在研的TIL疗法正在开展临床研究,下面全球肿瘤医生网小编针对其中的几款代表性产品,进行简单介绍,以供癌友们参考。
1、GT201:沙砾生物
GT201是沙砾生物自主研发的第二款TIL细胞产品,2023年7月11日,获国家药品监督管理局(NMPA)的临床试验默示许可,用于复发或转移性实体瘤的治疗,这也是我国首款进入注册临床试验的基因编辑型TIL产品。
2、HS-IT101注射液:华赛伯曼
“HS-IT101注射液”是华赛伯曼公司研发的一款自体天然加强TIL产品,2023年11月29日,其新药IND申请,获中国国家药品监督管理局(NMPA)批准(受理号:CXSL2300599),用于晚期实体瘤的治疗。
3、GC101:君赛生物
GC101是由君赛生物研发的全球首个无需清淋及IL-2输注的天然TIL细胞治疗产品。其临床新药IND申请,于2022年4月24日,获中国NMPA批准(受理号:CXSL2200070)。
GC101已在临床研究中,展现出良好的疗效,且安全性可控。全部入组患者中,有3例患者达到部分缓解(PR),另有2例患者幸运地获得完全缓解(CR),且CR持续时间分别>8个月、>6个月。
4、ZLT-001注射液:智瓴生物
ZLT-001注射液是由智瓴生物自主研发的一款TIL细胞产品,2023年1月28日,获中国NMPA的临床试验默示许可(受理号:CXSL2200552),用于晚期复发或转移性宫颈癌的治疗,它也是华南地区首个获批临床的TIL产品。
5、BST02:百吉生物
BST02是由百吉生物自主研发的一款重磅TILs细胞产品,2023年10月26日,美国食品药品监督管理局(FDA)批准了BST02的Ⅰ/Ⅱ期临床试验申请,用于各类肝癌的治疗,它也是全球首个进入临床阶段的用于肝癌治疗的TIL细胞产品。
6、C-TIL051:西比曼生物
“C-TIL051”是西比曼生物研发的一款新型TIL产品,2022年10月,美国FDA批准了其临床新药IND申请,用于治疗PD-1抗体难治或复发性晚期非小细胞肺癌(NSCLC)。此外,C-TIL051还可用于宫颈癌、黑色素瘤、头颈部鳞状细胞癌等泛癌种实体瘤的治疗。
7、HV-101注射液:天科雅生物
“HV-101注射液”是由天科雅生物及杭州厚无生物医药共同研发的一款新型TIL产品,2023年1月29日,获中国NMPA的临床试验默示许可(受理号为:CXSL2200574),用于晚期复发或转移性实体瘤的治疗。
8、LM103注射液:蓝马医疗
“LM103注射液”是由苏州蓝马医疗公司研发的一款TIL产品,2023年7月13日,获中国NMPA的临床试验默示许可,用于治疗晚期实体瘤。值得一提的是,它是国内首个获临床许可,使用滋养细胞(Feeder)工艺的TIL产品。
小编寄语
TIL细胞疗法具有将癌症自身肿瘤组织“变废为宝”的神奇魔力,是隐藏在患者体内的最强抗癌军团。如今这款抗癌黑科技经过30多年的发展,终于从基础研究阶段,走向了临床!值得欣慰的是,近年来我国紧随美国的脚步,多家生物公司纷纷加入TIL产品的研发大军中,并有多款产品正式获批开展临床研究,主要针对非小细胞肺癌、乳腺癌、胆管癌、宫颈癌、食道癌、卵巢癌等多款实体瘤。如今这款救命疗法对中国患者而言,终于不再是遥不可及的梦。想寻求TIL疗法帮助的患者,可将近期病理及基因检测结果、治疗经历等资料,提交至医学部,进行初步评估。
参考资料
[1]Hong H,et al.Clinical trial landscape for TIL therapy: emerging insights and future directions in oncology. J Transl Med. 2024 Nov 8;22(1):1008.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11545542/
[2]Zacharakis N,et al.Breast cancers are immunogenic: immunologic analyses and a phase II pilot clinical trial using mutation-reactive autologous lymphocytes[J]. Journal of Clinical Oncology, 2022, 40(16): 1741-1754.
https://ascopubs.org/doi/full/10.1200/JCO.21.02170
[3]Qin H,et al.Phase 1 study of GT101 as an autologous tumor infiltrating lymphocyte (TIL) therapy in advanced solid tumors[J]. 2024.
https://meetings.asco.org/abstracts-presentations/233955
[4]Zhao X,et al.T cell receptor repertoire characteristics and therapeutic potential of tumor infiltrating lymphocytes (TILs) derived from linkstatic lymph node in cervical cancer. Mol Biomed. 2024 Nov 4;5(1):51.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11532323/
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
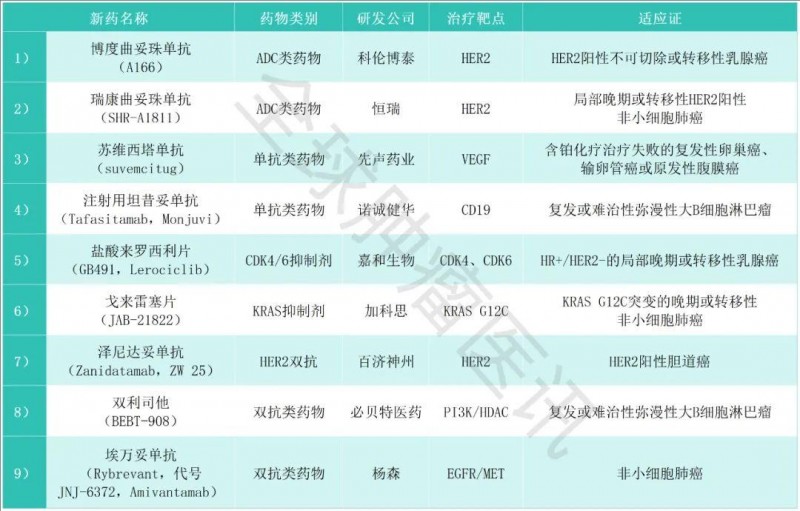
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




