【临床试验招募】科州/滨江药物妥拉美替尼临床试验
招募标准
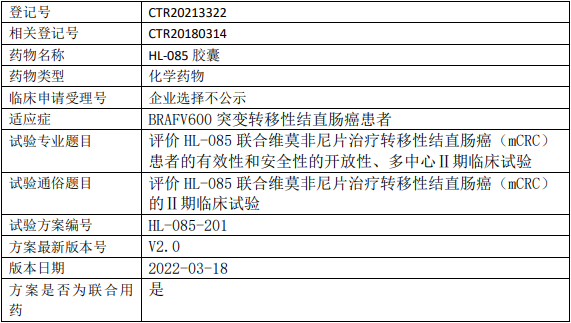
科州/滨江药物妥拉美替尼临床试验,评价妥拉美替尼(HL-085胶囊)联合维莫非尼片治疗转移性结直肠癌有效性、安全性、开放性、多中心的Ⅱ期临床试验
试验目的
Ⅱa期研究主要目的
评价HL-085联合维莫非尼片治疗转移性结直肠癌(mCRC)患者的疗效,基于由研究者根据实体瘤评价标准(RECIST)v1.1评估的客观缓解率(ORR)。
Ⅱb期研究主要目的
评价HL-085联合维莫非尼片治疗BRAF V600E突变的mCRC患者的疗效,基于由独立影像评审委员会(IRC)根据RECIST v1.1评估的客观缓解率(ORR)。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至 无上限 (最大年龄)
性别:男+女
健康受试者:无
出入排标准
入排标准
1、筛选前自愿签署书面知情同意书。
2、签署知情同意书时年龄≥18周岁,男性或女性。
3、mCRC患者:
a)经病理组织学/细胞学确诊,且;
b)经1线或2线治疗疾病进展或不能耐受,或不适合现有1线治疗者(适用于Ⅱa期);经1线或2线治疗疾病进展或不能耐受者(适用于Ⅱb期)。
4、根据实体瘤疗效评价标准(RECIST V1.1),至少有一个可测量的病灶。
5、ECOG体力状况评分0分或1分。
6、预期生存期大于3个月。
7、能够口服药物。
8、具有充分的骨髓和器官功能。
排除标准
1、既往使用过RAS抑制剂,RAF抑制剂,MEK抑制剂。
2、既往或筛选时有视网膜疾病。
3、心脏功能受损或临床意义显著的心脑血管疾病临床无法控制的疾病。
4、既往或目前存在CK升高相关的神经肌肉类疾病(例如炎症性肌病、肌营养不良、肌萎缩性侧索硬化、脊髓性肌萎缩症、横纹肌溶解综合征)。
5、肝功能受损,定义为Child-Pugh B级或C级。
6、既往抗癌治疗之后毒性反应尚未恢复到0或者1级水平(脱发、色素沉着和2级化疗相关神经毒性除外)。
7、治疗开始前7天内,或研究期间需要使用影响细胞色素P450(CYP)酶活性者,如CYP2C9、CYP3A4的强诱导剂、强抑制剂,正在服用经CYP1A2代谢的治疗窗较窄的药物。







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




