【临床试验招募】劲方药业GFH925临床试验
招募标准
劲方药业GFH925临床试验,评估GFH925片治疗具有KRAS G12C突变的晚期实体瘤安全性/耐受性、药代动力学和有效性的I/II期临床试验
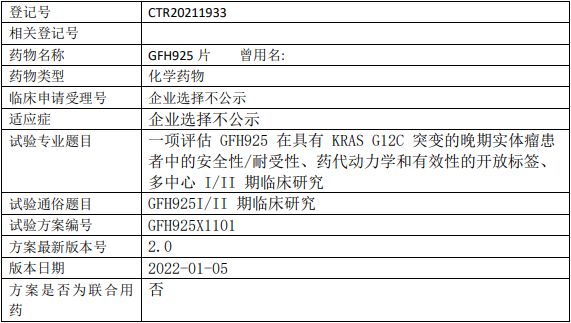
试验目的
Ⅰ期主要目的
为评估GFH925在KRAS G12C突变的晚期实体瘤患者中的安全性/耐受性,确定GFH925的最大耐受剂量和/或推荐的II期剂量。
II期主要目的
评估GFH925在KRAS G12C突变的晚期NSCLC患者中的疗效。
试验设计
试验分类:安全性和有效性
试验分期:其它 其他说明:I期+ II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入排标准
入选标准
1、自愿参加研究并签署知情同意书;
2、在签署知情同意书时年满18周岁;
3、具有至少一个可测量病灶(依据RECIST 1.1标准);
4、既往抗肿瘤治疗的毒性反应需恢复至基线水平(除残留的脱发效应之外)或≤1级才可入组(神经毒性可接受≤2级);
5、美国东部肿瘤协作组(ECOG)体能状态评分(PS)0~1分;
6、预期生存时间≥12周;
7、有生育能力的女性受试者或男性受试者须同意,从签署知情同意书开始直至末次研究给药后的30天内采取有效的避孕方法。有生育能力的女性受试者在给药前7天内(包含)的血妊娠检测结果应为阴性;
8、研究者判断受试者能够良好沟通、按期随访,遵循方案规定完成研究
排除标准
入选标准
1、自愿参加研究并签署知情同意书;
2、在签署知情同意书时年满18周岁;
3、具有至少一个可测量病灶(依据RECIST 1.1标准);
4、既往抗肿瘤治疗的毒性反应需恢复至基线水平(除残留的脱发效应之外)或≤1级才可入组(神经毒性可接受≤2级);
5、美国东部肿瘤协作组(ECOG)体能状态评分(PS)0~1分;
6、预期生存时间≥12周;
7、有生育能力的女性受试者或男性受试者须同意,从签署知情同意书开始直至末次研究给药后的30天内采取有效的避孕方法。有生育能力的女性受试者在给药前7天内(包含)的血妊娠检测结果应为阴性;
8、研究者判断受试者能够良好沟通、按期随访,遵循方案规定完成研究
排除标准
1、有明显的心血管系统疾病;
2、研究者判断不稳定的脑转移患者;
3、存在显著的消化道疾病,如顽固性呃逆、恶心、呕吐,严重的消化道溃疡、肝硬化,活动性消化道出血,或其他影响吞咽药片或显著影响口服药物吸收的疾病;肝癌患者如存在布卡综合征或门脉栓子导致的严重门脉高压也需要排除;
4、有重大急性或慢性感染;
5、孕期或哺乳期妇女;
6、已知对研究药物或其制剂中的任何成分过敏;
7、研究者认为不适合参加本研究的其他情况。







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




