【临床试验招募】阿斯利康DS8201临床试验(HER2突变的晚期非小细胞肺癌)
招募标准
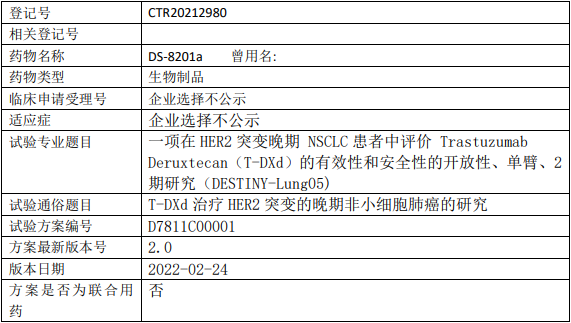
阿斯利康DS8201临床试验,评价DS8201(Trastuzumab Deruxtecan、T-DXd)治疗HER2突变晚期非小细胞肺癌有效性和安全性的II期临床试验
试验目的
在HER2阳性晚期非小细胞肺癌(NSCLC)患者中评价Trastuzumab Deruxtecan(T-DXd)的有效性和安全性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入排标准
入选标准
1、筛选时男性或女性受试者的年龄须≥18岁
2、病理上记录为转移性非鳞状NSCLC。
3、通过中心实验室检测记录的HER2阳性。
4、WHO/ECOG体能状态评分为0或1。
5、入组前14天内器官和骨髓功能足够。
6、筛选时最短预期生存时间≥12周。
7、入组前有足够的治疗洗脱期。
8、与未绝育的男性伴侣性生活活跃,具有绝经后状态或WOCBP血清妊娠试验结果为阴性的证据。
9、与未节育的男性伴侣进行活跃性生活的女性受试者,必须使用至少1种高效的避孕方法。
10、对于与具有生育能力的女性伴侣性生活活跃的未节育男性受试者,从筛选至T-DXd末次给药后4个月内必须使用含杀精剂的避孕套。
11、自筛选期至整个研究干预期间,女性受试者不得捐献卵子。
排除标准
排除标准
1、鳞状组织学NSCLC
2、研究者认为有可能增加毒性风险的共存疾病。
3、3年内有多种原发性恶性肿瘤
4、受试者在入组前6个月内有心肌梗死病史或症状性CHF(NYHA II至IV级)。
5、基于筛选期ECG结果,校正的QT间期(QTcF)延长至>470 ms(女性)或>450 ms(男性)。
6、ILD/非感染性肺炎病史、当前有ILD/非感染性肺炎
7、需要静脉用抗生素、抗病毒药物或抗真菌药物治疗的未受控制感染 或活动性感染
8、活动性原发性免疫缺陷、已知HIV感染、或活动性乙肝或丙肝感染。
9、存在物质滥用或研究者认为可能干扰受试者参与临床研究或临床研究结果评价的任何其他医学疾病(如具有临床意义的心脏或心理疾病)。
10、既往抗癌治疗后毒性未缓解,定义为毒性尚未缓解至≤1级或基线(脱发除外)。
11、任何同步抗癌治疗
12、已知会对T-DXd或其任何研究药物辅料产生过敏反应或超敏反应。
13、对其他mAb有严重超敏反应史。
14、经研究者判定不太可能遵从研究步骤、限制及要求的受试者不得参与本研究。
15、妊娠期(通过阳性妊娠试验证实)或哺乳期妇女受试者, 或计划怀孕的受试者。









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




