【临床试验招募】罗氏中国GDC-6036临床试验
招募标准
罗氏中国GDC-6036临床试验,评价单药GDC6036(RO7435846片)与多西他赛相比治疗KRAS G12C突变阳性晚期或转移性非小细胞肺癌有效性、安全性及药代动力学的II/III期临床试验
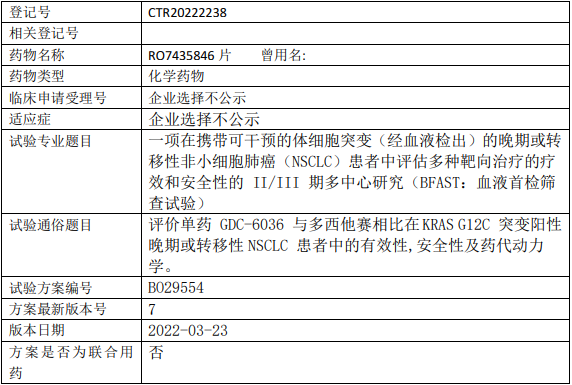
试验目的
本研究中国区仅参加队列G(KRAS G12 C+2L+队列),此队列将采用随机、开放性设计,在经中心实验室测定携带 KRAS G12 C 突变的经治的晚期或转移性NSCLC患者中,评价GDC-6036单药治疗与标准治疗多西他赛相比的有效性、安全性和药代动力学。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至 无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入排标准
入选标准
1、血液学的预筛选:患者必须符合以下标准才有资格进行基于血液的NGS;ctDNA检测筛查:签署本研究血液筛查部分的知情同意书,并愿意根据已识别的致癌体细胞突变参与指定队列组织学或细胞学确诊为不可切除的、不适合联合放化疗的IIIb期(晚期)或IV期(转移性)NSCLC混合肿瘤应根据主要细胞类型进行分类。
2、年龄大于18岁。
3、美国东部肿瘤协作组(ECOG)体力状况评分:0到2。
4、另外,为入组研究治疗队列,患者必须符合以下相应治疗队列的特定标准。
5、队列G的筛选: 已签署知情同意书且签署知情同意书时年龄大于18岁。
6、通过F1LCDx检测(或中国大陆申办者指定的检测)确定是否存在KRAS G12C突变。
7、经研究者判断,患者具有遵守研究方案的能力。
8、愿意并能够遵守所有研究相关程序,包括通过电子设备或其他方式完成患者报告的终点。
9、组织学证实的局部晚期的、不可切除/不可手术的、或转移性的,不可治愈的NSCLC。
10、根据RECIST v1.1标准,具有可测量病灶。
11、东部肿瘤协作组体能状态评分为0或1分。
12、预期存活时间大于12周。
排除标准
排除标准
1、血液学的预筛选:符合以下任一标准的患者将不得参与本研究的血液筛查部分:无法吞咽口服药物。
2、妊娠或哺乳期妇女。
3、未接受治疗的症状性CNS转移。
4、筛选前5年内具有除NSCLC以外的恶性肿瘤史,转移或死亡风险可忽略不计的恶性肿瘤(例如,5年OS率?90%)除外,例如充分治疗的宫颈原位癌、非黑色素瘤皮肤癌、局限性前列腺癌、乳腺导管原位癌或I期子宫癌。
5、患有严重的心血管疾病。
6、已知的HIV阳性或患有AIDS相关疾病。
7、患有并发疾病(包括医学病症,如需要静脉注射抗生素治疗的活动性感染或或存在实验室检测异常)或具有的既往病史使得患者在接受研究药物治疗后将被置于不可接受的风险、或将混淆研究结果的解读。
8、不能遵守该试验方案的其他要求。
9、此外,符合任何队列特定排除标准的患者将不得入组相应的治疗队列。
10、队列G的筛选: 要入组治疗队列,患者必须满足并继续符合上述基于血液的NGS ctDNA检测筛查指定的所有合格性标准,符合以下标准的患者均不得入组队列G:无法或不愿意服用片剂。
11、吸收不良综合征或其他会干扰肠内吸收的疾病。
12、通过F1LCDx检测(或中国大陆申办者指定的检测)确定的已知伴随的第二个致癌驱动因素(包括敏感型EGFR突变、ALK重排、ROS1重排、BRAF V600E突变、NTRK融合、RET融合、MET外显子14跳跃突变)。
13、已知的未接受治疗的CNS转移,或活动性的CNS转移(进展中或需要抗惊厥药或皮质类固醇来控制症状)。
14、软脑膜转移或癌性脑膜炎。
15、未控制的胸腔积液、心包积液,或需要反复引流的腹水(两周一次或更频繁)–可能允许患者留置胸腔或腹部引流管,只要患者已从手术操作中充分恢复,血流动力学稳定且症状改善。
16、研究者认为可能影响患者安全的任何活动性感染,或在第1周期第1天前7天内需要静脉注射抗生素的严重感染 在暴发大流行或流行性疾病的情况下,应根据当地或机构指南或相应的专业协会指南(例如,美国临床肿瘤学会或欧洲肿瘤内科学会)考虑研究期间进行活动性感染筛查。
17、临床重大肝脏疾病病史,包括病毒性肝炎或其他肝炎,目前酗酒或肝硬化。
18、已知的活动性或未受控制的HIV感染。









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




