【临床试验招募】华健未来HJ891临床试验
招募标准
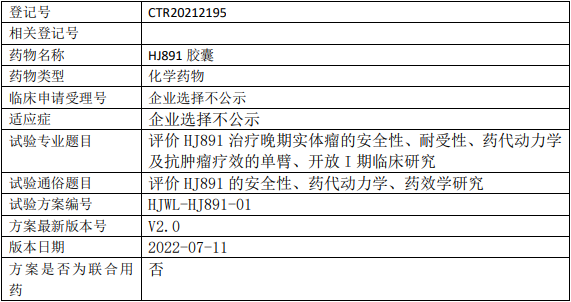
华健未来HJ891临床试验,评价HJ891胶囊治疗晚期实体瘤安全性、耐受性、药代动力学及抗肿瘤疗效的I期临床试验
试验目的
评价HJ891治疗晚期实体瘤的安全性、耐受性、药代动力学及抗肿瘤疗效的单臂、开放I期临床研究。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
入排标准
1、受试者发生脑转移或脑膜转移(除外无症状脑转移或临床症状稳定的患者);
2、有无法控制的或重要的心脑血管疾病,包括:
a)首次给予研究药物前6个月内出现纽约心脏病协会(NYHA)II级以上充血性心力衰竭、不稳定型心绞痛、心肌梗塞,或在筛选时存在需要药物治疗的心律失常,左射血分数(LVEF)<50%;
b)有临床意义的QTc间期延长病史,或筛选期QTc间期女性>470ms、男性>450ms;
c)无法控制的高血压,为收缩压≥160mmHg或舒张压≥100mmHg;
3、胃肠道疾病导致不能口服药物,吸收不良综合征,需要静脉营养,不受控制的炎症性胃肠病(如克罗恩病,溃疡性结肠炎等);
4、有需要通过静脉注射抗生素来治疗的活动性感染;
5、首次给药前14天或5个半衰期内(以时间较短者为准)接受过分子靶向治疗、化疗、生物免疫治疗、维甲酸治疗、有抗肿瘤适应症的中药;在首次使用研究药物前14天或5个半衰期内(以时间较短者为准)接受过其它未上市的临床研究药物或治疗;
6、首次给药前14天内接受过治疗性或姑息性放射疗法;
7、在研究治疗首次给药前一周内或5个半衰期内(以时间较短者为准)无法停用CYP3A4强抑制剂或强诱导剂(见附录2);
8、入组前6个月内有深静脉血栓或肺栓塞;
9、不能控制的胸腔积液、心包积液或腹水;
10、既往抗肿瘤治疗相关的毒性未恢复至≤CTCAE1级,脱发除外;先前抗肿瘤治疗导致的不可逆转的(存在并稳定6个月以上)2级或3级毒性,如与异环磷酰胺有关的蛋白尿,如果排除标准中没有其他规定,经研究同意,可以入组;
11、入组前4周内接受过除诊断或活检外的重大的外科手术(如需要全身麻醉),或预期将在研究期间接受重大外科手术;
12、对试验药物及其辅料过敏的患者;
13、接受过器官移植的患者;
14、乙肝表面抗原(HBsAg)阳性且乙型肝炎病毒DNA拷贝数≥2000IU/mL的患者;丙型肝炎病毒(HCV)抗体阳性者,且HCVRNA阳性者;已知人类免疫缺陷病毒(HIV)感染;
15、妊娠期或哺乳期女性患者;
16、不同意在研究期间和研究结束后1个月内采用避孕措施(如宫内节育器[IUD],避孕药或避孕套)的育龄期女性患者;不同意在研究期间和研究期结束后1个月内必须采用避孕措施的有生殖能力的男性患者;
17、估计患者参加本临床研究的依从性不足;
18、研究者认为其他不适合参加本研究的情况。
排除标准
排除标准
1、受试者发生脑转移或脑膜转移(除外无症状脑转移或临床症状稳定的患者);
2、有无法控制的或重要的心脑血管疾病,包括:
a)首次给予研究药物前6个月内出现纽约心脏病协会(NYHA)II级以上充血性心力衰竭、不稳定型心绞痛、心肌梗塞,或在筛选时存在需要药物治疗的心律失常,左射血分数(LVEF)<50%;
b)有临床意义的QTc间期延长病史,或筛选期QTc间期女性>470ms、男性>450ms;
c)无法控制的高血压,为收缩压≥160mmHg或舒张压≥100mmHg;
3、胃肠道疾病导致不能口服药物,吸收不良综合征,需要静脉营养,不受控制的炎症性胃肠病(如克罗恩病,溃疡性结肠炎等);
4、有需要通过静脉注射抗生素来治疗的活动性感染;
5、首次给药前14天或5个半衰期内(以时间较短者为准)接受过分子靶向治疗、化疗、生物免疫治疗、维甲酸治疗、有抗肿瘤适应症的中药;在首次使用研究药物前14天或5个半衰期内(以时间较短者为准)接受过其它未上市的临床研究药物或治疗;
6、首次给药前14天内接受过治疗性或姑息性放射疗法;
7、在研究治疗首次给药前一周内或5个半衰期内(以时间较短者为准)无法停用CYP3A4强抑制剂或强诱导剂(见附录2);
8、入组前6个月内有深静脉血栓或肺栓塞;
9、不能控制的胸腔积液、心包积液或腹水;
10、既往抗肿瘤治疗相关的毒性未恢复至≤CTCAE1级,脱发除外;先前抗肿瘤治疗导致的不可逆转的(存在并稳定6个月以上)2级或3级毒性,如与异环磷酰胺有关的蛋白尿,如果排除标准中没有其他规定,经研究同意,可以入组;
11、入组前4周内接受过除诊断或活检外的重大的外科手术(如需要全身麻醉),或预期将在研究期间接受重大外科手术;
12、对试验药物及其辅料过敏的患者;
13、接受过器官移植的患者;
14、乙肝表面抗原(HBsAg)阳性且乙型肝炎病毒DNA拷贝数≥2000IU/mL的患者;丙型肝炎病毒(HCV)抗体阳性者,且HCVRNA阳性者;已知人类免疫缺陷病毒(HIV)感染;
15、妊娠期或哺乳期女性患者;
16、不同意在研究期间和研究结束后1个月内采用避孕措施(如宫内节育器[IUD],避孕药或避孕套)的育龄期女性患者;不同意在研究期间和研究期结束后1个月内必须采用避孕措施的有生殖能力的男性患者;
17、估计患者参加本临床研究的依从性不足;
18、研究者认为其他不适合参加本研究的情况。









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




