【临床试验招募】富龙康泰FP-208临床试验
招募标准
富龙康泰FP-208临床试验,评估FP208对晚期肿瘤患者安全性和有效性的I期临床试验
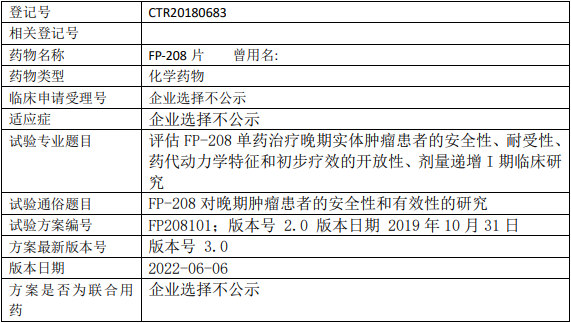
试验目的
主要目的
评估FP-208治疗晚期实体肿瘤患者的安全性和药代动力学特征。
次要目的
初步评估抗肿瘤活性,并探索生物标志物pS6药物和疗效的关系。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:16岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入排标准
1.年龄在18周岁至65周岁之间(含两端界值),性别不限;
2.经组织学或细胞学确认的,标准治疗失败或无标准治疗方案的晚期实体肿瘤患者,包括但不限于肾癌、乳腺癌、神经内分泌肿瘤、肉瘤、肝癌和卵巢癌;
3.ECOG体力评分0或1分;
4.预计生存时间3个月以上;
5.能够使用口服片剂药物;
6.根据RECIST1.1标准,具有可评价或可测量的肿瘤病灶;
7.器官的功能水平必须符合下列要求:
a.足够的骨髓储备:中性粒细胞绝对计数(ANC)≥1.5×109/L,血小板≥90×109/L,以及血红蛋白≥9g/dL;
b.肝脏功能:血清中白蛋白≥3.0g/dL;胆红素≤1.5×ULN,ALT和AST≤3×ULN,如有肝转移,则ALT或AST≤5×ULN;
c.凝血功能:凝血酶原时间≤2×ULN;活化部分凝血活酶时间≤2×ULN;国际标准化比值≤2;
d.肾脏:血肌酐水平≤1.5×ULN,或内生肌酐清除率≥50mL/min(采用Cockcroft-Gault公式);
e.血脂:胆固醇≤300mg/dL或7.75mmol/L;甘油三酯≤2.5×ULN;
f.心脏:左心室射血分数(LVEF)≥50%;心电图基本正常,QT间期(QTc)男性<450ms,女性<470ms。
8.有生育能力的合格患者(男性和女性)必须同意在试验期间和末次用药后至少12周内使用可靠的避孕方法(激素、屏障法或禁欲);育龄期的女性患者在入选前7天内的血或尿妊娠试验必须为阴性;
9.受试者须在试验前对本研究知情同意,并签署知情同意书。
排除标准
出现以下任何一种或多种情况的受试者不得入选研究:
1.首次给药前28天内接受过任何抗肿瘤治疗或任何外科手术;
2.在首次给药前30天内参加过其他治疗性临床试验;
3.首次给药前21天或5个消除半衰期内接受过细胞色素代谢酶CYP3A4强或中度抑制剂或诱导剂者;
4.给药前3个月内接受过PI3K、Akt或mTOR抑制剂(如BKM120、依维莫司、BEZ235、BYL719或AZD2014等)治疗的患者;
5.已知对FP-208或同类药物(PI3K抑制剂或mTOR抑制剂)过敏或对FP-208其他成分过敏的患者;
6.筛选时未从既往抗肿瘤治疗引起的不良事件中恢复(恢复至≤1级,脱发除外);
7.具有脊髓压迫、脑转移或者脑膜转移的病史记录、症状或体征,或根据影像学提示存在水肿或进展表现者;
8.既往患有1型或2型糖尿病、高血压(经药物治疗血压控制稳定者除外)和心脑血管系统疾病者;
9.患者需要在参加研究期间接受其他的抗肿瘤治疗;
10.受试者具有活动性胃肠道疾病或其他疾病可能导致明显影响药物吸收分布,代谢或排泄的因素;
11.已知进行过器官移植的患者;
12.受试者正处于急性感染期并需要药物治疗;
13.受试者HIV检测阳性,无法控制的乙型肝炎(HBV-DNA>500IU/mL或>2500copy/mL),无法控制的丙型肝炎(肝功能指标升高≥CTCAE2级);
14.受试者既往有明确的精神障碍史;
15.受试者有药物滥用史或吸毒史;
16.妊娠或哺乳期妇女;
17.育龄妇女及有生育能力的男性在试验期间和末次用药后至少12周内不能采取有效并且充分的双重避孕措施者;
18.研究者认为患者存在其他可能影响研究结果、干扰其参加整个研究过程的因素,包括曾经或现有的身体状况、治疗或实验室检查异常等;或者研究者认为参加该研究不能使患者获得最大的利益;
19.研究者判断,患者因任何原因不适合参与本研究。
研究者信息
主要研究者
姓名:徐兵河
学位:博士
职称:教授
单位名称:中国医学科学院肿瘤医院
参加医院
医院名称:中国医学科学院肿瘤医院
主要研究者:徐兵河
所在城市:北京-朝阳区









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




