【临床试验招募】再鼎医药MRTX849临床试验
招募标准
再鼎医药MRTX849临床试验,MRTX849片联合西妥昔单抗治疗KRAS G12C突变的晚期结直肠癌的III期临床试验
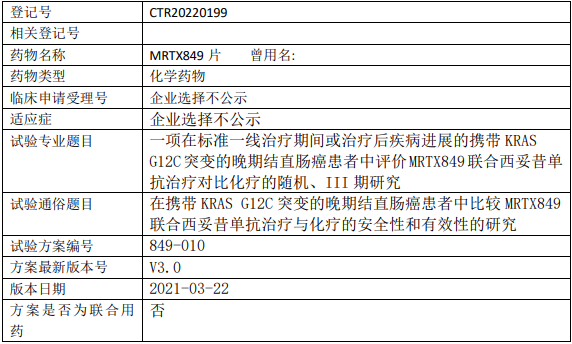
1、试验目的
比较 MRTX849 联合西妥昔单抗与化疗(FOLFIRI 或 mFOLFOX6)在携带 KRAS G12C突变的 CRC 患者二线治疗中的有效性。
2、试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
3、受试者信息
年龄:18 岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
入排标准
入选标准
1.经组织学确诊为存在肿瘤组织 KRAS G12C 突变的结直肠癌。
2.既往在晚期疾病阶段接受过一线含氟尿嘧啶化疗方案(含奥沙利铂或伊立替康),并在治疗期间或治疗后出现影像学记录的疾病进展。
3.根据当地产品标签,具有可接受西妥昔单抗治疗的资格(除外:患者必须有记录的 KRAS G12C 突变,表现或未表现出肿瘤 EGFR 表达阳性)。
4.根据 RECIST 1.1,存在可评价或可测量病灶。
5.能够提供足够数量的代表性肿瘤样本(原发性或转移性、存档或新采集),用于 KRAS G12C 突变状态的中心实验室检测。
6.年龄≥18 岁。
7.预期寿命至少为 3 个月。
8.既往治疗的不良反应恢复至基线或 1 级(任何级别的脱发和≤2级的周围神经病变符合入组要求)。
9.美国东部肿瘤协作组织(ECOG)体能状况评分为 0 或 1。
10.筛选期实验室检查值应满足标准。
11.能够口服药物。
12.有生育能力的女性(WOCBP)或伴侣为 WOCBP 的男性同意在参与本研究期间和研究治疗终止后 6 个月内使用避孕方法。
13.完成知情同意过程,包括签署 IRB/EC 批准的知情同意书。
14.愿意遵守临床试验说明和要求。
排除标准
排除标准
1.既往在辅助治疗和/或后续治疗中均接受过含奥沙利铂和伊立替康的 CRC 治疗方案。
2. 既往接受过靶向 KRAS G12C 突变的治疗(例如 AMG 510)。
3. 既往接受过抗 EGFR 抗体(例如西妥昔单抗或帕尼单抗)治疗。
4. 在随机化日期前 2 周内中断了最近一次既往抗癌治疗(例如化疗、抗血管新生治疗或放射疗法)。
5. 已知有按计划剂量接受西妥昔单抗、5-FU 或亚叶酸治疗的禁忌症。
6. 活动性脑部转移或癌性脑膜炎。如果脑部转移得到充分治疗且患者在随机分组前至少 2 周内神经系统稳定,且未使用皮质类固醇或者正在接受稳定或递减剂量≤10 mg 每天一次的强的松(或等效剂量),则患者具有入选资格。
7. 已知人类免疫缺陷病毒(HIV)感染或者急性或慢性乙型肝炎或丙型肝炎感染。请注意,如果出现以下情况,则允许患者入组:
针对丙型肝炎病毒(HCV)接受治疗且未检测到病毒载量的患者;
针对 HIV 接受治疗且在随机化前至少 1 个月内未检测到病毒载量、同时接受非 CYP3A4 强效抑制剂稳定给药方案治疗的患者;
接受乙型肝炎(HBV)再活动预防治疗的乙型肝炎患者([HBsAg 阳性且 ALT 正常和 HBV DNA <2000 IU/mL 或<10,000 拷贝/mL]或[HBsAg 阴性和抗 HBc 阳性])。
8. 随机化前 4 周内进行过大手术。
9. 存在有可能改变研究治疗吸收的肠道疾病史或胃部大手术史或无法吞服药物。
10. 以下任何一种心脏异常:
a. 随机化前 6 个月内出现不稳定型心绞痛或心肌梗死。
b. 随机化前 6 个月内出现症状性或未控制的房颤。
c. 随机化前 6 个月内充血性心力衰竭≥NYHA 3级。
d. QTc 间期延长>480 毫秒或有先天性长 QT 综合征家族史或病史。
11. 随机化前 6 个月内有卒中或短暂性脑缺血发作史。
12. 需要持续使用已知会导致QTc间期延长或已知的CYP3A酶强效抑制剂或诱导剂合并用药进行治疗,且在入组研究前无法转换为替代治疗。
13. 在疾病评估期间,已知或疑似存在其他恶性肿瘤,可能被误认为研究中的恶性肿瘤。
14. 妊娠。随机化前,WOCBP 的血清或尿妊娠试验结果必须呈阴性。
15. 在研究期间或研究治疗末次给药后 6 个月内进行母乳喂养或计划母乳喂养。
16. 研究者认为可能干扰患者提供知情同意的能力、参与研究、或结果解读的任何严重疾病、未控制的并发疾病、精神疾病、活动性或未控制的感染或者其他疾病或病史,包括实验室检查结果。
4、研究者信息
1.主要研究者信息
| 姓名 | 学位 | 职称 | 单位名称 |
| 沈琳 | 博士 | 主任医师 | 北京肿瘤医院 |
| 李进 | 博士 | 主任医师 | 上海市东方医院 |
2.各参加机构信息
| 编号 | 机构名称 | (主要)研究者 | 国家或地区 | 省(州)-城市 |
| 1 | 北京肿瘤医院 | 沈琳 | 中国 | 北京市-北京市 |
| 2 | 上海市东方医院 | 李进 | 中国 | 上海市-上海市 |
| 3 | 河南省肿瘤医院 | 王居峰 | 中国 | 河南省-郑州市 |
| 4 | 安徽医科大学第一附属医院 | 顾康生 | 中国 | 安徽省-合肥市 |
| 5 | 华中科技大学同济医学院附属协和医院 | 张涛 | 中国 | 安徽省-合肥市 |
| 6 | 复旦大学附属中山医院 | 刘天舒 | 中国 | 湖北省-武汉市 |
| 7 | 复旦大学附属肿瘤医院 | 陈治宇 | 中国 | 上海市-上海市 |
| 8 | 天津医科大学肿瘤医院 | 巴一 | 中国 | 上海市-上海市 |
| 9 | 哈尔滨医科大学附属肿瘤医院 | 白玉贤 | 中国 | 天津市-天津市 |
| 10 | 福建省肿瘤医院 | 陈奕贵 | 中国 | 黑龙江省-哈尔滨市 |
| 11 | 吉林省肿瘤医院 | 程颖 | 中国 | 福建省-福州市 |
| 12 | 中山大学附属第六医院 | 邓艳红 | 中国 | 吉林省-长春市 |
| 13 | 上海市第一人民医院 | 李 琦 | 中国 | 广东省-广州市 |
| 14 | 浙江省肿瘤医院 | 钟海均 | 中国 | 上海市-上海市 |
| 15 | 中南大学湘雅医院 | 刘合利 | 中国 | 浙江省-杭州市 |
| 16 | 山东省肿瘤医院 | 牛作兴 | 中国 | 湖南省-长沙市 |
| 17 | 陕西省人民医院 | 王建华 | 中国 | 山东省-济南市 |
| 18 | 湖北省肿瘤医院 | 梁新军 | 中国 | 陕西省-西安市 |
| 19 | 湖南省肿瘤医院 | 殷先利 | 中国 | 湖北省-武汉市 |
| 20 | 华中科技大学同济医学院附属同济医院 | 袁响林 | 中国 | 湖南省-长沙市 |
| 21 | 江苏省人民医院 | 束永前 | 中国 | 湖北省-武汉市 |
| 22 | 辽宁省肿瘤医院 | 张敬东 | 中国 | 江苏省-南京市 |
| 23 | 南昌大学第一附属医院 | 熊建萍 | 中国 | 辽宁省-沈阳市 |
| 24 | 浙江大学医学院附属第二医院 | 袁瑛 | 中国 | 江西省-南昌市 |
| 25 | 上海交通大学医学院附属瑞金医院 | 张俊 | 中国 | 浙江省-杭州市 |
| 26 | 中国医科大学附属第一医院 | 曲秀娟 | 中国 | 上海市-上海市 |
| 27 | 四川大学华西医院 | 刘继彦 | 中国 | 辽宁省-沈阳市 |
| 28 | 安徽省肿瘤医院 | 何义富 | 中国 | 四川省-成都市 |
| 29 | 蚌埠医学院第一附属医院 | 刘牧林 | 中国 | 安徽省-合肥市 |
| 30 | 北京大学深圳医院 | 王树滨 | 中国 | 安徽省-蚌埠市 |
| 31 | 江阴市人民医院 | 邓立春 | 中国 | 广东省-深圳市 |
| 32 | 广西壮族自治区人民医院 | 陈可和 | 中国 | 江苏省-无锡市 |
| 33 | 内江市第二人民医院 | 蒋鸥 | 中国 | 广西壮族自治区-南宁市 |
| 34 | 中国医学科学院肿瘤医院 | 周爱萍 | 中国 | 四川省-内江市 |
| 35 | 吉林大学第一医院 | 李薇 | 中国 | 吉林省-长春市 |









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




