【临床试验招募】江苏威凯尔VC004临床试验
招募标准
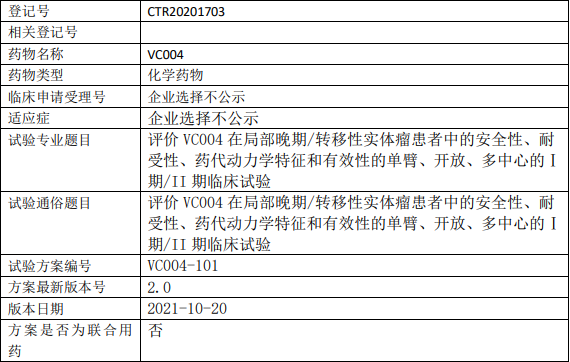
江苏威凯尔VC004临床试验,评价VC004胶囊在局部晚期/转移性实体瘤患者中的安全性、耐受性、药代动力学特征和有效性的单臂、开放、多中心的Ⅰ期/II期临床试验
一、试验目的
第一部分(I 期临床试验):
1、剂量递增阶段
1)评价 VC004 在局部晚期/转移性实体瘤患者中的安全性、耐受性、有效性及 PK 特征。
2)确定 VC004 在局部晚期/转移性实体瘤患者中的 MTD(如有)。
2、剂量扩展阶段
主要目的:
1)评价VC004在NTRK融合阳性局部晚期/转移性实体瘤患者中的安全性。
2)确定VC004在NTRK融合阳性局部晚期/转移性实体瘤患者中的 RP2D。
次要目的:
1)评价VC004 在 NTRK 融合阳性局部晚期/转移性实体瘤患者中的 PK 特征。
2)评价VC004在 NTRK 融合阳性局部晚期/转移性实体瘤患者中的有效性。 第二部分(II 期临床试验):
主要目的:
1)评价 VC004 在 NTRK 融合阳性局部晚期/转移性实体瘤患者中的 ORR。
次要目的:
1)评价 VC004 在 NTRK 融合阳性局部晚期/转移性实体瘤患者中的 DOR、DCR、PFS、OS。
2)评价 VC004 在 NTRK 融合阳性局部晚期/转移性实体瘤患者中的安全性。
3)评价 VC004 在 NTRK 融合阳性局部晚期/转移性实体瘤患者中的 PK 特征。
二、试验设计
试验分类:安全性和有效性
试验分期:其它 I 期+II 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
三、受试者信息
年龄:18 岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
入排标准
入选标准
1.所有受试者或法定代理人愿意并能够在开始任何筛选程序之前书面签署伦理委员会批准的知情同意书。
2.男性或女性,年龄≥18 岁。
3.经组织学或细胞学确诊的局部晚期或转移性实体瘤患者,或目前无标准治疗或经标准治疗失败或对标准治疗不耐受或现阶段不适用标准治疗, 第一部分剂量递增阶段:局部晚期或转移性实体瘤,包括但不限于疾病发展缓慢的唾液腺癌、甲状腺癌、软组织肉瘤、脂肪肉瘤等; 第一部分剂量扩展阶段和第二部分:NTRK融合阳性的局部晚期或转移性实体瘤,各肿瘤类型参考标准治疗详见附录 5。
4.受试者基线病灶要求:根据 RECIST v1.1 或 RANO 的定义,受试者必须有至少一个可测量病灶(适用于 NTRK 融合阳性的局部晚期或转移性实体瘤)。
5.对于原发性中枢神经系统(CNS)肿瘤的受试者必须符合以下标准(仅第一部分剂量扩展阶段和第二部分适用):
1)根据指南或 CNS 肿瘤类型,已接受过包括放疗和/或化疗的治疗,而且放疗与首次接受研究药物治疗至少间隔 12 周。
2)根据 RANO 的定义,磁共振成像(MRI)中有至少一个可测量的病灶,并能够在层厚为5 mm 的≥2 张轴位片上显影,且相互垂直的长径均>10 mm。
3)影像学检查在入组前 28 天内进行,若接受糖皮质激素治疗,则要求进行影像学评估前至少 5 天使用稳定剂量的糖皮质激素。
6.东部肿瘤协作组(ECOG)评分为≤2 分(剂量递增阶段要求 0-1分)。
7.预计生存期≥12 周。
8.受试者必须有适当的器官和血液学功能(在研究药物给药前14天内未接受过输血、EPO、G-CSF 或其他医学支持治疗。
9.对于绝经前有生育可能的妇女必须在开始治疗之前的 7 天内做妊娠试验,妊娠试验必须为阴性,必须为非哺乳期;无生育能力的女性可以不进行妊娠试验及避孕,但须满足:年龄 50 周岁以上、未使用激素治疗且停经至少 12 个月,或已行绝育手术。所有入组患者(不论男性或女性)均应在整个治疗期间及治疗结束后180天采取充分的避孕措施。
排除标准
排除标准
1.既往接受过下列任何一项治疗:
1)首次给药前 4 周内患者曾在前一治疗方案中使用过任何细胞毒性化疗药物、靶向治疗、免疫治疗或其他抗癌药物(注:亚硝基脲或丝裂霉素 C 为首次使用研究药物前 6 周内,口服氟尿嘧啶类和小分子靶向药物为首次使用研究药物前 2 周或药物的 5 个半衰期内(以时间长者为准))。
2)接受其他试验性药物或类似物距离首次用药前的时间未超过该药的 5 个半衰期或 14 天(以时间长者为准)。
3)在首次给药前14 天内使用过以抗肿瘤为适应症的中药及中药制剂、具有肿瘤辅助治疗作用的中药及中药制剂。
2. 首次用药前 4 周内接受过重大手术或试验期间预计进行重大手术(不包含血管通路建立手术、活检手术)。
3. 既往治疗所致不良反应尚未恢复至≤1 级(剂量递增阶段不包括≤2 级脱发,剂量扩展阶段和 II 期临床试验由研究者综合评估)。
4. 原发性中枢神经系统恶性肿瘤(仅第一部分剂量递增阶段)。
5. 已知存在有症状的或未治疗的脑转移或其他中枢神经系统转移。通过完全切除和(或)放疗治疗后保持稳定或出现改善的中枢神经系统病灶除外,但要求进入本研究前 14 天内无需使用糖皮质激素以控制神经系统症状。
6. 有任何提示患重度或未得到控制的全身性疾病的临床依据,研究者认为患者不适合参加试验、或者会影响患者对研究方案依从性的,例如稳定性或失代偿性呼吸系统疾病、脑血管疾病、肝病、肾病、未控制糖尿病、主动脉夹层、主动脉瘤、活动性易出血体质、需要接受全身抗感染治疗者。
7. 任何临床上严重的胃肠道功能异常,可能影响研究药物的摄入、转运或吸收。
8. 患有具有临床意义的心血管疾病,包括:
1)筛选期经超声心动图的左室射血分数(LVEF)≤50%;
2)心力衰竭,纽约心脏病学会(NYHA)分级为 III 级及以上;
3)控制不良的高血压(尽管使用了最佳治疗,但 BP≥150/100 mmHg);
4)既往或当前患有心肌病;
5)心室率>100 bpm 的房颤、严重心律失常患者;
6)不稳定性缺血性心脏病(开始研究治疗前 6 个月内发生过心肌梗死(MI),或每周需要使用>1 次以上硝酸酯类药物控制症状的心绞痛)。
9. 男性 QTcF 间期≥450ms,女性 QTcF 间期≥470ms(Fredericka公式:QTcF=QT/RR0.33)。
10. 在研究药物首次给药前7天内接受过强CYP3A抑制剂或诱导剂治疗。
11. 目前存在的乙型肝炎(乙肝表面抗原[HbsAg]阳性或核心抗体[HbcAb]阳性且 HBV DNA 阳性)、丙型肝炎(HCV 抗体阳性且 HCV RNA阳性)、人类免疫缺陷病毒(HIV)和梅毒感染。
12. 研究者判定其它原因不适合参加本研究的患者。
13. 受试者不愿意或不能遵循方案流程。
四、研究者信息
1、主要研究者信息
姓名:石远凯
学位:医学博士
职称:主任医师
单位名称:中国医学科学院肿瘤医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 中国医学科学院肿瘤医院 | 石远凯 | 中国 | 北京市-北京市 |
| 2 | 江苏省中医院 | 钱军 | 中国 | 江苏省-南京市 |
| 3 | 天津市肿瘤医院 | 王国文 | 中国 | 天津市-天津市 |
| 4 | 河南省肿瘤医院 | 王家强/罗素霞 | 中国 | 河南省-郑州市 |
| 5 | 湖南省肿瘤医院 | 黄钢 | 中国 | 湖南省-长沙市 |
| 6 | 辽宁省肿瘤医院 | 李振东 | 中国 | 辽宁省-沈阳市 |
| 7 | 南方医科大学珠江医院 | 魏婷 | 中国 | 广东省-广州市 |
| 8 | 湖北省肿瘤医院 | 朱又华 | 中国 | 湖北省-武汉市 |
| 9 | 新疆医科大学第一附属医院 | 赵化荣 | 中国 | 新疆维吾尔自治区-乌鲁木齐市 |









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




