【临床试验招募】609A临床试验
招募标准
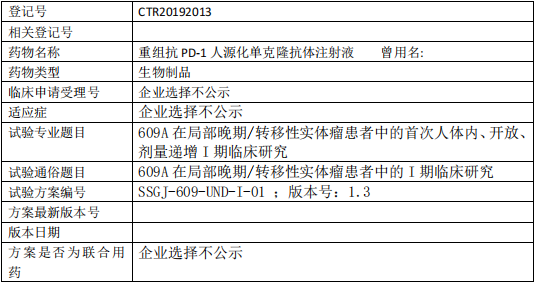
609A临床试验,609A在局部晚期/转移性实体瘤患者中的I期临床研究
1、试验目的
评估 609A 在局部晚期/转移性实体瘤患者中的安全性和耐受性,确定其静脉给药时的最大耐受剂量(MTD)和 II 期推荐剂量(RP2D)。考察 609A 静脉给药的 PK特征,初步评估 609A 的抗肿瘤活性。
2、试验设计
试验分类:安全性
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 70 岁(最大年龄)
性别:男+女
健康受试者:无
入排标准
入选标准
1.能够理解并愿意签署知情同意书(ICF)2.具有组织学或细胞学证实的局部晚期或转移性实体瘤患者,标准治疗失败(疾病进展或无法耐受)或缺乏标准治疗方法。若有驱动基因变异,一定要经过针对驱动基因的标准治疗失败,且无其他标准治疗方案可选时才能入组。
3.既往因脑转移接受过治疗的患者,在入组前 4 周内脑转移病灶无症状或影像学/临床稳定且不需要类固醇药物治疗者可入组本研究。
4.患者必须至少有一个可测量的病灶(靶病灶或非靶病灶),可测量的定义参见附录 1 RECIST v1.1 标准。
5.ECOG 评分 0,1 或 2 分。
6.预期寿命≥3 个月。
7.在 609A 开始治疗之前必须具有足够的器官功能,包括:
a.骨髓储备:绝对中性粒细胞计数(ANC)≥1.0×109/ L; 血小板计数≥100×109/ L; 血红蛋白≥9g / dL 或≥5.6mmol / L。
b. 肝脏:总胆红素≤1.5×ULN,天冬氨酸转氨酶(AST)和/或丙氨酸转氨酶(ALT)≤3×ULN(如果肝功能异常是由于肝癌或肿瘤肝转移所致,则 AST 和/或ALT≤5×ULN)。
c.肾脏:血清肌酐≤1.5×ULN 或估算的肌酐清除率≥50mL/ min(Cockroft 和 Gault 公式)。
d. 凝血试验INR≤2(除外:华法林抗凝治疗的患者可接受INR 2至≤3),活化部分凝血活酶时间(aPTT)≤1.5×ULN。
8.有生育能力的女性或男性受试者必须同意,从签署知情同意开始直至最后一次给药后的 5 个月内受试者本人及男性受试者的伴侣必须采取有效的避孕措施
9.同意筛选期进行肿瘤组织活检取材。
排除标准
排除标准
1.有危及生命的过敏史,或已知对 609A 药物制剂中的蛋白质药物或重组蛋白或辅料过敏。
2. 曾在其他单克隆抗体给药后出现重度过敏反应。
3. 怀孕或哺乳的女性 。
4. 关于既往的抗肿瘤治疗:
a) 已经接受任何获批的或正在研究的抗癌药物,包括化疗、免疫治疗、激素疗法(激素替代疗法、睾酮或口服避孕药除外)、生物疗法的受试者,在 609A 第一次给药前停止治疗少于 3 周或五个半衰期,以时间较长者为准。
b)全身放射治疗在 609A 第一次给药前停止治疗少于 3 周,局部放疗或骨转移放射治疗在 609A 第一次给药前停止治疗少于 2 周。在 609A 第一次给药前 8 周内服用了治疗用放射性药物。
c) 筛选时检测血浆抗 PD-1 药物的 ADA 抗体为阳性。
d) 接受免疫激动剂(如白介素-2、γ 干扰素或溶瘤病毒)治疗的患者,在 609A第一次给药前停止治疗不足 4 周或 5 个半衰期,以时间较长者为准。
5. 严重的慢性或活动性感染,需要系统性抗菌、抗真菌或抗病毒治疗,包括结核感染等。
6. HIV 感染。
7. 活动性乙型或丙型肝炎。无活动性疾病的 HBV 携带者(HBV DNA滴度<1000 cps/mL 或 200 IU/mL)或治愈的丙肝(HCV RNA 检测阴性)可以入组。
8. 有间质性肺病、特发性肺纤维化、未解决的活动性或慢性炎症性肺病病史者不能入组。有放射性肺炎但已恢复的受试者可以入组。
9. 急性或慢性不受控制的肾脏疾病(肾癌和肾转移癌除外),胰腺炎或肝脏疾病(根据研究者评估)。
10. 根据 CTC AE v5.0,任何先前抗肿瘤治疗残留的 AE 未恢复至 0 级或 1 级,或未达到入选/排除标准中规定的其他水平,但残留的脱发效应除外。
11. 既往 PD-1/PD-L1 治疗发生过免疫治疗相关 SAE,包括但不限于间质性肺炎及心肌炎。
12. 发生过免疫治疗相关不良事件(irAE)≥3 级,或由于任何等级的 irAE 而不得不停止先前的抗 PD-1、抗 PD-L1 或抗 CTL4 治疗的受试者。
13. 严重或无法控制的需要治疗的心脏病,充血性心力衰竭 NYHA III 或 IV,药物无法控制的不稳定型心绞痛,近 6 个月有心肌梗死病史,心电图 QTcB (Bazetts 公式) > 450msec,需要药物治疗的严重心律失常(房颤或阵发性室上性心动过速除外)。
14. 持续收缩压>160 mm Hg 和/或使用抗高血压药物后舒张压>100mm Hg 的高血压患者。
15. 在研究药物首次给药前 1 周内有发热。
16. 在研究药物首次给药前 21 天内接受过大手术(不包括诊断性活检)的受试者。
17. 在研究药物首次给药前 28 天内接种了减毒活疫苗。
18. 在研究药物首次给药前 7 天内接受过任何草药或替代疗法,或中成药治疗的患者。
19. 在入组前 5 年内罹患其他原发性恶性肿瘤者,但接受过适当治疗的宫颈原位癌、痊愈的皮肤基底细胞癌者除外。
20. 任何类型的原发性免疫缺陷病史,干细胞或器官移植的病史,或先前临床诊断为结核病。
21. 应排除患有活动性自身免疫性疾病或自身免疫性疾病病史的受试者
22. 需要在计划的研究药物首次给药前 14 天内用糖皮质激素(>15mg /d 泼尼松或等效剂量激素)或其他免疫抑制剂进行全身治疗的患者。在没有活动性自身免疫性疾病的情况下,允许吸入或局部使用类固醇和肾上腺替代类固醇剂量≤10 mg 每日泼尼松当量。可接受眼科,鼻腔和关节内注射类固醇。
23. 任何其他严重的病症(例如:未受控制的糖尿病,活动性未受控制的感染,活动性胃溃疡,未控制的癫痫,脑血管事件,胃肠道出血,具有严重症状和体征的凝血障碍)、精神、心理、家庭或地理状况,根据研究者的判断,可能干扰试验的计划、治疗和随访,或影响受试者的依从性,或将使受试者处于治疗相关并发症的高风险中。
24. 经研究者判断认为患者不适合进入本试验的任何其他情况
研究者信息
1、主要研究者信息
姓名:王洁
学位:医学博士
职称:主任医师
单位名称:中国医学科学院肿瘤医院
2、各参加机构信息
机构名称:中国医学科学院肿瘤医院
(主要)研究者:王洁
国家:中国
省(州)-城市:北京-北京









![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




