70%非小细胞肺癌有靶向药可用,利用基因检测“中靶”有望成为“超长生存者”!
肺癌靶向基因检测可以指导70%的非小细胞肺癌靶向治疗
近十年来,靶向药逐渐异军突起,发展壮大,迅速成为肿瘤治疗界的“新宠”,大有取代放化疗手段的趋势。这并不仅仅取决于靶向药的直接疗效,更多的是得益于靶向药的低毒及副反应小等优势。
据无癌家园的专家介绍道:根据患者的基因突变,医生决定用特定药物的靶向治疗在肺癌中已经成为一种有效的治疗手段。截止到目前为止,已经有阳性意义基因突变的肺癌患者,已经达到非小细胞肺癌患者总数的70%,这意味着将有70%的非小细胞肺癌患者可以通过基因检测找到对应的靶向药物,从而延长生存周期,提高生存质量。
用好靶向药,晚期肺癌患者可活过7年
其中,来自于真实世界的研究表明,的确有部分晚期肺癌患者通过服用靶向药物,实现了长期生存的目的。
间变性淋巴瘤激酶(ALK)融合基因突变是大家熟知的“钻石突变”,ALK基因融合突变在肺癌中发生率较低,仅为3%~5%,虽占比不大,但针对ALK突变的研究较多,靶向药物层出不穷。
克唑替尼作为第一代ALK抑制剂早在2012年时就已获批用于一线治疗ALK阳性非小细胞肺癌的治疗。而以塞瑞替尼为代表的二代ALK抑制剂,2018年已在中国获批上市并进入医保,对临床医生和患者来说意义重大。
近期,一项来源于法国的真实世界研究(IFCT-1302 CLINALK)显示,克唑替尼耐药后序贯二代ALK抑制剂赛瑞替尼(赞可达)患者的中位总生存期(OS)能够长达89.6个月,相当于7年多!这个结果让人不禁瞠目结舌!
该分析中起始克唑替尼治疗后的中位总生存期OS为16.6个月。为了分析克唑替尼治疗进展后不同治疗策略的作用,研究者将患者分为3组:仅最佳支持治疗(BSC,105例)、二代ALK抑制剂以外的药物(74例)、二代ALK抑制剂(84例)。
结果显示,二代ALK抑制剂治疗组中75%的患者首选了塞瑞替尼。在接受二代ALK抑制剂的患者中,中位OS达到惊人的89.6个月,显著长于使用二代ALK抑制剂以外的药物(28.2个月)和BSC(19.6个月);而后续使用二代ALK抑制剂以外的药物未改善生存,BSC组生存更差。

这项研究表明,有些长期生存的晚期肺癌患者,实现了像慢性病一样通过吃药来控制肺癌。
肺癌精准治疗,基因检测先行
小编给大家介绍完这则真实世界的研究后,大家不禁会想,靶向药既然这么好,那是否能够人人都适用呢?其实并非如此!这是因为不同患者携带的突变基因存在差异,因此用药前应该通过基因检测。基因检测能够帮助肿瘤医生针对不同分子变异类型的患者,选择适合他们的治疗方案,从而实行靶向药物治疗。
肺癌可以分为小细胞肺癌和非小细胞肺癌,非小细胞癌又分为腺癌、鳞癌、腺鳞癌和大细胞癌,其中腺癌占主导地位,其次是鳞癌,而小细胞癌不到15%。
临床对于肺腺癌研究的比较多,发病机制研究比较清楚,导致肺腺癌突变的驱动基因突变70%~80%已被发现。在亚洲人群里面,最常见的是EGRF突变,其次是ALK、ROS1、KRAS等。肺腺癌的国内外治疗指南里面都强调了要做基因检测。此外,“无检测,不治疗”已经成为肺癌专科医师“必需”的诊疗行为,这无疑更强调了做基因检测的重要性!

对肺鳞癌来说,如果是活检小标本,不吸烟女性的肺鳞癌主张做基因检测,如果是吸烟的男性鳞癌,则指南不推荐做基因检测。
基因检测对免疫治疗也有一定价值。除了做PD-L1检测,还可以做基因检测来判断“肿瘤突变负荷(TMB)”。虽然现在还没有很强的证据,但对多线治疗(比如靶向治疗或者化疗)失败以后,考虑免疫治疗时可以检测。这时基因检测的目的不是为了找一个特定的靶点指导靶向治疗,而是去计算肿瘤的突变负荷。突变负荷高的患者可以推荐做免疫治疗。
使用FoundationOne CDx有助于实现个性化精准治疗
在2020年ASCO大会上,一项美国新诊断晚期NSCLC患者行基因组检测的临床研究结果显示,二代测序(NGS),尤其是全面基因组测序(FoundationOne®CDx)的使用,有助于减少检测失败或不充分的发生,不错失潜在靶向治疗的机会,并提高对新型生物标志物的检测,从而实现个体化精准治疗。
此项研究共纳入2971例患者,2281例在一线治疗前进行了基因检测。其中1355例接受NGS检测(FoundationOne®CDx:占比18.8%,n=429),另外926例接受非NGS检测。
研究结果显示,NGS检测组比非NGS检测组检测不充分和检测失败的概率更低(检测不充分定义为对ALK、BRAF、EGFR和ROS1至少一个基因检测不成功)。
NGS(含FoundationOne®CDx)组 vs 非NGS组患者检测不充分比例为13.4% (FoundationOne®CDx:4.9%) vs 52.5%。
NGS(含FoundationOne®CDx)组 vs 非NGS组患者检测失败率比例4.2%(FoundationOne®CDx : 1.2%) vs 6.8%。

在非NGS组中,40.3%的患者可能错失靶向治疗选择,而NGS组中这一比例仅为10.1%(FoundationOne®CDx:3.0%)。

从该研究结果可见,NGS(尤其大panel NGS FoundationOne®CDx)检测更为充分、快速,失败概率更低。值得一提的是,仅仅在过去的两个月,就有针对MET外显子14跳突、FGFR2融合和RET融合等多个新兴靶点抑制剂获得FDA批准,并且其中多数使用FoundationOne®CDx作为伴随诊断。想要了解更多关于基因检测的前沿消息请持续关注无癌家园网站。
无癌家园专家点评:
FoundationOne®CDx作为FDA首个且唯一获批的实体瘤大panel NGS检测(伴随诊断级别)因其准确性、全面性和低失误率,是识别常见驱动基因、发现罕见突变、探索新型治疗模式的有力手段。尤其面临研发周期越来越短的新靶点药物,通过精准检测筛选目标基因患者,将有很大机会接受有针对性的、更前沿的靶向治疗。
小编有话说
最后,小编再次很负责任的向所有的癌症患者推荐foundation基因检测,只是为了让更多的癌症患者了解到真正权威的基因检测!应该如何做!为何如此受到权威认证!以避免越来越多的癌友在治疗过程中少走弯路,莫被坑骗!
参考文献
1.https://ascopubs.org/doi/abs/10.1200/JCO.2020.38.15_suppl.9592
2.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5400633/
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
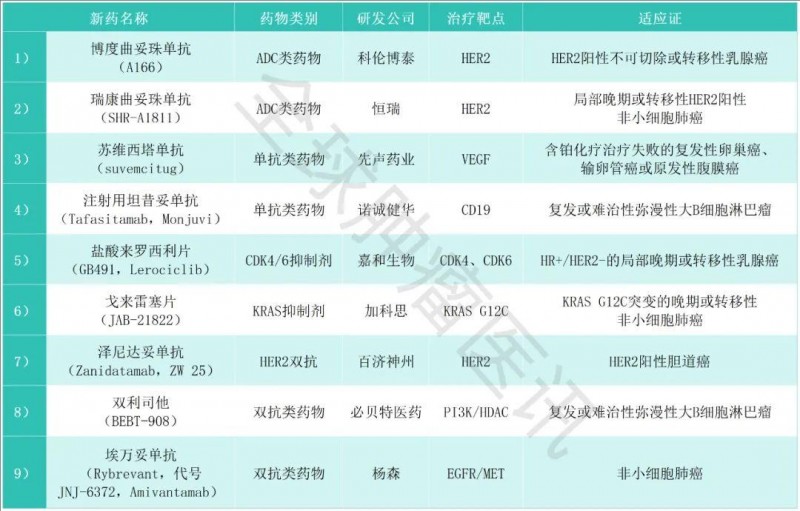
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




