疾病控制率100%!FDA接受抗癌新药pralsetinib (BLU-667) 上市申请!
FDA接受抗癌新药,RET抑制剂,RET基因突变靶向药,RET靶向药Pralsetinib(中文名帕拉西替尼、普雷西替尼)上市申请
精确肿瘤学已经使EGFR,ALK和ROS1畸变患者受益。而RET改变的癌症患者,既往虽有多激酶抑制剂可以用于治疗,但疗效不尽如人意,患者生存期无明显改善,且毒副反应较大,因此此类患者缺乏有效治疗,更多的是接受常规化疗。
2年前ASCO会议上报道了特异性相对较好的靶向RET的药物——BLU-667,让这部分患者迎来了春天。
2020年5月,Pralsetinib(BLU-667,普雷西替尼)用于治疗局部晚期或转移性RET融合阳性非小细胞肺癌的新药上市申请(NDA)和营销授权申请(MAA)已分别被美国FDA和欧洲药监局(EMA)受理。目前,pralsetinib已被美国FDA授予了优先审评资格,预计将于2020年11月23日前做出审批决定。这意味着如果一切顺利,今年的第四季度,我们将迎来既LOXO-292之后的第二款RET抑制剂。
2020年7月2日,pralsetinib(BLU-667,普雷西替尼)再次向FDA提交了新药申请,用于新适应症的审批,治疗患有晚期或转移性RET突变型甲状腺髓样癌和RET融合阳性甲状腺癌的患者。我们期待这款药物能早日获批上市。

抗癌新星BLU-667
BLU-667(pralsetinib,普雷西替尼)是由Blueprint Medicines Corporation公司开发的一种高效且选择性的口服抑制剂,其靶向致癌RET-融合,抗性突变。该药物的临床前期和早期临床验证也已发表在Cancer Discovery上。

根据MD Anderson发布的新闻稿,BLU-667被选中进行调查是因为它对RET的选择性比其他激酶测试的选择性高100倍!并已被证明可有效阻止与多种激酶治疗抵抗有关的基因突变!
疾病控制率100%!ARROW临床试验数据惊艳ASCO
在2020年5月29日ASCO大会上最新公布的 I / II ARROW(NCT03037385)期临床试验的更新数据中,显示了普雷西替尼有可能成为治疗RET改变的甲状腺癌患者的最佳疗法,在一线和复发性治疗中均具有持久的疗效。”
截至2019年11月18日数据发表时,普雷西替尼在NSCLC患者中的总体缓解率(ORR)为61%,95%的患者观察到肿瘤缩小,其中14%的患者达到完全缓解!
对于RET突变型甲状腺髓样癌(MTC)患者,以前接受过卡博替尼或凡德他尼治疗的患者,客观缓解率(ORR)为60%,约98%的患者肿瘤缩小。
而未接受过治疗的MTC患者客观缓解率ORR为74%,并且100%的患者达到了肿瘤缩小。
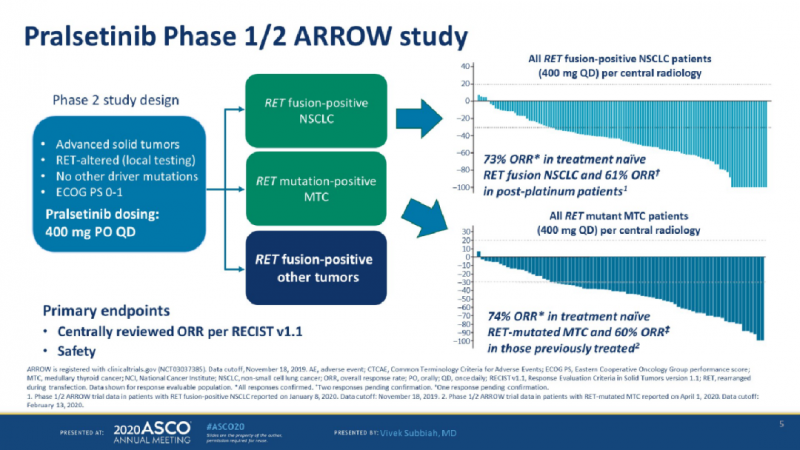
此次报告的数据包括116例接受每日一次pralsetinib 400毫克起始剂量的NSCLC患者(包括80例先前接受过含铂化疗的NSCLC患者、26例未经治疗的NSCLC患者)、11例RET融合阳性甲状腺癌患者、以及12例其它RET融合阳性肿瘤患者。
RET融合阳性NSCLC
截至2019年11月18日数据,不管是初治的,还是接受过治疗的晚期患者,亦或是已经出现脑转的患者,pralsetinib在RET融合阳性NSCLC患者中都表现出强劲的抗肿瘤活性。
在80名先前接受过含铂化疗的患者中,经pralsetinib治疗的客观缓解率(ORR)为61%。有5%的患者实现了经确认的完全缓解(CR),14%的患者出现了靶病灶肿瘤的完全消退。
在26例未接受过全身治疗的患者中,经pralsetinib治疗的客观缓解率为73%(95%CI:52-88%),完全缓解的患者比例为12%。
其它RET融合阳性瘤种
截至2020年2月13日的数据,Pralsetinib在一系列其他RET融合阳性肿瘤中均显示出显著的临床活性。
在11例RET融合阳性甲状腺癌患者中(10例曾接受过全身治疗),经中心评估确认的ORR为91%,疾病控制率为100%。
在之前接受过全身治疗的12例其他RET融合阳性肿瘤患者中,研究者评估的ORR为50%。在所有可评估的胰腺癌(n = 3)和胆管癌(n = 2)患者中均观察到不同程度的缓解,这些类型的肿瘤通常预后较差。
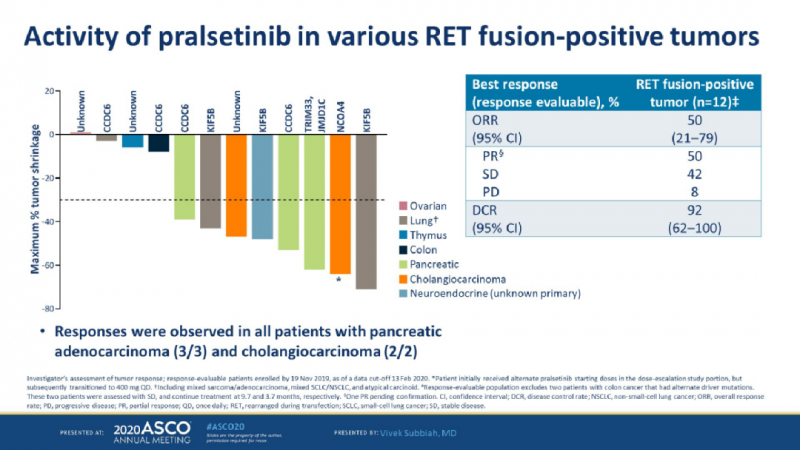
总体而言,截至数据截止,在所有116例患者中,无论既往接受何种治疗,均未达到中位持续缓解时间(DOR),86%的患者持续缓解时间达到6个月,有70%的缓解患者仍在接受治疗,治疗持续时间目前长达22个月。
值得一提的是,Pralsetinib在9例存在脑部转移灶的患者中显示出强劲而持久的颅内抗肿瘤活性。所有患者均出现了CNS转移灶的缩小,实现颅内完全缓解的患者比例为33%。
BLU667的特点表现为:
靶向RET融合基因的特异性较强,不良反应相对比较轻,3级及以上不良反应发生率在10%左右;
同时其治疗反应持续时间长,现有最长持续时间达24个月;
另外,BLU667对颅内病灶有疗效,驱动基因阳性患者较易发生中枢神经系统转移,研究中9例中枢神经受累患者的有效率达78%,提示BLU667能很好地透过血脑屏障;
此外,BLU667对多激酶抑制剂诱导产生的耐药突变也有疗效,凡德他尼和卡博替尼诱导的V804L/M等耐药突变采用BLU667治疗的效果也非常好;
既往使用过PD-1/PD-L1抑制剂的患者也对BLU667有治疗反应。
好消息!BLU-667临床招募中
目前,一项高选择性RET抑制剂BLU-667治疗甲状腺癌、非小细胞肺癌和其他晚期实体瘤患者的I期研究现在国内开始招募患者,如果您是甲状腺髓样癌、含有RET 融合的非小细胞肺癌和其他含有RET变异的晚期实体肿瘤患者,可以尝试联系全球肿瘤医生网医学部评估是否能够入组(4006667998)。
试验目的:
确定每种肿瘤类型的客观缓解率,并明确BLU-667的安全性和耐受性。
入组条件(部分)
1 非小细胞肺癌患者必须有病理学证实和确诊的携带RET融合的局部晚期或转移性非小细胞肺癌,且既往接受过含铂化疗。
2 甲状腺髓样癌患必须有病理学证实和确诊的晚期MTC,在筛选访视之前14个月内疾病已进展,且既往未接受过治疗。
3 患有携带RET突变或融合的其他实体肿瘤。
4 有可测量病灶。
5 同意提供肿瘤组织以进行RET状态确认。
6 签署知情同意书。
申请方式:
做过基因检测的病友,请将报告发送至全球肿瘤医生网医学部,我们的专家将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
1.请将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,医学部收到报告分析完毕后一个工作日内电话联系。
2.直接致电全球肿瘤医生网医学部咨询相关医生。
如何进行RET融合基因检测
看了上面的介绍,大家应该都能了解到这是一款非常值得期待的新药,但是这个药使用需要满足一个硬性条件,具备RET基因融合或突变。那么这究竟是个什么样的突变呢?
RET激酶的基因组改变包括融合和点突变,从而导致RET信号过度活跃和细胞生长不受控制。RET融合和突变发生在多种肿瘤类型中,且发生频率不同。
据统计,在非小细胞肺癌里面,大约1%-2%的患者有RET基因融合,在甲状腺髓样癌中超过60%的患者有RET基因突变,在乳头状甲状腺癌中10%的患者有RET基因融合,具体的信息大家可以看下面的图。所以大家做过多基因检测的患者,可以先看看是否有这个RET基因突变或者融合,一旦这款药物上市,大家就有新希望啦!还没有检测的,Rossy建议大家选择NGS技术进行全面的检测。(如果需要解读报告可以致电全球肿瘤医生网医学部或扫描文末二维码在线解读)
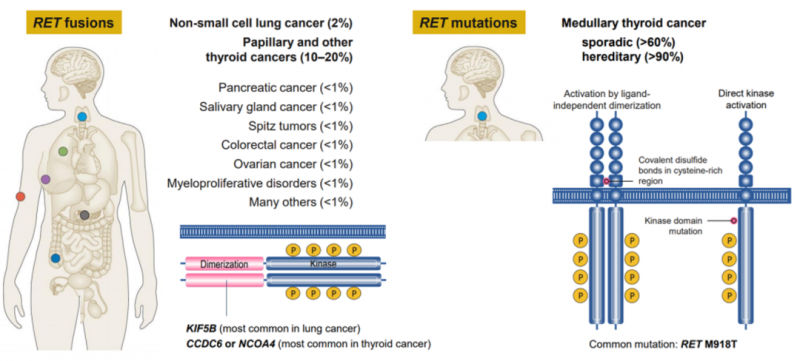
RET融合:非小细胞肺癌2%,甲状腺癌10%·20%,胰腺癌<1%,唾液腺癌<1%,结直肠癌<1%,卵巢癌<1%;RET突变:甲状腺髓样癌>60%
目前BLU-667已经获得了美国FDA优先审批,我们共同期待它早日获批造福大众!
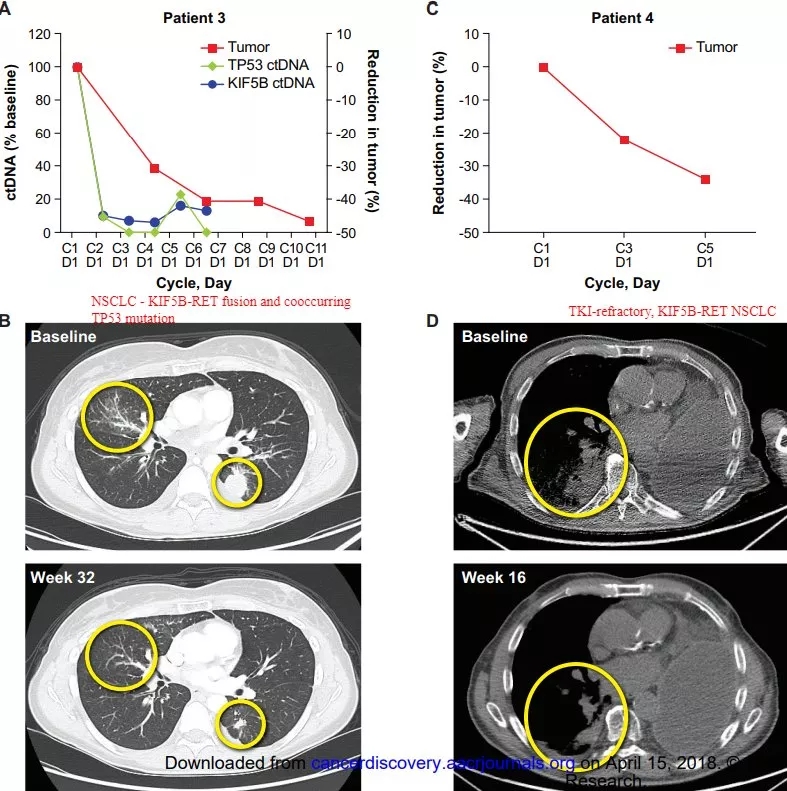
BLU-667治疗案例
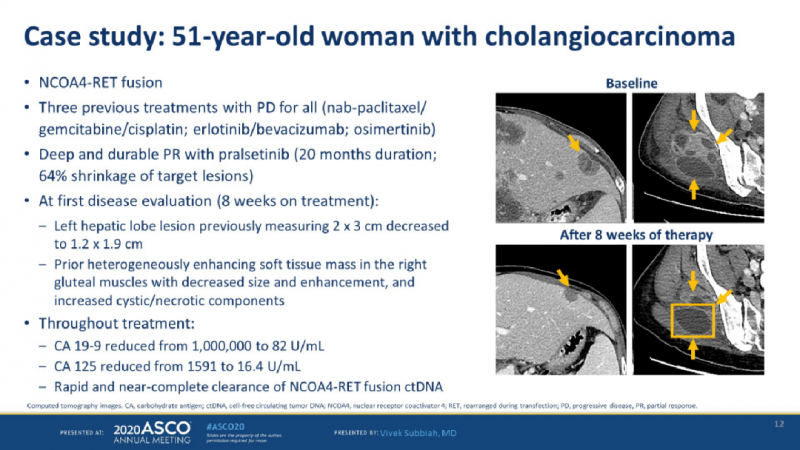
一、51岁的女性胆管癌患者存在NCOA4-RET融合
既往接受过治疗后病情进展,在接受Pralsetinib治疗八周后初次评估,左肝上的病灶由2*3缩小到1.2*1.9;
右臀肌中的软组织肿块大大减小;
肿瘤标记物CA19-9由1000000将至82U/mL;
CA125由1591将至16.4U/mL。
二、一位转移性NSCLC患者在接受治疗后“首次评估时脑部响应”
参考资料:
https://www.targetedonc.com/news/rolling-nda-submitted-for-pralsetinib-in-ret-nsclc-based-on-topline-arrow-data
https://meetinglibrary.asco.org/record/186874/slide
https://www.onclive.com/view/fda-approval-sought-for-pralsetinib-in-advanced-ret-positive-thyroid-cancers
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




