2024年4月24日国家药监局批准西达本胺片(Chidamide、Tucidinostat、爱谱沙)联合R-CHOP用于既往未经治疗的MYC和BCL2表达阳性的弥漫大B细胞淋巴瘤
2024年4月24日国家药监局批准西达本胺片(Chidamide、Tucidinostat、爱谱沙)联合R-CHOP用于既往未经治疗的MYC和BCL2表达阳性的弥漫大B细胞淋巴瘤
2024年4月24日,中国国家药品监督管理局(NMPA)批准了微芯生物自主研发的HDAC口服抑制剂西达本胺片(Chidamide、Tucidinostat、爱谱沙)联合R-CHOP方案(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松)用于既往未经治疗的MYC和BCL2表达阳性的弥漫大B细胞淋巴瘤(DLBCL)患者。这一里程碑式的批准,不仅标志着西达本胺在淋巴瘤治疗领域的又一重大突破,也为众多DLBCL患者带来了新的希望和治疗选择。

获批依据
西达本胺此次获批基于一项随机、双盲、安慰剂对照、多中心III期临床试验DEB试验(NCT04231448),DEB试验也是全球首个在初治、MYC/BCL2双表达弥漫大B细胞淋巴瘤为适应症的III期注册临床研究,该研究由来自全球多个中心的肿瘤专家共同参与,旨在评估西达本胺联合R-CHOP方案在初治MYC和BCL2表达阳性的DLBCL患者中的有效性和安全性。
研究设计
纳入标准:研究纳入了423例初治MYC和BCL2表达阳性的DLBCL患者,这些患者均未接受过任何针对DLBCL的治疗。
随机分组:患者按1:1的比例随机分配接受西达本胺联合R-CHOP方案或安慰剂联合R-CHOP方案治疗。
治疗方案:西达本胺组患者在每个治疗周期第一天口服西达本胺,同时接受R-CHOP方案化疗;安慰剂组患者在每个治疗周期第一天口服安慰剂,同时接受R-CHOP方案化疗。
治疗周期:患者接受6个周期的治疗,每个周期为21天。
维持治疗:在联合治疗后达到完全缓解(CR)的患者接受西达本胺或安慰剂作为维持治疗,最长持续24周。
主要终点和次要终点
主要终点:由研究者评估的无事件生存期(EFS),即从随机分组到首次发生事件(包括疾病进展、复发、死亡)的时间。
关键次要终点:在联合治疗结束时评估的完全缓解率(CRR),即肿瘤完全消失的比例。
其他次要终点:总生存期(OS)、疾病进展时间(TTP)、缓解持续时间(DOR)、安全性等。
中期分析结果
CRR显著提升:西达本胺联合R-CHOP组CRR达到73.0%,安慰剂联合R-CHOP组CRR为61.8%,两组之间的差异具有统计学意义(P=0.014)。
EFS明显改善:西达本胺联合R-CHOP组24个月EFS率为58.9%,安慰剂联合R-CHOP组24个月EFS率为46.2%,两组之间的风险比(HR)为0.68,P值为0.018。
安全性可控:两组的安全性数据与已知风险相符,未发现新的重大安全性信号;西达本胺组≥3级血液学不良事件的发生率总体高于安慰剂组,但大多数患者能够耐受并完成计划的治疗周期。两组均未观察到显著的心脏毒性、肝毒性或肾毒性。
DEB研究结果的解读
DEB研究结果表明,西达本胺联合R-CHOP方案能够显著提高DE-DLBCL患者的CRR和EFS,延长患者的生存时间,且安全性可控;这为DE-DLBCL患者提供了一种新的治疗选择,有望改善他们的预后。
DEB研究的意义
DEB研究是DLBCL治疗领域的重要进展,它首次证实了西达本胺联合R-CHOP方案在DE-DLBCL患者中的疗效和安全性;该研究结果为DE-DLBCL的治疗提供了新的证据和参考,也为未来DLBCL治疗方案的优化和个体化治疗提供了新的思路和方向。
西达本胺简介
西达本胺作为一种亚型选择性HDAC抑制剂,具有独特的抗肿瘤机制。它可以通过以下途径发挥作用:
诱导细胞周期阻滞:西达本胺可提高B细胞淋巴瘤细胞内的组蛋白H3、H4乙酰化水平,导致细胞周期阻滞,从而抑制肿瘤细胞增殖。
促进肿瘤细胞分化:西达本胺可以促进肿瘤细胞分化,使其向正常细胞方向转化,从而抑制肿瘤生长。
诱导肿瘤细胞凋亡:西达本胺可以激活caspase-3等凋亡相关蛋白,诱导肿瘤细胞凋亡。
此外,西达本胺与R-CHOP方案具有协同作用,可以增强R-CHOP方案的疗效,西达本胺可以通过上调CD20表达,增强DLBCL细胞对于利妥昔单抗治疗的敏感性;同时,西达本胺还可以通过上调SOCS3表达抑制JAK2/STAT3等信号通路,下调c-MYC及BCL2的表达水平,从而提升R-CHOP方案对DE-DLBCL的疗效。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
里程碑!mRNA-4157联合派姆单抗让
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

刚刚!"双免王炸"纳
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

2025肺癌生存新希望:六大"
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
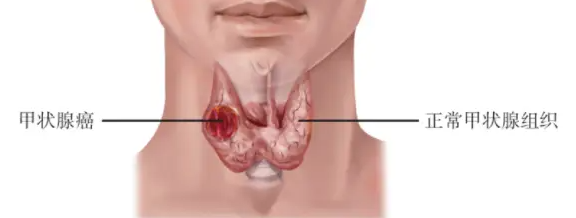
早期甲状腺癌术后五年生存率超99%,但要
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
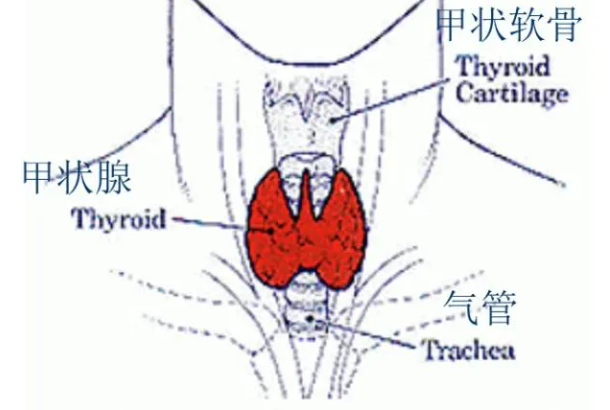
早期甲状腺癌术后五年生存率超99%!但忽
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
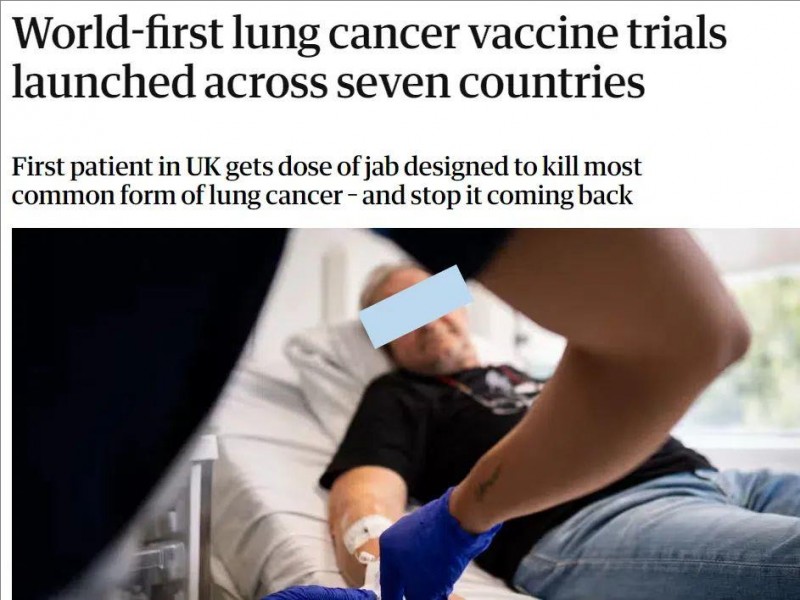
2025年四款肺癌疫苗震撼登场!打一针治
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05








![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




