2020高光时刻!四大新型实体瘤免疫疗法闪耀ASCO!
2020年四大实体肿瘤免疫治疗法,免疫治疗药物闪耀ASCO大会
当基于基因改造的第一个T细胞抗癌疗法-CAR-T技术上市,曾被认为是天方夜谈的治愈奇迹已经成为了现实。目前FDA批准的两款CAR-T疗法,对于特定的血液肿瘤类型总体缓解率都能达到80%以上,这些治疗方法已经证实可以诱发的显着反应 - 即使是生存期仅仅几个月的晚期癌症患者也可以完全根除,在某些情况下强烈响应持续数月甚至数年。
在占比高达90%的实体瘤中,细胞免疫疗法也一直备受瞩目和期许,医学界期望这种依靠自身免疫系统攻击癌症的疗法也能在一部分实体瘤患者身上出现“治愈”奇迹。在刚刚举行的ASCO盛会上,众多新型疗法纷纷闪亮登场,数据振奋人心,相信细胞免疫治疗正式临床应用于实体肿瘤的那一天离我们越来越近了。
一,有望上市!TILs疗法率先宣战实体瘤,震惊四座
在实体肿瘤中最具潜力的TILS(肿瘤浸润淋巴细胞)疗法近两年好消息不断,对于多种临床上难治的实体肿瘤取得了惊艳四座的临床效果。
2019年6月,FDA基于innovaTIL-04(C-145-04)积极的试验的数据,治疗晚期宫颈癌患者的反应率(ORR)高达44%,授予肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的细胞免疫疗法首次获此殊荣。Iovance Biotherapeutics公司与FDA进行讨论之后宣布重大喜讯:FDA支持LN-145治疗晚期宫颈癌的监管申请。这一反馈让Iovance公司可能在2020年下半年为LN-145递交生物制剂许可申请(BLA),加快其上市的进程,一旦FDA批准,这将是首款用于实体瘤的细胞免疫疗法,将给癌症患者带来巨大的生存获益。
此外,早年的研究已经证实黑色素瘤中的TIL治疗具有持续数十年的完全应答(CR)的潜力,这种长期的作用归功于记忆T细胞的持久性。在今年的ASCO会议上,基于TILS细胞的创新型疗法LN-144(Lifileucel)更新了黑色素瘤的临床结果,再次引起了轰动。
C-144-01是一项2期临床试验,招募66名已被诊断患有IIIc期或IV期转移性黑色素瘤的患者。这些患者的特点是至少接受了3~4种全身性治疗都失败后的患者,所有人都接受过PD-1抑制剂治疗,80%接受过CTLA-4抑制剂 ,23%的患者接受过BRAF / MEK抑制剂,可以说是临床上用尽了治疗方案,山重水复疑无路的极晚期患者。还有44%的患者存在肝或脑转移。
该临床试验旨在确定TIL治疗疗法LN-144是否安全有效地治疗转移性黑色素瘤(帮助患者延长寿命和/或减缓癌症进展)。
这些患者在接受手术后,将肿瘤组织中的TIL细胞进行培养后回输,平均注入的TIL细胞:28 x 10^9;IL-2剂量:6次。
实验结果:
不负众望!在最新报道的66例接受过PD-1治疗晚期黑色素瘤患者的试验中,结果显示:
疾病控制率(DCR)高达80.3%;
客观缓解率达到36.4%;
中位随访时间为8.8个月,未达到中位反应持续时间。
更引人注目的是,患有PD-L1阴性的患者也有响应,这说明对免疫检查点抑制剂无效的患者仍能获益于TIL疗法。
对于PD-1治疗后进展的患者,几乎没有其他治疗选择,这种治疗方案的效果几乎无与伦比。

一位晚期黑色素瘤患者肿瘤在治疗前出现广泛转移,在接受TILs疗法后一个月病灶明显缩小,治疗6个月达到完全缓解,治疗两年后仍然处于完全缓解状态,并且体内持续存在肿瘤反应性CD8 + T细胞。

深藏在实体肿瘤中的宝藏-肿瘤浸润淋巴细胞(TIL)
在癌症的早期阶段,免疫系统试图通过动员淋巴细胞的特殊免疫细胞来攻击肿瘤。在手术切除的肿瘤组织中,我们发现大部分是肿瘤细胞,也有少部分淋巴细胞。这些淋巴细胞中有部分是针对肿瘤特异性突变抗原的T细胞,世界免疫学泰斗,美国癌症研究院的外科主任Rosenberg博士认为它们才是深入到敌军内部打击能力最强的免疫细胞,也是深藏在肿瘤中的宝藏!科学家现在已经研发出体外培养方法,把这些肿瘤组织中的特异性淋巴细胞富集起来,再回输给患者,就能够发挥抗肿瘤作用,而且联合PD-1效果会更好。
重要提示
99%的肿瘤患者都不知道,自己手术切除的肿瘤组织中深藏着杀癌能力最强的一群免疫细胞,肿瘤浸润淋巴细胞(TIL),手术后就直接扔掉或者取一小部分做成蜡块,浪费了宝贵的抗癌资源,建议大家在手术前争得手术医生的同意,将新鲜手术组织中的TIL细胞提取并冻存,可以在术后回输预防复发,或者是先冻存起来,以备未来不时之需。因为手术后未经其他治疗的新鲜组织中的TIL细胞对肿瘤的杀伤能力是最强的,一旦接受化疗和放疗,免疫细胞的杀伤能力会被削弱。具体的方法和冻存流程大家可以致电全球肿瘤医生网医学部(4006667998)咨询。
二,攻克血液肿瘤,征伐实体肿瘤!CAR-T疗法突破不断
众所周知,CAR-T在治疗恶性血液学肿瘤方面取得的成果有目共睹,这全都得益于血液肿瘤的肿瘤细胞中的祖传靶点——CD19,此靶点只存在于肿瘤细胞中而不存在于正常细胞中。因此在肿瘤治疗中可以依靠此靶点带领CAR-T细胞找到并消灭癌细胞。如果在实体瘤中找到仅在癌细胞中而不存在于正常细胞中的靶点,就能够定向的攻击实体肿瘤。
医学界一直希望CAR T细胞可以为更多的实体肿瘤开发出新的特异性靶点!此次ASCO大会上“中国造”CAR-T细胞疗法纷纷登上国际舞台,显示出了巨大的潜力,也反映出我们国家的CAR-T疗法科研实力已经毫不逊色美国等国家。
01、完全消除过表达HER2的实体瘤!新一代ARC-T疗法出世
常规的嵌合抗原受体T细胞(CAR-T)疗法在治疗一直缺乏实体瘤特定表达的肿瘤抗原,中国的研究人员对CAR-T治疗进行重新设计,将重新编辑抗原受体复合物T(ARC-T)细胞和新型的靶向肿瘤的可溶性蛋白抗原受体X-接头(sparX),形成新一代ARC-T疗法。
研究人员创建了一个sparX库,该库结合了不同的细胞表面抗原,包括HER2。
体外研究初步表明,表达sparX-HER2的ARC-T细胞实现了对HER2过表达的乳腺癌细胞的选择性杀伤,对表达正常组织影响最小。ARC-T / sparX-HER2的体内原理证明可以完全消除过表达HER2的实体瘤细胞。
02、根除髓母细胞瘤!NKG2D特异性CAR-T疗法未来可期
髓母细胞瘤(MB)是一种恶性脑癌,最常见于幼儿。近年来,人们正在探索嵌合抗原受体T(CAR-T)细胞治疗在脑肿瘤中的潜力,但临床结果有限。据报道,NKG2D配体在髓母细胞中大量表达,因此可以利用NKG2D特异性CAR-T细胞(KD-025)进行治疗。研究人员对种植了随母细胞瘤的小鼠静脉内注射一千万单位的KD-025单次治疗。

结果显示KD-025在小鼠模型中完全清除了随母细胞肿瘤,并且没有明显的毒副作用。我们期待这些研究能尽快开展人体的临床试验。,目前国内已开展多项针对实体肿瘤的CAR-T疗法临床试验,大家可以申请接受这种前沿疗法的治疗。
三,疾病控制率90%!新型TCR-T疗法对多种实体瘤有效
近两年,基于T细胞的免疫疗法取得了前所未有的突破,除了给血液肿瘤提供了”治愈性“疗法的CAR-T,最近各大国际免疫团队对于另外一项基于T细胞的免疫治疗技术-TCR-T的研究应用在实体瘤中也初现曙光。
在刚刚落下帷幕的全球最大肿瘤会议ASCO年会中,一项由美国MD安德森癌症中心公布的新型过继性T细胞疗法,ADP-A2M4的1期试验最新数据引起了轰动。在这项研究中,专门采用针对MAGE-A4癌症抗原的TCR-T技术ADP-A2M4,在多种实体瘤类型,包括滑膜肉瘤,头部肿瘤,宫颈癌和肺癌中均获得了缓解,并且多名患者出现持久反应,这意味着这种新型的基于TCR的新兴技术是未来攻破实体瘤的新希望。
在这项I期临床试验中,共纳入了38名至少接受过三线全身治疗,临床上可以说是没有任何标准治疗方案的极晚期患者,包括恶性程度极高的滑膜肉瘤,卵巢癌,头颈癌,胃癌,粘液样/圆形细胞脂肪肉瘤,非小细胞肺癌,膀胱癌,食道癌和黑色素瘤。
试验结果显示,这些患者在接受ADP-A2M4 T细胞治疗后,产生了强烈的响应。9例患者(23.7%)病情缓解或肿瘤缩小,18例患者(47.4%)病情稳定。

其中,本次试验共入组的16例滑膜肉瘤患者,客观缓解率(ORR)43.8%(7名患者肿瘤缩小),疾病控制率为90%以上(14名患者响应)。

这些患者的中位反应持续时间为28周,中位无进展生存期为20周。

会议上报道了一位67岁的男性晚期滑膜肉瘤患者,MAGE-A4高表达(100% 3),接受9.95*10^9ADP-A2M4 T细胞治疗12周后,最大的肿瘤病灶(155mm)缩小了45%,随着进一步的治疗,肿瘤缩小了71%。

ADP-A2M4疗法用于治疗滑膜肉瘤,已在2019年分别获得FDA授予的再生医学先进疗法称号(RMAT)和治疗软组织肉瘤的孤儿药称号(ODD)。值得振奋的是,基于以上积极数据,该公司预计ADP-A2M4将于2022年在美国上市。
目前,ADP-A2M4的研究正在进行针对MAGE-A4肉瘤的II 期试验,想了解临床招募详情的病友可致电全球肿瘤医生网医学部了解。我们也期待这款疗法能够早日完成临床验证,获批造福更多的患者。
四,有效率44%!NK联合PD-1大显身手
最近研究发现,人体内存在的自然杀伤(NK)细胞也会表达PD-1,并且与免疫检查点抑制剂的抗肿瘤反应相关。那么,将PD-1和NK细胞联合起来治疗效果会不会更好?
这一想法在今年的ASCO上得到了初步证实!NK联合PD-1或将成为晚期肺癌治疗的免疫王炸组合。
SNK01是一种新型的自体NK细胞疗法,具有更强的抗癌效果,已发现对几类肺癌细胞系具有杀伤作用。
一项I / IIa随机研究,评估了SNK01联合PD-1(派姆单抗)在IV期非小细胞肺癌患者中的安全性和有效性,摘要编号3037。
这项研究纳入了20例IV期非小细胞肺癌(PD-L1 +,EGFR-,ALK-),这些患者接受了一线铂类治疗并失败了,随机分配至两组:
A组接受PD-1(派姆单抗)+SNK01治疗(每六周2 x 10⁹或4 x 10⁹个细胞)
B组患者仅接受派姆单抗,在21天周期的第1天注射。

结果显示:
1.联合治疗组的总体缓解率(ORR)为44%,与Keytruda单独治疗的0%相比,明显更高;并且接受最高剂量的NK细胞治疗的患者的ORR可以达到50%;
2.中位无进展生存期(PFS):联合治疗组为8个月,单药治疗组仅为1.6个月;
3.中位总生存期(mOS):联合治疗组尚未达到,单药组为6个月。
4.与单独使用Keytruda的25%3-5级毒性相比,用联合治疗的患者没有与治疗相关的毒性,并且总体生活质量更好。
总结:
虽然这只是一项小型研究,但这些初步结果已经表明,与单独使用基于Pembrolizumab的铂类治疗失败的IV期NSCLC患者相比,Pembrolizumab联合NK细胞治疗非常安全,甚至可以降低PD-1相关的毒性,同时增加总体肿瘤反应。我们期待更大规模的试验数据来证实这些免疫疗法全新的尝试是否能给病友们带来更大生存获益!
免疫肿瘤学的潜力刚刚开始实现,揭开更多的冰山将会更加详细地了解如何控制免疫反应,以及将将这些治疗手段用于临床获得益处。每天我们能看到更多的进展,我们相信这种治疗方法将在未来几年取得重大突破,让我们共同期待。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
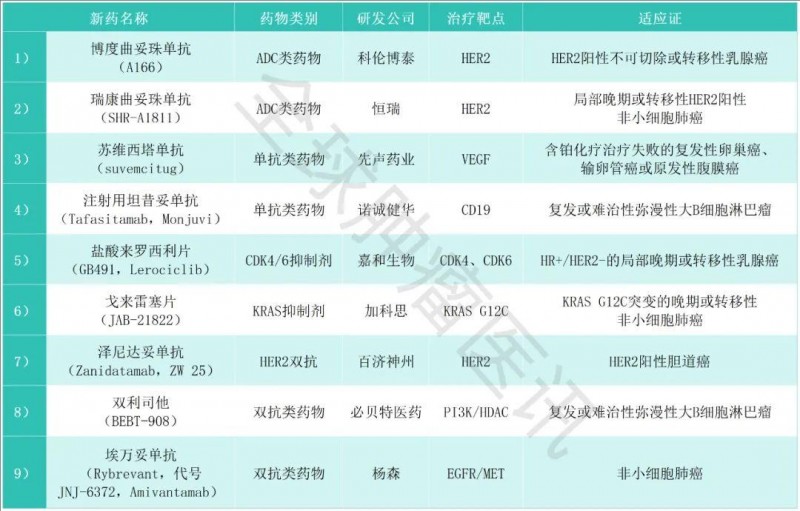
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




