TCR-T疗法再创佳绩,'万癌之王'胰腺癌的治疗新利器使肿瘤消退约72%!
TCR-T疗法治疗胰腺癌使肿瘤消退约72%
胰腺癌(PC)是发生于胰腺的一种恶性肿瘤,是继肺癌、结肠癌之后又一个预后较差、治疗难度较高的癌种,被称为“万癌之王”,虽然目前在放疗、化疗、靶向治疗、手术治疗等方向,取得了一定的进展,但胰腺癌的3年生存率仍<5%,这可能与胰腺癌的“获得性免疫特权”有关。受免疫抑制微环境驱动,胰腺癌患者T细胞浸润较差,突变负荷低,易导致新抗原反应性肿瘤浸润淋巴细胞的缺乏,故对目前的免疫疗法耐药。
近年来,研究人员解锁了胰腺癌的免疫治疗新方法——T细胞受体工程T细胞(TCR-T)疗法,以应对胰腺癌的“热点突变”(如KRAS热点突变)。随着时间的推移,这些TCR转导的T细胞群,在外周血中表现出类似的持久性。
何谓TCR-T疗法
TCR-T(engineered T cell receptor-T cell,TCR-T)疗法是通过基因工程将特异性识别肿瘤抗原的TCR基因序列转移到T细胞中,使其获得介导免疫反应,以及特异性识别并杀死肿瘤细胞,从而达到治疗肿瘤的目的。TCR-T和CAR-T(嵌合抗原受体T细胞)疗法同属于过继性T细胞治疗方式,两者有何差异呢?
CAR-T仅能识别肿瘤表面的抗原,主要用于治疗急性淋巴细胞白血病、多发性骨髓瘤、淋巴瘤等血液系统肿瘤。
而TCR-T不仅能识别肿瘤细胞表面的特异性抗原,还能识别细胞内抗原,这使得TCR-T具有更广谱的靶抗原,故而在实体瘤治疗方面极具潜力。
▲截自《Experimental Hematology & Oncology》
TCR-T疗法有望成为攻克胰腺癌的突破口
近日,国际知名医学杂志《N Engl J Med》报道了一项临床病例。一例71岁转移性胰腺腺癌患者在接受标准治疗和肿瘤浸润淋巴细胞治疗无效后陷入治疗困境。然而,天无绝人之路,2021年5月,该患者的治疗迎来新的转机,经机构审查委员会审查后,他成功接受了靶向KRASG12D的TCR-T治疗。

▲截自《N Engl J Med》
在细胞输注后第21天,患者的绝对中性粒细胞计数恢复;治疗第28天,血小板计数恢复;治疗第1个月,计算机断层扫描显示,患者肺转移病灶消退;治疗后6个月,部分缓解率达72%。
研究显示,KRAS突变在肿瘤中很常见,其中,G12D是KRAS中较为常见的突变,属于单个氨基酸突变,可见于胰腺导管腺癌等多种癌症。
而TCR-T细胞疗法为胰腺癌患者提供了一种新型细胞免疫治疗方法,经过基因工程改造的自体T细胞,能够克隆表达两种异体HLA-C限制性TCR,可尝试治疗携带KRAS G12D突变的胰腺癌患者。
TCR-T疗法——治疗实体瘤的"潜力股"
2022年1月25日,首个获美国食品药品管理局(FDA)批准的TCR-T治疗产品——Kimmtrak(tebentafusp-tebn,IMCgp100)诞生,用于治疗成人无法切除或转移性葡萄膜黑色素瘤。该产品的获批彰显了TCR-T疗法在抗肿瘤方面的强大实力,具有里程碑的意义,至此也开启了TCR-T临床研究的黄金时期。
2021年12月24日,来恩生物医药有限公司(Lion TCR)研发的LioCyx-M004,获得FDA快速通道指定,这是一款用于治疗成人乙肝相关肝细胞癌的T细胞受体工程化T细胞疗法。
LioCyx-M004是一种转基因自体细胞疗法,源自T细胞,这些T细胞经过mRNA编码后,以表达T细胞受体(TCR),从而识别肝癌细胞表面的乙型肝炎表面抗原细胞。
一项关于LioCyx-M004治疗原发性乙肝相关肝细胞癌的1期研究试验结果显示,接受治疗的患者疾病控制率为60%,缓解持续时间为27.7个月,中位总生存期(OS)为33.1个月,且该患者未出现细胞因子释放综合征(CRS)及神经毒性的迹象。
无癌家园TCR-T疗法招募
目前无癌家园正有一款TCR-T疗法的临床试验进行肝癌患者的招募,想要参加的患者可以咨询无癌家园医学部了解详细入排标准。
【主要纳入标准】
1、患有原发性肝细胞癌
2、有慢性乙肝感染史
3、不适合常规治疗或常规治疗无效
4、无肝硬化或仅有代偿性肝硬化
5、未发生肝癌脑转移
截止到2022年10月18日,全球共有710个有关“TCR"的试验,可在美国国立卫生研究院的临床试验数据库(www.clinicaltrials.gov)检索到,这些研究大多针对实体瘤,比如黑色素瘤、肠癌、胃癌、肺癌、胰腺癌等。
胰腺癌治疗不止一种选择
作为一种预后较为凶险的疾病,各国学者一直致力胰腺癌的研究,除了上文提到的TCR-T疗法之外,小编还帮大家汇总了其他较为亮眼的免疫细胞疗法,以供大家参考。
CAR-T疗法
“CAR-T疗法是以T细胞介导的CAR为基础的一种细胞免疫疗法,通过装上CAR(肿瘤嵌合抗原受体)这个定位导航装置,对T细胞进行改造,以识别并杀灭体内特定的肿瘤细胞,实现精准抗癌的目的。与“TCR-T疗法”同属于“过继性T细胞”这一大家族。目前,CAR-T治疗胰腺癌的主要靶点是Claudin 18.2、间皮素(Mesothelin,MSLN)、HER2、CD133、PSCA等,其中,较为热门的是Claudin 18.2、MSLN。
科济药业的一种自体CAR T细胞产品——CT041研究新药(IND),已获国家药品监督管理局(NMPA)批准,用于CLDN18.2阳性胰腺癌(PC)的术后辅助治疗。
一项在美国进行的CT041治疗晚期胃腺癌和胰腺癌的1b期试验结果显示,截止到2022年2月15日,11名患者(5名胃病患者和6名胰腺病患者)接受了CT041治疗,所有患者的ORR均为37.5%(3/8),其中,胃癌亚组的ORR为100%(3/3)。

▲截自《J Clinical Oncology》
目前急招胃癌、胰腺癌、肝癌、结直肠癌、间皮瘤、卵巢癌、B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、非霍奇金淋巴瘤等多个癌种!
想要寻求CAR-T疗法帮助的病友,可将病理报告、治疗经历及出院小结等,提交至无癌家园医学部,进行病情的初步评估!
NK细胞疗法
自然杀伤(NK)细胞是先天免疫系统中的关键淋巴细胞,在癌症免疫治疗和病原体清除方面,表现出快速有效的细胞毒性,无需事先致敏或识别肽抗原,即可直接杀伤肿瘤细胞,有望成为一种更安全、更快速、更便宜的胰腺癌治疗方法。
一项细胞免疫疗法治疗晚期胰腺癌的实验结果显示,该患者在体外使用扩增的活化同种异体淋巴细胞,细胞毒性T淋巴细胞对CD3和CD8呈阳性,NK对CD3和CD56呈阴性,联合化疗与靶向药物治疗,碳水化合物抗原19-9(CA19-9)水平由之前的136U/ml,下降至37U/ml以下,而且病灶明显消退。这项结果也为胰腺癌患者带来了新的希望,小编希望随着研究的不断深入,NK细胞疗法将会为胰腺癌免疫治疗做出更多的贡献。

▲截自《Oncol Lett》
CAR-NK疗法
嵌合抗原受体-自然杀伤细胞(CAR-NK)疗法,是利用基因工程给NK细胞加入一个既能识别肿瘤细胞,同时又能激活NK细胞杀死肿瘤细胞的嵌合抗体。
CAR-NK细胞是“现成的”产品,通过NK细胞受体依赖性和CAR的细胞毒作用,可满足癌症免疫治疗大规模生产的临床需求,并成为转移性恶性肿瘤患者的替代治疗选择。
中国进行了三项关于同种异体ROBO-1-CAR-NK-92细胞免疫疗法,治疗胰腺导管腺癌(PDAC)、表达ROBO-1相关实体瘤的临床试验,I/II期的临床研究结果表明了CAR-NK细胞治疗非血液肿瘤(包括胰腺癌)的可行性。
小编有话说
胰腺癌的恶性程度高、治疗靶点少且分散,而且早期易发生转移,很多患者发现即为晚期,因此也失去了宝贵的手术治疗机会,而且该癌种对放化疗均不敏感,因此导致很多患者的预后不良。
而TCR-T细胞疗法的出现,为胰腺癌患者带来了一丝曙光。TCR-T细胞可识别和靶向缺乏特定表面肿瘤标志物的实体瘤,也可联合放疗、新抗原疫苗等多种治疗手段,未来有望发展成为一种广谱的抗癌手段,逐步实现改善胰腺癌患者生活质量、延长患者生存期的美好愿景!
如果您也想寻求TCR-T细胞疗法及其他国内外治疗新技术帮助,且经济条件允许的情况下,可以先将病理报告和治疗经历提交至无癌家园医学部进行初步评估。
参考资料
[1]Leidner R,et al.Neoantigen T-Cell Receptor Gene Therapy in Pancreatic Cancer. N Engl J Med. 2022 Jun 2;386(22):2112-2119. doi: 10.1056/NEJMoa2119662..
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9531755/
[2]Greenbaum U,et al.Engineered T-cell Receptor T Cells for Cancer Immunotherapy. Cancer Immunol Res. 2021 Nov;9(11):1252-1261. doi: 10.1158/2326-6066.CIR-21-0269.
[3]Zhang Y,et al.TCR engineered T cells for solid tumor immunotherapy. Exp Hematol Oncol. 2022 Jun 20;11(1):38. doi: 10.1186/s40164-022-00291-0.
[4]http://www.china-oncology.com/fileup/1007-3639/PDF/1691647734535-26153295.
[5]https://ascopubs.org/doi/abs/10.1200/JCO.2022.40.16_suppl.2538
[6]Peng X,et al.Application of natural killer cells in pancreatic cancer. Oncol Lett. 2021 Sep;22(3):647. doi: 10.3892/ol.2021.12908. Epub 2021 Jul 8.
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
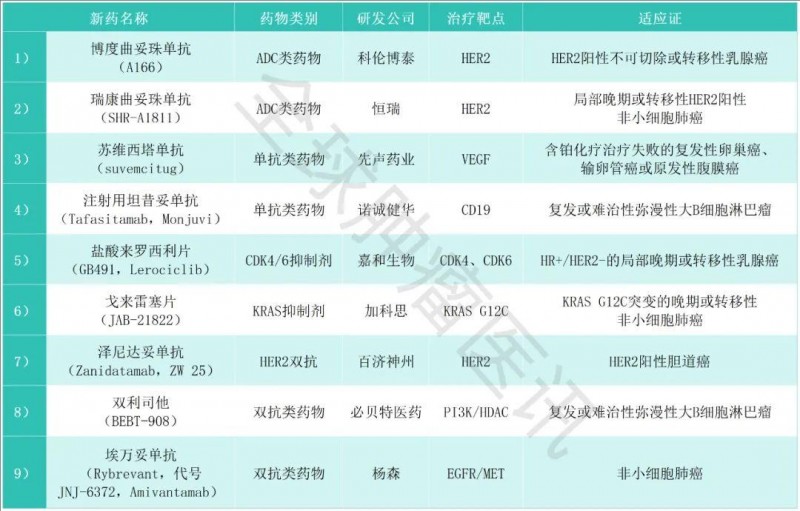
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




