CAR-T竟联手PD-1,免疫新组合疗法首次应用于肺癌,疗效1+1>2!
肺癌免疫联合治疗,CAR-T竟联手PD-1,新免疫组合治疗首次应用于肺癌,疗效1+1>2
近年来,随着免疫精准治疗的发展,如今CAR-T(嵌合抗原受体T细胞)免疫疗法自出现以来已发展至第四代,针对血液肿瘤的靶点已经取得了很多突破性的进展,其中具有代表性的是FDA批准的诺华的Kymriah(淋巴瘤)与吉利德的Yescarta(白血病),而针对于实体瘤的研究却十分有限。其中,非小细胞肺癌的靶标更为有限。
全球肿瘤医生网专家解释道,CAR-T细胞脱靶效应限制了其在实体瘤中发挥作用,且大多数实体瘤缺乏特异的肿瘤抗原且存在肿瘤异质性。因此,获得理想靶抗原是CAR-T细胞在实体瘤中发挥杀伤作用的前提,理想的靶抗原应仅在肿瘤组织中表达,而在正常组织中不表达或者低表达。
针对这一亟待解决的难题,我国的医学研究者们针对CAR-T进行了多种改造,用来治疗非小细胞肺癌。下面小编就如数家珍般地给大家一一介绍这些“出圈”的研究。
PD-1敲除的CAR-T疗法首次用于肺癌
ESMO肿瘤免疫2018年大会上报道了全球首个PD-1敲除的MUC-1 CAR-T治疗晚期非小细胞肺癌初步研究数据,这项研究是由广东药科大学附属第一医院等单位合作开展的。

研究初步结果显示,PD-1敲除的MUC-1 CAR-T治疗安全,可耐受,部分患者肿瘤明显缩小,所有入组患者的症状均有所改善。
【组合免疫疗法1+1>2】
此项研究选择的抗原是MUC-1,研究发现70%以上的非小细胞肺癌患者MUC-1均异常表达,是非小细胞肺癌CAR-T疗法的理想靶点。
研究纳入MUC-1阳性晚期非小细胞肺癌患者,以2.5×10 ∧6/kg的剂量输注抗MUC-1,PD-1敲除的CAR-T细胞超过60分钟。
【研究结果】
ESMO大会报道了6例入组患者的数据,输注CAR-T细胞后的头2周,所有患者的症状均有明显改善,肿瘤显著缩小,其中一例患者肿瘤尺寸由25x19x22mm 缩小到14x10x26mm。安全性方面,没有观察到细胞因子释放综合症(CRS),而且所有患者都没有记录到其他不良反应。
其他CAR-T治疗肺癌的突破进展
1.EGFR为靶点的CAR-T治疗晚期难治性NSCLC
301医院在国内率先开展CAR-T疗法,成果显著。韩为东教授曾报道过利用EGFR为靶点的CAR-T治疗EGFR表达强阳性(EGFR表达超过50%)的晚期难治性的非小细胞肺癌患者。

研究结果显示,其中11例患者疗效可评价:2例患者肿瘤明显缩小,5例疾病稳定。
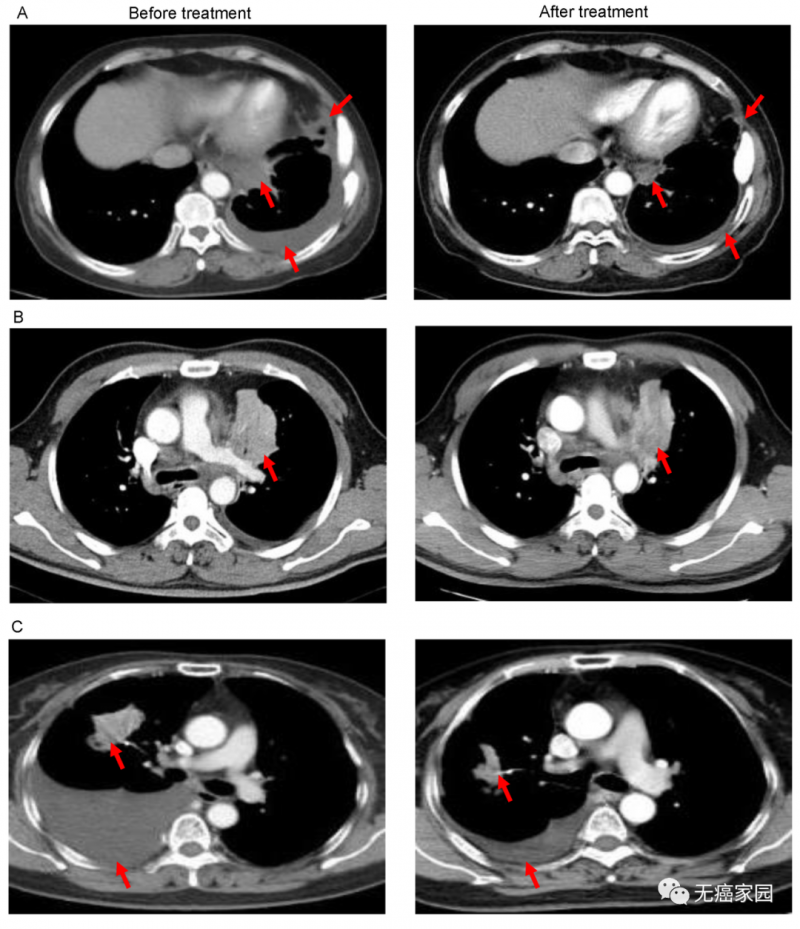
图A中患者1在输注CAR-T细胞后,通过CT扫描显示其胸腔积液减少,转移性肺门淋巴结和胸膜结节轻度缩小(箭头)。
图B中CT图像显示患者8的原发性肿瘤缩小(箭头);图C中CT检查发现CAR-T治疗后患者9的胸腔积液吸收和肺部病变明显消退。
2.CAR LunX T细胞杀伤力倍增,强于CAR CD19 T细胞
这项研究于2020年4月20日刊登于国际权威杂志《Moleculaf Therapy》,是由中国科学技术大学的研究者们牵头进行的。他们为了寻找在非小细胞肺癌(NSCLC)患者中具有高表达的肺癌特异性抗原,构建了人类T细胞来表达特异于LunX的CAR(CAR LunX T细胞),并在NSCLC小鼠模型中评估这些细胞抗NSCLC的功能。
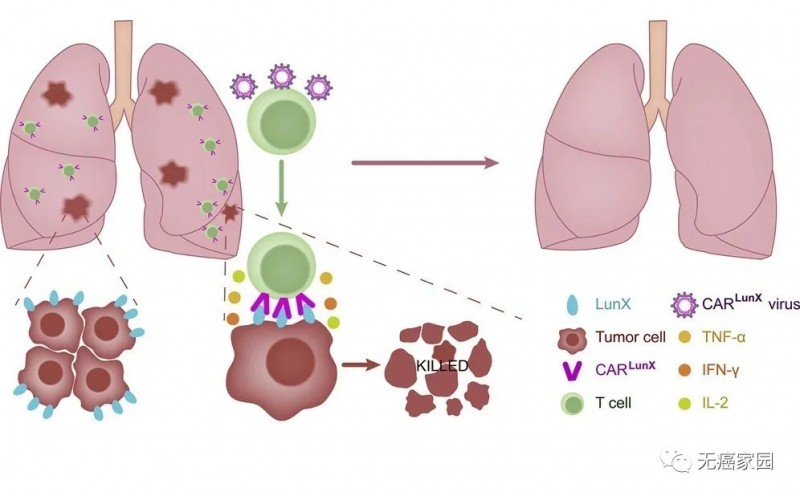
【新发现的肺癌治疗靶点—lunX】
lunX属于PLUNC家族,前期研究发现lunX mRNA可作为肺癌诊断的特异性生物标记物,它仅表达于肺癌组织,而不表达于人的正常肺组织,且lunX与非小细胞肺癌的生长和转移密切相关,所以使用lunX 蛋白作为CAR-T细胞治疗肺癌的靶点具有重要的科学意义和应用价值。
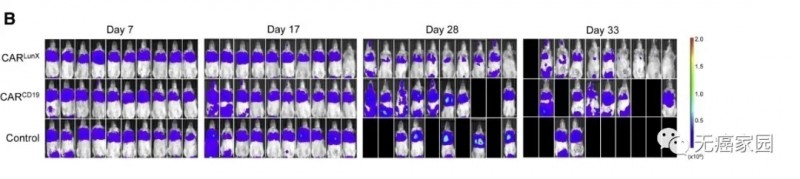
研究人员在建立异种移植模型3天后,小鼠随机分为CAR LunX T,CAR CD19 T和磷酸盐缓冲液(PBS)组,并接受首次输血。经过3个疗程后,腹腔器官在第17天显示出CAR CD19 T细胞和PBS的转移定植,而没有出现CAR LunX T细胞。从第28天到第33天,与在CAR CD19 T细胞组和PBS组中观察到的相比,CAR LunX T细胞可以抑制肺癌细胞的生长并提高存活率(图B)。
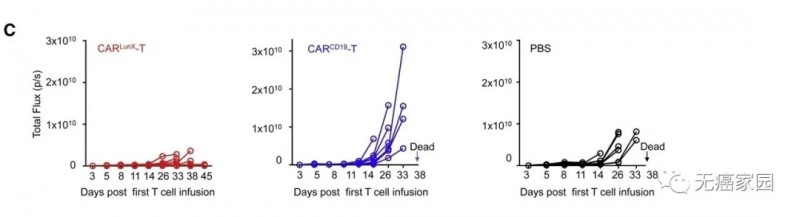
此外,分析三组小鼠的肿瘤动态生长,用CAR LunX T细胞处理的小鼠显示出肿瘤细胞的增殖减少。相比之下,CAR CD19各个小鼠组中的T细胞或PBS不能抑制肿瘤生长,并且小鼠死亡(图C)。
每组肿瘤动态生长的统计分析表明,在整个实验过程中,CAR LunX T细胞抑制肿瘤生长的效果优于其他两组,并且不会引起T细胞自身的毒性(图D)。与对照小鼠相比,用CAR LunX T细胞处理的小鼠的存活率显著提高(P<0.0001)(图E)。
为了研究CAR LunX T细胞是否可以浸润到肿瘤中,研究人员使用EGFP进行了免疫荧光分析以指示CAR T细胞。CAR渗透观察到LunX T细胞,而CAR CD19 T细胞在首次治疗后7天几乎没有浸润到肿瘤中(图F)。
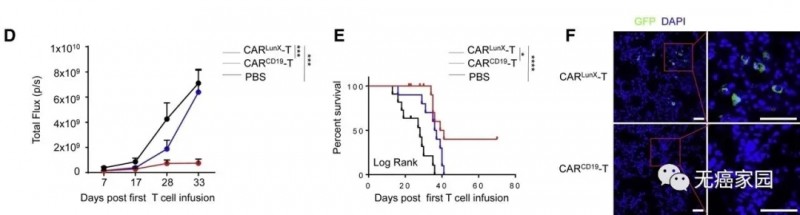
这些结果表明,与CAR CD19 T细胞组和PBS组相比,用CAR LunX T细胞治疗不仅抑制了LunX阳性肿瘤的生长,而且显著提高了小鼠的存活率。
国内CAR-T细胞治疗实体瘤临床研究进行中
除了上述提到的比较突出的研究外,CAR-T治疗肺癌的主要靶点还包括酪氨酸激酶受体EphA2、人类表皮生长因子受体2(HER2)、间皮素(MSLN)等。目前国内正在积极开展实体瘤的CAR-T临床研究。若想若想参加可以咨询全球肿瘤医生网医学部申请参与CAR-T实体肿瘤的临床试验。
【申请流程】
1.材料初审:病理报告,一个月内影像检查资料,近期肝肾功能报告,近期出院小结提交至全球肿瘤医生网医学部;
2.面诊:患者本人携带所有的病例材料前往临床试验招募医院面诊(病例报告、出院小结、影像报告片子);
3.免疫组化检测:检测肿瘤细胞表面抗原EGFR、MUC1和间皮素,有一个为强阳性(高表达)即可申请CAR-T疗法。
小编有话说
近年来,科学家们已经做出了相当大的努力来开发新的方法攻克肺癌等实体瘤的障碍,并采用优化策略用于针对这些特定适应症的CAR-T疗法。我们期待着,越来越多的临床前/临床试验数据能够拼凑出一幅完整的拼图,充分展示CAR-T细胞疗法治疗肺癌等实体瘤的真正实力。
参考文献
1.https://www.cell.com/molecular-therapy-family/oncolytics/fulltext/S2372-7705(20)30058-9#
2.http://engine.scichina.com/publisher/scp/journal/SCLS/59/5/10.1007/s11427-016-5023-8?slug=fulltext
3.https://oncologypro.esmo.org/meeting-resources/esmo-immuno-oncology-congress-2019/phase-i-clinical-trial-of-pd-1-knockout-anti-muc1-car-t-cells-in-the-treatment-of-patients-with-non-small-cell-lung-cancer
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
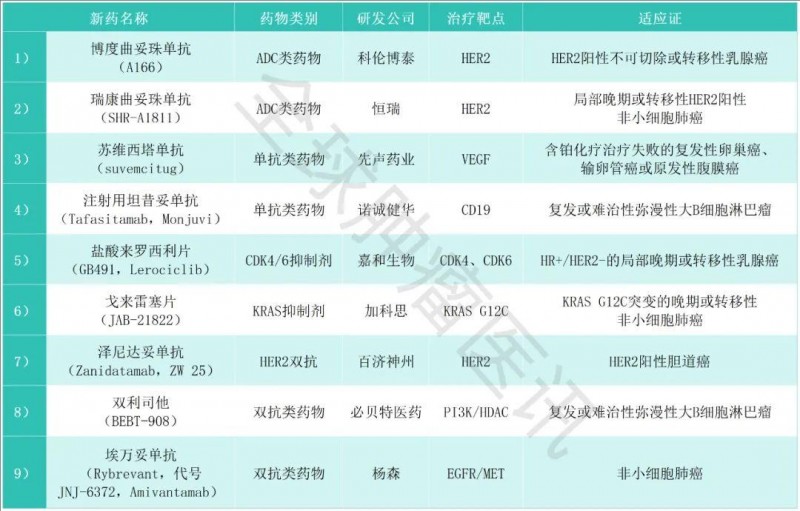
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




