疗效更好还是副作用更少?癌症治疗的这个"两难"问题,也能两全了!
抗体偶联(ADC)药物和双抗药物能很好的兼顾癌症肿瘤治疗中疗效更好和副作用更少的问题
对于大部分癌症患者来说,选择一种治疗方案之前的考量,最主要集中于这么几点:价格能不能承受?有效的概率有多大?效果能维持多久?副作用严不严重?耐药之后还有没有治疗手段?
其中很多问题凑在一起就变成了“两难”,就比如疗效和副作用。很多对癌细胞杀伤性更强的药物,对于正常细胞的影响也越大,导致的副作用越大。
很多情况下,患者被迫放弃了某种治疗,其实并不是因为得不到疗效,而是因为无法耐受严重的副作用。如果副作用带来的新痛苦比起疾病缓解减少的痛苦还多,那么这种治疗的意义又何在呢?
更好的疗效,和更少的副作用,该如何两全呢?
换药,最基本也最有效的处理方式
一位85岁的女性患者,确诊肺腺癌,存在多处脑转移,分期为ⅣB期,同时检测到了ROS1重排阳性。
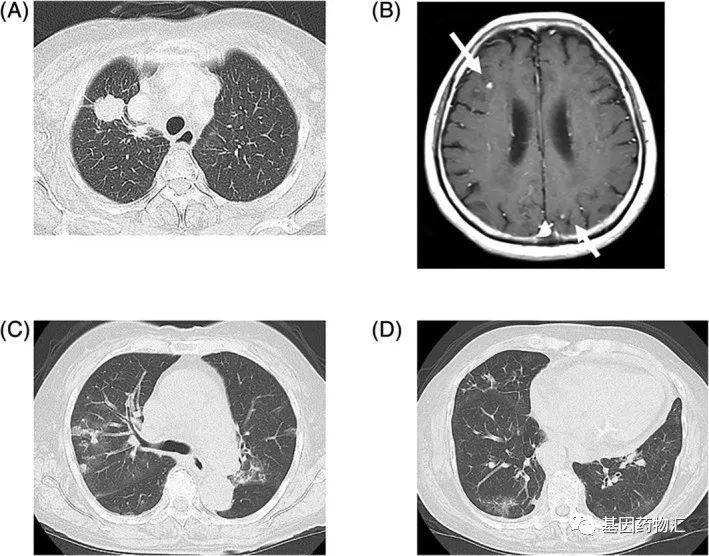
作为一线方案,患者接受了克唑替尼的治疗。疗效很快展现。治疗33天时,患者的原发病灶出现了部分缓解;治疗38天时,在没有接受任何颅脑放疗的情况下,患者的脑转移病灶达到了完全缓解。
但伴随着较好疗效的是严重的不良反应。患者从第8天开始恶心呕吐,至第57天这种不良反应变得难以忍受,患者的用药剂量降低到最初的一半。至第115天,胸部CT检查发现患者因药物治疗出现了间质性肺病。
一方面是克唑替尼带来的出色疗效与脑转移病灶的完全缓解,另一方面是痛苦到难以忍受的副作用。这两者同时存在,患者陷入了两难的境地。
这种时候该怎么办?
如果药物之间的常见副作用有差别,可以在未耐药的情况下换用其它同代药物。考虑到患者还没有发生耐药突变,医生做出了决断——继续为患者使用第一代的ROS1抑制剂,从克唑替尼改为同代的恩曲替尼!
用药28天,患者的病灶持续缩小;至用药6个月以后,患者仍在持续接受治疗,期间没有发生任何的不良事件。
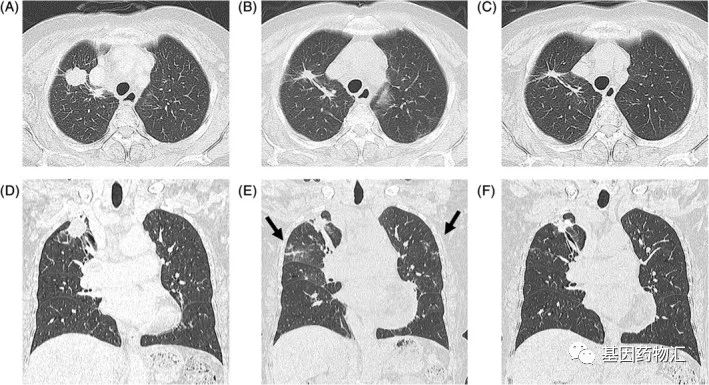
换药这种处理虽然简单,但是要求医生对于各类药物的不良反应有充分的了解,必要的时候,还需要寻求经验更丰富更权威的专家、甚至是外国专家的帮助。
ADC,理论上副作用更少的药物类型
“生物导弹”抗体-药物偶联物,也就是我们所说的ADC,这是一种将靶向性做到了(当前的)极致的药物类型。
与常规的靶向治疗药物不同的是,这类药物在靶向性上额外加了一层“保险”,药物会一直抵达某个特定的环境(即部分特殊的与癌细胞相关物质浓度较高的部位)之后才会被释放出来。
这样的特点使ADC药物具备了更强的靶向性,能够将更高的药物浓度集中于靶部位,一方面提升了对癌细胞的杀伤能力,一方面减少了药物对正常细胞的伤害,在提升疗效的同时降低了副作用。
除了这些明显的优势,一部分曲妥珠单抗耐药的患者都能够从同靶点的ADC的治疗当中获益。甚至于,部分对另一款同为HER2靶点ADC的T-DM1耐药的患者,都从Enhertu的治疗当中获益了。
一名67岁的男性贲门癌患者,伴有淋巴结和肝转移,活检提示低分化腺癌,免疫组织化学(IHC)显示HER2过表达。
患者一线接受了SOX加曲妥珠单抗治疗,6个周期治疗后进展;二线接受了紫杉醇+雷莫芦单抗治疗,三线接受了伊立替康治疗,病情同样进展。
随后患者参加了Enhertu的临床试验(Ⅰ期)作为四线治疗,达到了临床部分缓解,无进展生存期5.6个月,后再次耐药;后续的五线和六线,患者接受了免疫检查点抑制剂方案。
至七线治疗,患者复查IHC时仍然发现了HER2过表达,因此再次尝试了Enhertu的方案。结果显示,接受治疗后,患者的肿瘤再次缩小了!至病例发布时患者仍在接受治疗,病灶没有再次增大,且未出现任何副作用。
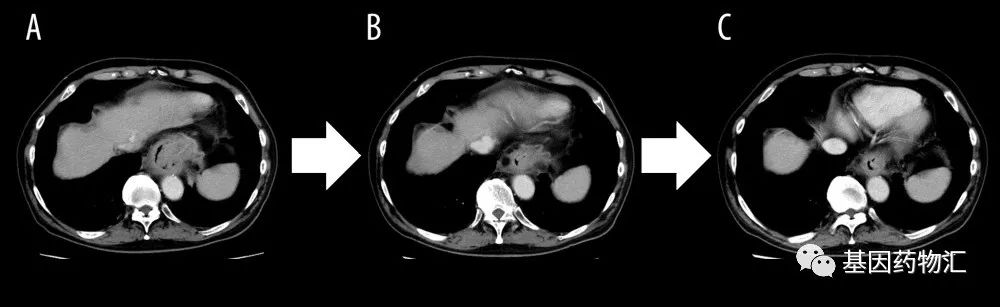
目前为止,HER2还是ADC发展最快、成果最多的靶点。如果大家希望尝试这个靶点的ADC的临床试验项目,可以咨询基因药物汇获取帮助。
双抗,有望超越双免疫方案
不论是化疗、靶向还是免疫检查点抑制剂,目前的癌症治疗方案当中,“联合方案”都已经成为了临床的主流选择。靶向+化疗、靶向+靶向、免疫+化疗、免疫+靶向、免疫+免疫、免疫+靶向+化疗,越来越多的联合用药方案,让癌症治疗的疗效踏上了新的台阶。
但随着临床应用的普及,“双免疫”联合方案的“弱项”也逐渐暴露了出来——在疗效强劲的同时,这一方案的副作用也有些过于强烈。
以经典的“双免疫”治疗方案O+Y方案(纳武单抗+伊匹木单抗)为例,这个用药组合已经“斩获”了七类适应症。但在临床试验当中,尤其是公开发表的患者病例报告讨论当中,医生们更多关注的,则是O+Y方案带来的不良事件的处理。
O+Y方案治疗引发患者心脏骤停、导致患者继发生长障碍性贫血等等案例不胜枚举,即使是通过治疗达到了完全缓解的患者,也可能在治疗过程中经历急性肾损伤等副作用。
从临床试验的数据来说更是如此。在各类癌症的试验当中,双免疫方案治疗发生各类、各级别不良事件的比例,通常都比单免疫方案更高。
在“解锁”了免疫细胞的杀伤能力的情况下,免疫细胞不仅能够强力杀伤癌细胞,还会同等地对健康细胞产生更强的攻击性,进而导致更多、更严重的副作用。
但临床医生们宁愿反复讨论、研究双免疫方案引发的不良事件的处理方式,也不愿意放弃使用这种新兴的治疗方案,正是因为双免疫方案的疗效实在是太好了。
一些对于单免疫药物治疗并不敏感的患者,使用这种“更强力”的方案却能够完全缓解,那么医生自然更愿意为患者选择双免疫方案。但从患者的角度来说,自然是希望疗效与副作用能够“两全”。那么,有没有哪种方案,能够在提升疗效的同时,让副作用更轻、更易于承受一些呢?
此时,一类能够同时作用于两个靶点的药物类型,双特异性抗体即“双抗”,走入了临床。
在靶向治疗中,越来越多的“双抗”甚至“多抗”药物异军突击,包括EGFR难治突变亚型ex20ins的“救星”JNJ-6372在内,许多多靶点的药物发挥出了单靶点药物难以达到的疗效。
在免疫药物当中,同样有一部分免疫检查点抑制剂能够同时作用于两个免疫检查点。这些免疫药物被称为“第二代”的免疫检查点抑制剂,许多研究都已经明确地证实,这类药物的疗效远远超过了单靶点的免疫药物,不良反应又远远少于两药联合的方案的既往数据!
我们以前不久上市的首款国产免疫双抗、也是全球首款获批的PD-1/CTLA-4双免疫检查点抑制剂卡度尼利单抗(商品名:开坦尼,AK104)为例。
这款药物已经获批用于治疗既往接受过含铂化疗失败的复发或转移性宫颈癌患者,根据此前公布的Ⅱ期临床试验数据,卡度尼利单抗治疗的整体缓解率为33.0%,治疗其中PD-L1阳性(CPS≥1)患者的缓解率更是达到了43.8%。
而此前在2020中国肿瘤免疫治疗会议上研究者公布的既往试验数据,Balstilimab+Zalifrelimab的整体缓解率20.6%,O+Y组合(纳武单抗+伊匹木单抗)的整体缓解率23.1%~36.4%,以及PD-1抑制剂Balstilimab单药的11.9%,和派姆单抗单药的14.3%(PD-L1阳性患者)。
“双抗”的优势巨大!
在靶点的组合上,双抗也表现得非常“自由”。如PD-1/CTLA-4这样的双免疫靶点、PD-1/VEGFR的免疫+靶向靶点,还有EGFR/MET这样的双靶向靶点,相关的临床试验都在推动当中。如果大家希望更进一步了解相关的资讯,或了解自己关注的药物是否有临床试验正在招募,也可以咨询基因药物汇医学部获取帮助。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




