肺癌脑转移就走到了生命的尽头?"头"等大事不容含糊!这些治疗脑转移的方法你应该知道
肺癌为什么会脑转移,肺癌脑转移的症状表现有哪些,肺癌脑转移怎么治疗、如何治疗
在非小细胞肺癌当中,大约10%的患者确诊时已经发生了脑转移,另有25%~40%的患者,会逐渐发展为脑转移。脑转移起病隐匿,早期症状可能不明显;但随着疾病进展,会逐渐对患者的生活造成越来越大的影响;直至终末期,甚至会进展为意识障碍、昏迷等。
从生存期上来说,脑转移患者的生存期在各类转移部位的患者当中也是比较差的。如果不能接受系统治疗,患者生存期约为1个月;糖皮质激素治疗约为2个月;接受全脑放疗(WBRT)约为2.4~4.8个月;铂类化疗的中位总生存期约为7.4~10个月。靶向治疗彻底改变了脑转移非小细胞肺癌患者的生存情况,中位无进展生存期延长至6.6~15.2个月,中位总生存期可达到12.9~18.9个月。
脑转移如此常见又如此难治,患者们应该选择哪种方案才更合适呢?这一次,基因药物汇就来和大家谈一谈,非小细胞肺癌的“头”等大事,脑转移。
文章大致分为三个部分:脑转移的发生,脑转移的表现,以及脑转移的治疗。
PART 1、癌细胞为什么能跑到大脑这个位置
癌细胞入脑,意味着这两道屏障被突破!
大多数类型的肿瘤,发生扩散时都会首先转移至肝、骨,以及肺等其它部位,再发生为脑转移;但对于肺癌来说,脑转移却是一种非常常见的发展方向。
这样的表现与肺自身的特点是密不可分的。作为最主要的气体交换器官,肺中含有丰富的血管、尤其是毛细血管。原发于肺的肺癌,癌细胞脱落后很容易进入血管,并随血液向身体各处转移。
可以说,肺的毛细血管床承担着阻止癌细胞向其它组织或器官转移的重担,是阻止癌细胞入脑的第一道屏障。若癌细胞侵袭肺脏、损伤肺内毛细血管管壁,并经由此处进入血液,那么癌症发生其它部位转移的风险也会随之显著提升。而这也是为什么各类癌症通常都会在先发生肺转移后才逐渐发生为脑转移的原因,肺癌原发于肺组织细胞,对于肺脏的侵害更加严重。
而阻止癌细胞入脑的第二道屏障,理论上来说应当是大家常有耳闻的血脑屏障。
血脑屏障指脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障,和由脉络丛形成的血浆与脑脊液之间的屏障。正常情况下,血脑屏障可以阻止各类有害物质进入脑内,也可以将脑内产生的有害或过剩物质排出脑外,是保护脑阻止不受各类损伤的重要结构。
许多治疗癌症的、分子较大的药物,都因为这道血脑屏障而被阻隔在了脑外。那么从理论上来说,体型比这些药物更大的癌细胞,应该也无法穿过血脑屏障才对。
但事实上,血脑屏障也同样是癌细胞侵袭的受害者。对于癌症脑转移的途径,目前有多种理论假说。
1."趁虚而入"和"暴力破拆"
早期的理论曾经猜测为,癌细胞很可能是通过血脑屏障上的细小伤口、或索性破坏血脑屏障创造伤口,来进入脑内的。当然,目前更加深入的研究已经发现了这种假说的不完善之处,并作出了补足。
2."见缝插针"
一篇发布于2018年《自然》杂志上的研究报告中指出,癌细胞能够通过血脑屏障上环绕脊髓的毛细血管进入中枢神经。这种毛细血管的基底膜上存在粘连蛋白,癌细胞能够依靠自身表达的整合素,与这种粘连蛋白结合,顺着毛细血管入侵。
3."远隔转移"
癌细胞及癌栓通过潜伏入动脉、椎静脉、淋巴管,上升或逆行性转移到达硬脑脊膜。癌细胞的侵袭能力,与原发细胞的体积、其在血管内皮的贴壁能力、甚至是细胞表面的电荷性都有一定关系,因此不同原发部位、不同突变类型的癌症,其侵袭及转移的能力各不相同。
除了这三种假说以外,还有很多研究尝试解答癌细胞穿过血脑屏障的渠道与方式。这些理论研究,对于指导药物的研发具有重要的作用——如果能够将癌细胞入脑的方式研究透彻,那么是不是也能够研发出能够提前预防癌细胞转移入脑的药物呢?
因此,脑转移的治疗,最关键的一点就是“入脑性”。不论是通过物理的治疗手段、直接将治疗的目标定位在脑部,还是通过药物治疗、凭借药物的特质将脑部纳入覆盖,都能够达到治疗脑转移病灶的目的。
PART 2、脑转移的症状表现有哪些
肺癌脑转移的表现复杂多样,也可能不够典型。
肺癌脑转移的症状表现很多,但初起病时通常比较隐匿,且容易与其他疾病的症状混淆。很多患者在结束前期治疗,甚至经过多年无复发生活后,很难及时注意到这些症状,导致诊断不及时甚至误诊、漏诊。
因此,提前掌握并重视脑转移的症状,对于患者及患者家属来说非常必要。
肺癌脑转移的常见症状包括头痛(主要因颅内压升高或脑水肿导致,常于清晨、静息状态、咳嗽或紧张时加剧)、呕吐(尤其是喷射样呕吐)、视力障碍或视力下降、精神异常(异常的兴奋、躁动、忧郁、健忘或出现虚构记忆)、单侧肢体感觉异常或无力、幻嗅、偏瘫或踉跄步态、耳鸣或耳聋等。
了解过了脑转移的发生和症状,接下来和基因药物汇一起了解一下,临床上常用的脑转移治疗手段,以及一些比较新兴的脑转移治疗手段吧。
PART 3、脑转移可以如何治疗
不论是局部治疗还是全身治疗,“入脑”都是关键。
临床上对于预防癌细胞入脑的药物确实有一些研究(比如idelalisib),但对于癌症患者来说,最重要的还是如何在已经确诊了脑转移之后进行有效的治疗。
脑转移病灶的治疗方案和各种原发病灶类似,主要依靠局部治疗与全身治疗。
局部治疗(放射治疗)
局部治疗方案包括手术与放疗等。
对于非小细胞肺癌患者,在患者有脑部症状的情况下,如果脑部转移病灶数量较少(≤3个),则可以考虑手术切除方案、局部放疗(立体定向放疗)联合全脑放疗方案;如果脑部转移病灶数量较多(>3个),则基本不考虑手术治疗,主要采用局部放疗联合全脑放疗方案。
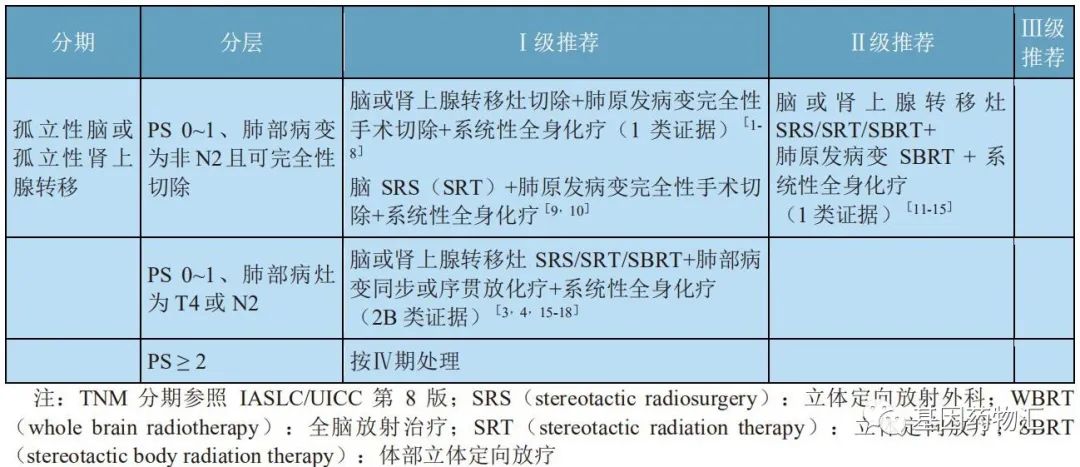
孤立脑或肾上腺转移非小细胞肺癌的治疗
血脑屏障有可能会横亘于药物与病灶之间、阻止药物发挥疗效,而手术和放疗这两种局部方案从外部绕过了血脑屏障,能够直接作用于病灶,达到治疗效果。但这并不意味着仅仅依靠局部治疗就能够完全控制住患者病情。
目前临床上也会使用预防性全脑照射(PCI)来作为脑转移的预防和控制手段,部分研究证实这种治疗方案能够延长患者的无进展生存期,这里我们就不详细说明了。
除了这些写在指南上的常规治疗手段,还有一些比较新兴的手段,或在常规手段之上有一些提升,或可以填补一些尚属空缺的领域,例如质子疗法。
1.质子疗法:从"粒子"提升放疗疗效
质子疗法属于放疗,是一种采用质子束取代目前临床上最常用的光子束(X射线)进行放射治疗的疗法。
质子释放的能量是远远大于普通放疗中所使用的光子的,光子放射的能量为4~18 MeV,质子放射的能量却可以达到70~230 MeV。
除能量强度外,由于粒子的重量不同,两种射线束还具有不同的特性。质子是相对较重的带正电的粒子,它们会在击中目标时停止。而X射线由光子组成,光子是几乎没有质量的粒子,因此它们会一直穿过身体,包括健康的组织。
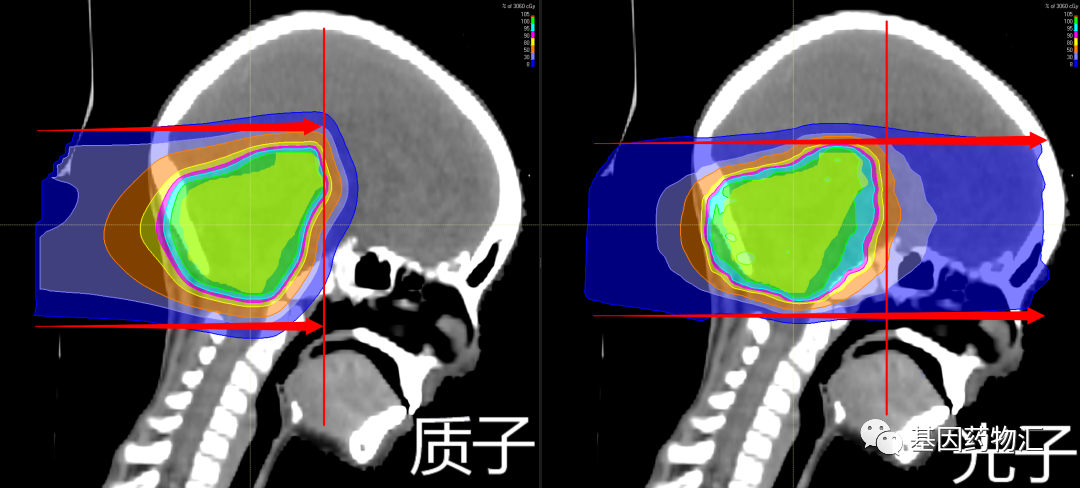
总的来说,质子疗法就像是常规放疗的“硬件升级版”,而三维、适形、调强等手段就像是放疗的“软件升级”。
基于质子和质子束本身的特点,比起传统的光子放疗,质子疗法具有一些独特的优势:放射剂量更集中于病灶部位、不良反应更少、安全性更好、二次肿瘤发生率更低、治疗过程中痛苦更少等等。这些特点都很有利于脑转移病灶的治疗。
2.电场疗法:正在崛起的新"抗癌黑科技"
肿瘤电场疗法,简称电场疗法(Tumor-Treating Fields,TTF),这是一种新的癌症治疗模式,通过在病灶区域输出低强度、中等频率、交变的电场,干扰癌细胞的分裂过程,使癌细胞死亡,达到抗癌的目的,属于一种物理的抗癌手段。
简单来说,电场疗法就是通过一些体外的设备,在我们希望处理的病灶部位创造一个电场,然后通过这个电场,影响癌细胞的分裂过程,让它在某个特定的过程当中停滞、最终死亡的治疗手段。
在癌细胞有丝分裂的过程当中,有一个步骤,细胞内会产生一类名为纺锤体和纺锤丝的结构。此时,细胞的遗传物质已经复制成为了两倍,纺锤体会移向细胞的两端,并通过纺锤丝,牵着这些遗传物质均分成为两份移向细胞两端,以备后续细胞分裂成为两个细胞。
而电场作用的时间正是此时。纺锤丝是有电极性的,一端带正电、一端带负电,正常情况下将在细胞内环境的影响下朝向正确的方向。但在外界电场的作用下,纺锤丝进入了另一个完全不符合分裂期要求的环境里,被迫不断地随着电场掉转方向,无法维持正常结构,最终崩散。而染色体无法正常分离的时候,癌细胞也会走向死亡。
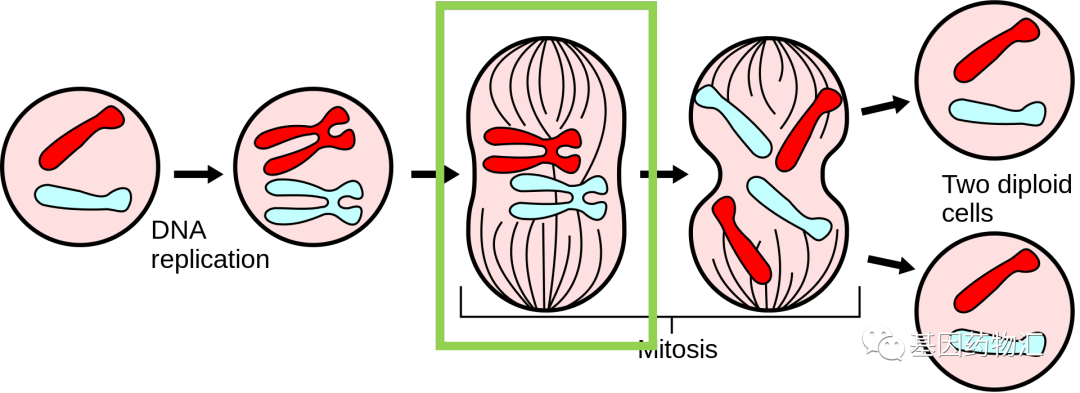
(图片来源:维基百科)
图为细胞有丝分裂过程示意图。绿色方框标记的位置,即电场疗法主要发挥效果的时间段。
基于这样的原理,我们可以分析出电场疗法的十大特点(小汇自己总结的):
第一,电场疗法对于人体正常的、终末分化因此不再分裂分化的健康细胞,基本没有大的影响。
第二,电场疗法针对的是癌细胞“不断分裂增殖”的特点,因此并不像靶向治疗或免疫治疗一样需要基于某些特定的靶点。
第三,越是频繁增殖的癌细胞,受到电场疗法的影响越明显,因此部分类型的癌症使用电场疗法效果更好。
第四,佩戴电场设备的时间越长,对癌细胞的伤害越大。这很好理解,细胞增殖是需要时间、有一定的细胞周期的,患者佩戴的时间越长,覆盖到特定时间的概率也就越大。往极端了说,假如患者佩戴的时间非常短,刚好一个癌细胞都不处于分裂后期,那么电场疗法将无法发挥任何效果。
第五,电场疗法不容易像各类药物一样发生“耐药”,这种物理层面的治疗,癌细胞基本不可能依靠其适应性来“耐受”。
第六,电场疗法不会像手术等方式一样造成创口,是一种无创的治疗手段。
第七,电场疗法也不会像放疗一样在患者体内积累剂量,只要把设备移除或者断电,患者体内的电场就又恢复原样了。
第八,电场疗法对患者的年龄要求会小一些,许多儿童患者,也有机会用。
第九,电场疗法的副作用,主要来源于设备与皮肤长时间接触或贴附而带来的皮肤炎症和不适等。
第十,也是最值得关注的一点是,电场疗法完全有潜力与其它治疗方案联合应用、提升疗效,例如为化疗增敏等,同时不增加毒副作用。
当然,由于“电”这个概念在癌症治疗当中实在是太“时髦”了,很多忽悠人的骗子也编出了许多“用电流/电磁治疗癌症”的谎言,大家在了解或参与的时候一定要做好甄别。
总得来说,什么样的方案是可靠的呢?
FDA批准了、NMPA批准了的,肯定是疗效非常可靠的;FDA或者NMPA批准进行临床试验了的,代表这种方案理论可靠,并且已经在临床前和动物试验当中取得了初步验证。
而信誓旦旦地宣称“只要花钱就保证治愈”的,就肯定是骗子了。
全身治疗
手术、放疗等局部治疗手段仅仅能够处理患者脑内的病灶,如果想要真正有效地控制病情、延长患者生存期,控制患者原发病灶的治疗及全身治疗方案也是必不可少的。
临床常用的全身治疗方案包括化疗、靶向治疗及免疫治疗等。在这几种治疗方案之中,结合疗效与不良反应两方面考虑,靶向治疗的效果显然优于化疗;但并非每位患者都能检出有获批药物的突变靶点,且长期使用靶向药物有发生耐药的风险存在,因此目前化疗也是无可取代的重要治疗手段。
不论是哪种全身治疗方案,首先必须具备的一点是入脑性。在使用了各种“手段”之后癌细胞通过了血脑屏障并在患者的脑内定植,而药物想要进入病灶“追击”癌细胞,同样也需要具备穿过血脑屏障的能力。
部分化疗药物和靶向治疗药物对于脑转移患者的疗效不佳,主要的原因之一在于其分子量较大,被血脑屏障像阻拦“有害物质”一样过滤了出去。
考虑到这样的特点,越来越多的小分子靶向药物将治疗脑转移病灶作为了研究的重点,新药研发取得了丰硕的成果,为脑转移患者的治疗提供了更多的解决方案。
我们先从靶向治疗讲起。
1.EGFR
EGFR抑制剂,“上帝送给中国人的礼物”,重要性自然不必说。
相信很多关注了基因药物汇的读者,都看过我们之前的一篇文章,《20个脑转移病灶5周全部消失!肺癌脑转移=死亡通知书?选对方案,连放疗都不用!》
文中所提到的一个经典案例,就是由第三代EGFR抑制剂奥希替尼所创造的。患者治疗前,颅脑MRI检查提示,她头颅中大大小小的转移病灶数量超过20个。但在接受了仅仅5周的奥希替尼治疗之后,患者颅内的病灶,完全消失!
除了奥希替尼,其它EGFR抑制剂治疗脑转移病灶的疗效也非常出色。第一、二代EGFR抑制剂(吉非替尼、厄洛替尼、阿法替尼等),治疗颅内病灶的缓解率在60%~70%;第三代EGFR抑制剂(奥希替尼、阿美替尼、伏美替尼等),治疗第一二代药物耐药的患者,颅内病灶缓解率仍然高达60%~70%,控制率更是接近100%。
这说明,在某些特殊的情况下(比如患者可能很难耐受放疗,或颅内转移病灶数量过多等),可以考虑先使用药物治疗。如果患者对于药物的响应良好,很可能靶向药物的治疗能够为脑部放疗提供条件,甚至,部分患者有希望直接凭借药物治疗完全消除病灶。
2.ROS1/ALK
ROS1和ALK,非小细胞肺癌的两大“钻石突变”,对于整个治疗过程的价值更加明显。
许多驱动基因突变导致的肺癌,都是脑转移风险比较高的类型。因EGFR突变导致的非小细胞肺癌,发生脑转移的风险高达44%~63%;ROS1或者ALK突变的患者也有约30%~40%的风险。47%的ROS1阳性患者,以及33%的ALK阳性患者,首个、也是唯一一个发生进展的部位,就是脑。
在《三分之一的患者体内,狡猾的癌细胞都在往大脑里“钻”!该怎么治疗?》这篇文章当中,我们列出了几个使用克唑替尼单药治疗,但逐渐发生为脑转移的患者。整体来说,这部分患者接受克唑替尼治疗,除了颅脑病灶以外的其它靶病灶控制都相当不错。但不论是初始存在脑转移的患者还是不存在脑转移的患者,最终癌细胞都会逐渐地向颅脑侵袭——这是一个克唑替尼“够不到”的地方,是这种方案的“致命弱点”,于是癌细胞非常“狡猾”地躲向了这里。
第三代药物劳拉替尼弥补了这一治疗上的“短板”。同时,另一款与克唑替尼同为第一代ROS1/ALK抑制剂的药物,我们熟知的ROS1/NTRK抑制剂恩曲替尼,也为脑转移患者的一线治疗,提供了有价值的解决方案。
临床试验当中,克唑替尼的颅内病灶缓解率大概是百分之十几,恩曲替尼的缓解率却高达79.2%!同时,脑转移患者的缓解持续时间也非常稳定,55%的患者缓解持续超过12个月。
3.MET外显子14跳跃突变
MET外显子14跳跃突变,简称MET ex14跳跃,患者发生脑转移的风险同样不低,大约在20%~40%,基本接近非小细胞肺癌脑转移的平均概率。
这是一个近几年热度正高的突变类型。一方面是因为几款近期上市的新药,让这类突变正式成为治疗性的靶标;另一方面则是庞大的患者需求。
除了作为原发性致癌突变以外,MET突变还可能是EGFR、ROS1等多种靶向药物的耐药突变。
超过20%的EGFR突变型非小细胞肺癌患者因继发的MET异常而产生了耐药。一些研究显示,存在MET 14外显子跳跃突变的细胞,对于奥希替尼的敏感性降低了大约20倍,反馈于治疗当中,疗效自然显著降低,甚至导致耐药。
那么,MET突变的患者,如果发生了脑转移,接受靶向治疗的效果如何呢?
在特泊替尼(Tepotinib)的Ⅱ期VISION研究中显示,脑转移患者的颅内病灶缓解率为71.4%,虽然样本量稍微小了一点,但是当前的数据非常理想!
4.RET
RET同样是近几年热门的靶点之一,几款经典RET抑制剂对于脑转移病灶的治疗效果都比较理想。
其中,塞尔帕替尼(Selpercatinib,LOXO-292)治疗的颅内病灶缓解率高达91%,普雷西替尼(Pralsetinib,BLU-667)的颅内病灶缓解率也有56%。
5.KRAS
关于KRAS突变,大家可以看我们以前的文章《从“不可成药”到“多方围剿”,对抗KRAS突变的那些事儿》。
在KRAS G12C突变的脑转移患者中,Sotorasib(AMG-510)的颅内病灶缓解率为25%。
但靶向治疗也是有一定的应用条件的,也即是“驱动基因突变阳性”。但另一部分驱动基因阴性的患者,治疗选择仍然比较匮乏。
免疫检查点抑制剂治疗的出现为这部分患者带来了全新的生机。一项统计学分析结果显示,PD-1抑制剂单药治疗脑转移的非小细胞肺癌患者,颅内病灶的缓解率为16.4%,控制率45%。这个数字已经不算低,但与靶向治疗动辄60%~70%的超高缓解率相比仍有很大的差距。
这一次,基因药物汇给大家讲一个“组合拳”,跨界“割”王,免疫+放疗。
免疫+放疗,跨界"割"王
免疫检查点抑制剂,以及放疗,这两种方案单独使用,其实都有一点尴尬。放疗虽是清除患者颅内病灶的一把“利刃”,但应用的局限性很强。如果病灶超过5个,那么想用放射线来清除就比较困难了。
而免疫治疗呢,有靶向治疗在前,免疫检查点抑制剂用于颅内病灶的缓解率显得有点不太够高。
但这两种方案的作用机理实在是太有特点,让专家们忍不住提出了一个假设——如果将免疫治疗与放疗联合起来,是否能够将脑转移的疗效,再提升到一个全新的高度?
事实证明,这种假设确实是可行的。
放疗的过程中,放射线会损伤癌细胞(以及同处于放射线范围之内的健康细胞)的DNA,进而导致癌细胞的死亡。目前,越来越多的研究证实,放疗与免疫治疗存在一定的协同作用,也就是说,当这两种疗法共同使用的时候,效果会比单独某一种疗法要更好。
其主要的理论依据,目前最受重视的有两种:放疗的增敏效应和远隔效应。
1、增敏效应
放疗的增敏效应属于药物与射线叠加在一起所产生的生物效应之中的一种。目前,已经确定能够提升放疗敏感性的药物与方案,主要包括高电子亲和力类化合物、氧、中草药,以及热疗等等。
而免疫检查点抑制剂也非常有希望成为众多增敏剂当中的一个。或者换句话来说,目前的研究认为,在恰当的时刻使用免疫治疗,能够与放疗产生非常出色的协同效果。例如在一项刊登于European Urology,由比利时根特大学医院放射治疗部和癌症研究所等多家研究机构共同参与的研究当中,使用派姆单抗联合立体定向放射治疗转移性尿路上皮癌,其中先使用派姆单抗治疗3周、再使用放射疗法治疗的患者整体缓解率为44%,而先使用放疗、1周后再使用派姆单抗的患者缓解率为0。
当然,也有两种方案共同使用并取得成功的试验。例如比较著名的PACIFIC研究,验证了同步放化疗后序贯免疫治疗局部晚期肺癌的效果,患者的中位总生存期长达47.5个月,中位无进展生存期17.2个月;而不使用免疫治疗的患者,中位总生存期仅有29.1个月,中位无进展生存期5.6个月。
2、远隔效应
患者接受了针对局部病灶的放射线照射,靶区之外的病灶、即没有接受过放射线照射的同源病灶,也会在结束治疗后的一段时间之后缩小甚至消失,这种特殊的现象就是放疗的远隔效应。
远隔效应的发生与人体免疫系统的功能密切相关。简单来说,当癌细胞因照射死亡之后,释放出的抗原能够成为人体免疫细胞(尤其是其中树突状细胞,即DC)进一步识别癌细胞的“标志”;而在照射中没有死亡的癌细胞也会发生一些特殊的变化,更容易被免疫细胞(尤其是其中T细胞)识别并攻击,成为免疫细胞“练手”的“活靶子”。
由于这种效应涉及人体的免疫功能以及免疫细胞,因此与免疫治疗存在非常大的协同潜力。试想,一方面采用免疫检查点抑制剂,“解放”免疫细胞的杀伤能力;一方面触发放疗的远隔效应,撕掉癌细胞的伪装;最后得到的疗效,必然会比单用任何一种方案要更加强大。
2015年发表于《柳叶刀》杂志上的研究已经证实了这一点。研究中纳入的41例晚期实体瘤患者接受局部放疗联合免疫治疗之后,多达27%的患者出现了远隔效应,疗效更出色!
试验结果证实,产生了远隔效应的患者,中位总生存期为20.98个月,而没有产生远隔效应的患者,中位总生存期仅有8.33个月,差异非常显著。
总得来说,免疫治疗与放疗的“联手”是非常有研究价值的一个发展方向。目前这一领域相关研究的数量也在增加,不过考虑到这是一种内外科联动的治疗方案,相关研究的数量还是比靶向药物研究的少一些。
不过考虑到这种方案有比较特殊的潜力,有机会尝试的患者,也可以将这种联合方案纳入考虑。
小汇有话说
最后来简单总结一下。
脑转移是肺癌发展到中晚期,最重要的表现与标志之一。考虑到脑这一部位的特殊性,全身治疗+局部治疗是脑转移治疗的基本框架,预防性全脑照射是主要的预防与控制手段,许多经典的案例也证实了这一点。
局部治疗以放疗、手术等为主,一些新兴的治疗手段,例如电场疗法,也有独特的优势;全身治疗以化疗、靶向治疗、免疫治疗等为基础,部分情况下,入脑性极好的靶向治疗药物,甚至能够在不借助放疗的情况下,彻底清除患者脑内的大量病灶。
当然,绝大多数情况下,患者仍然需要同时接受这两类治疗。这种“多学科联合治疗”的思路,能够为患者争取最好的疗效。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
肠癌患者找到"重生密码&quo
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

绝境逆袭!NY-ESO-1 TCR-T疗
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
结直肠癌六大治疗性疫苗重磅集结!最长控瘤
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05








![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




