国药厚积薄发!盘点2021年那些出圈的抗癌新药,覆盖十多个癌种
盘点2021年中国国产抗癌抗肿瘤药物有哪些
众所周知,肿瘤患者的抗癌过程是与时间的赛跑,国际肿瘤新药从在国外上市到国内投入临床使用的“时间差”,直接影响治愈率和生存率,成为很多患者熬不过去的坎儿。通常情况下这些上市的抗癌新药大多远在美国,价格昂贵,被称为“昂贵的国外专利药”。中国只有少数经济条件雄厚的患者能够前往美国接受治疗,而多数癌友们只能望药兴叹,白白错过最佳的药物治疗时机。
据国家癌症中心数据显示,中国以22%的人口占全球癌症新发人数的21.79%以上,对最新抗癌药的需求量巨大。尽管国外新药审批上市正在提速,上市周期长,数量少是现实,与临床需求之间仍存在巨大缺口,国内患者“新药难求”的困境一直存在。

图源摄图网
近几年,随着政府的重视,我国加快了抗癌药入市和研发的步伐,国内抗癌新药的研发速度也呈现井喷状态。2021年,我们惊喜地发现,我国的抗癌新药遍地开花,斩获了不俗的成绩。一些突破性的药物及疗法更是一跃而起,成为备受瞩目的“爆款”,尤其是CAR-T细胞疗法、抗体偶联药物(ADC)、PD-1/L1等。
接下来,无癌家园小编就给各位癌友们盘点下2021年那些出圈的抗癌新药以及有哪些可以参加的临床试验,以供各位参考。
嵌合抗原受体(CAR)T细胞疗法
CAR-T细胞疗法就是嵌合抗原受体T细胞免疫疗法,是目前国际最前沿的肿瘤治疗方法,即从人体血液中提取T细胞,应用基因工程技术将其变身为能识别并消灭肿瘤的CAR-T细胞,再将其输入患者体内。
众所周知,CAR-T疗法改变了血液恶性肿瘤治疗图景,成为近年来最具潜力的肿瘤免疫疗法之一。随着四款靶向CD19的自体CAR-T疗法Kymriah和Yescarta、Tecartus、Breyanzi相继获批上市,靶向BCMA的CAR-T疗法Abecma获批上市,CAR-T的显著疗效逐渐获得业内肯定,也变成众多癌友们非常关注的焦点。
1、爆!终于官宣了!国内首款CAR-T疗法获批上市!
我国CAR-T技术虽然起步晚,但国内市场规模大,就在6月22日,我国CAR-T领域的空白终于被打破!
中国国家药品监督管理局(NMPA)最新公示,复星凯特生物科技有限公司(以下简称 “复星凯特”)靶向 CD19 的 CAR-T 细胞治疗产品阿基仑赛注射液(又称阿基仑赛,FKC876)正式获批上市。
这是中国首个获批上市的CAR-T疗法,全球第6款获批上市的CAR-T疗法。相信紧随其后,中国将迎来CAR-T细胞疗法井喷时代。相关文章:爆!终于官宣了!国内首款CAR-T疗法获批上市!它能为中国患者带来什么?
2、短短1个月,中国第2款、全球第6款CAR-T疗法获批!
9月3日,国家药监管理局最新公示,药明巨诺靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达)已正式获批。瑞基奥仑赛注射液此次获批的适应症为:用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。瑞基奥仑赛注射液是中国第二款获批的CAR-T产品,也是中国首款1类生物制品的CAR-T产品。

距离上次7月30日提交审批,不过才短短1个月左右,可谓是进展神速,可喜可贺!
3、国内第3款CAR-T即将获批!BCMA CAR-T疗法cilta-cel疗效强劲!
传奇生物的靶向BCMA(B细胞成熟抗原)CAR-T疗法西达基奥仑赛(LCAR-B38M/JNJ-4528,下称cilta-cel)也一直备受关注,已经在治疗多发性骨髓瘤的临床试验中表现出卓越的抗癌活性。
此前cilta-cel曾在5月26日被美国FDA授予优先审评资格,然而西达基奥仑赛的审批却遭遇延迟,由2021年11月29日调整至2022年2月28日,相应的,西达基奥仑赛的上市日期也将延迟,据悉此次延迟与产品无关,而是FDA需要更多时间审查公司提交的更新信息。
也就是说,如果一切顺利,cilta-cel将有望成为国内第3款获批上市的CAR-T产品,也是首个靶向BCMA的CAR-T疗法!
cilta-cel是一种研究性B细胞成熟抗原(BCMA)导向的CAR-T疗法,用于治疗复发或难治性多发性骨髓瘤(RRMM)。
在2021年ASH会议上,1b/2期CARTITUDE-1研究(n=97)的最新结果显示,中位22个月的长期随访,客观缓解率(ORR)达到了98%,83%的患者达到严格的完全缓解(sCR),强调随着时间的推移缓解加深(sCR从2020年ASH年会上报告的67%增加到83%)。在18个月时,有66%的患者存活且疾病无进展。在2021年ASCO年会上将要公布的最新研究结果显示,中位随访18个月,总生存(OS)率为81%,缓解率在全部预先指定的亚组和不同治疗线数患者中具有可比性。
4、疾病控制率达78%,国产CAR-T疗法在肝癌领域大展拳脚
今年ASCO年会上我国医学研究者们首次公布了靶向GPC3的CAR-T药物(Ori-CAR-001)治疗复发/难治性肝细胞癌的最新临床研究数据。该研究的初步数据显示,Ori-CAR-001在GPC3阳性复发/难治性患者中表现出良好安全性和有效性。
截至2021年3月10日,共纳入11名接受细胞输注的复发受试者。所有受试者均患有晚期肝细胞癌,并且经过化疗、TACE(肝动脉化疗栓塞术)和靶向治疗均无效。9例可评估受试者中,4例达到部分缓解 (PR),3例达到疾病稳定 (SD),2例出现疾病进展 (PD),客观缓解率为44%,疾病控制率达到78%。
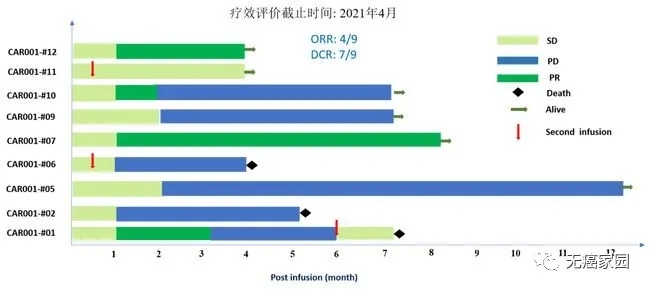
5、CAR-T挑战实体瘤!治疗胃癌及胰腺癌的CT041疗效惊艳
Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,被认为是胃癌和其他癌症类型的潜在治疗靶点。基于此,中国研究人员开发了国际上首个针对 Claudin18.2的CAR-T细胞。
2019年ASCO年会数据
2019 ASCO年会上,CAR-Claudin18.2 T细胞治疗胃癌/胰腺癌的临床数据更新显示,靶向claudin18.2 CAR-T细胞治疗12例转移性腺癌(胃癌7例,胰腺癌5例),未发生严重不良事件、治疗相关死亡或严重神经毒性。
11例评估对象中:1例(胃腺癌)完全缓解;3例(胃腺癌2例胰腺腺癌1例)部分缓解;5例病情稳定;2例病情进展;总客观缓解率为33.3%。
并且,CAR-Claudin18.2 T 细胞治疗胃癌的临床前研究成果显示,靶向Claudin18.2的CAR-T细胞在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
就在9月16~21日召开的欧洲肿瘤内科学会(ESMO)年会上,由科济药业开发的靶向Claudin18.2(CLDN18.2)自体CAR-T候选产品CT041展现了其在消化系统肿瘤中的突出疗效,可谓是大放异彩!
11月15日,CAR-T疗法针对实体瘤领域的进展又迎来喜讯!科济药业公告称,欧洲药品管理局(EMA)已授予自主研发的CAR-T产品CT041优先药物(PRIME)资格。
据美通社报道,11月22日,科济药业自主研发的CT041已获得加拿大卫生部关于临床试验申请的无异议函,这意味着CT041获批进入加拿大临床试验阶段。
截至公告日,CT041为全球唯一靶向CLDN18.2的、且已获得美国食品药品监督管理局、中国国家药监局和加拿大卫生部IND批准、并正在进行临床试验研究的CAR-T细胞免疫治疗方法。
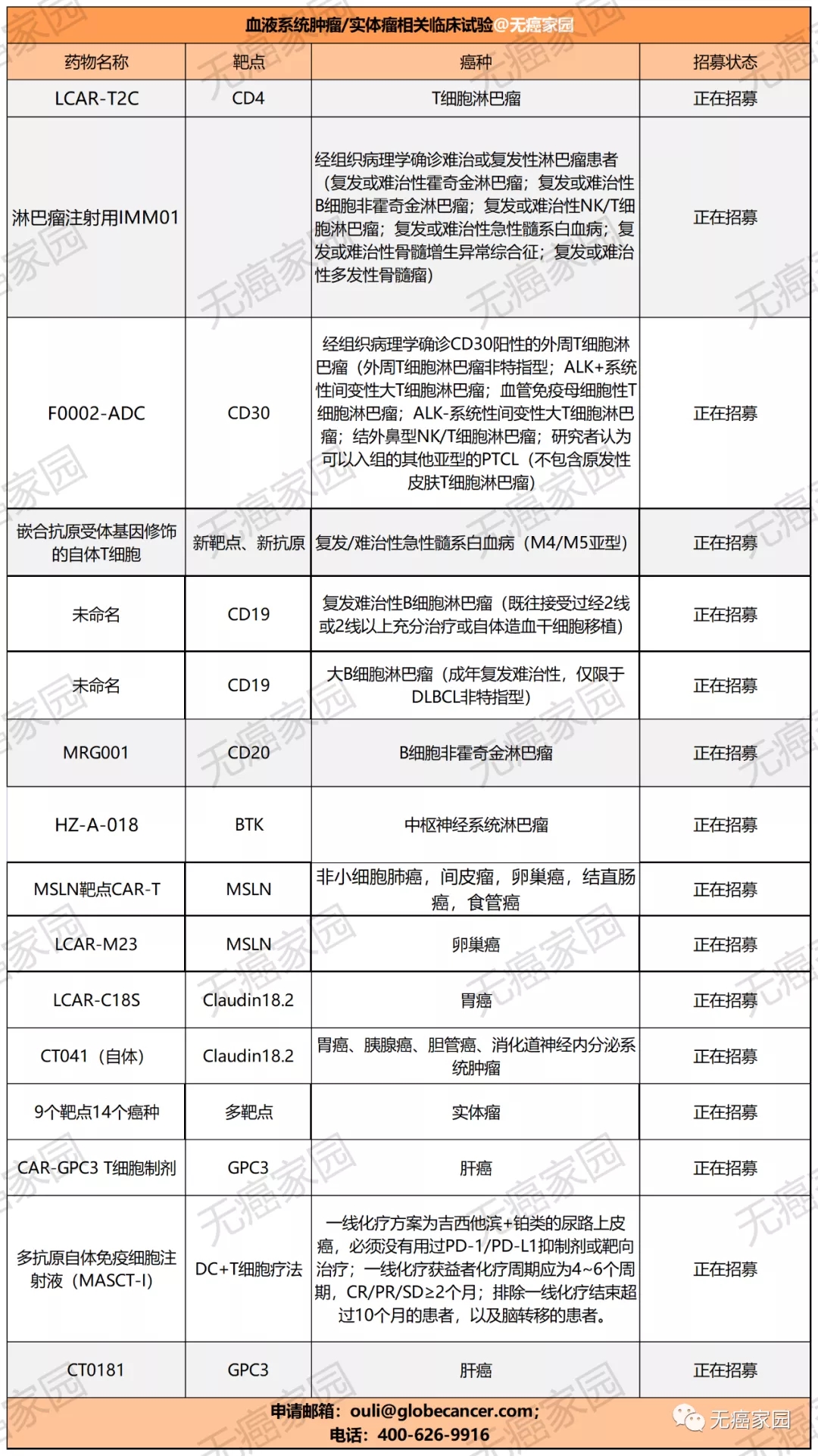
目前,无癌家园有多款血液肿瘤及实体瘤的CAR-T的临床试验正在进行招募,有意向者可咨询医学部具体评估病情!
抗体药物偶联物(ADC)
化疗抗癌,常常是“杀敌一千,自损八百”。抗体药物,能够精准找到肿瘤靶点,但有时候战斗力不足。
要是能给抗体药物上安上化疗药物“弹头”,是不是就能更精准地打击癌细胞了?
基于此,一种被称为“生物导弹”的ADC(抗体药物偶联物)横空出世。
抗体偶联药物就像是生物导弹,由两部分核心功能组成:第一是抗体(导弹体),第二是强化疗药(核弹头);这种设计会使抗体带着化疗药去找肿瘤细胞,然后精准地给肿瘤细胞下毒,毒死它们。这种药物设计结合了靶向药的精准和化疗药的高效,既避免了全身使用化疗药的毒副作用,也比单独使用靶向药具有更强的杀伤能力,一举两得。
目前有100多种ADC正在进行临床试验。大多数ADC已从I期进展到 II 期。一些 ADC 的III期试验显示积极结果;截止2021年9月20日全球目前已有14款上市的ADC药物,治疗领域主要集中在血液瘤和实体瘤方面,并且主要是用于患者的后线治疗,包括晚期、复发/难治性以及转移性的肿瘤适应症。
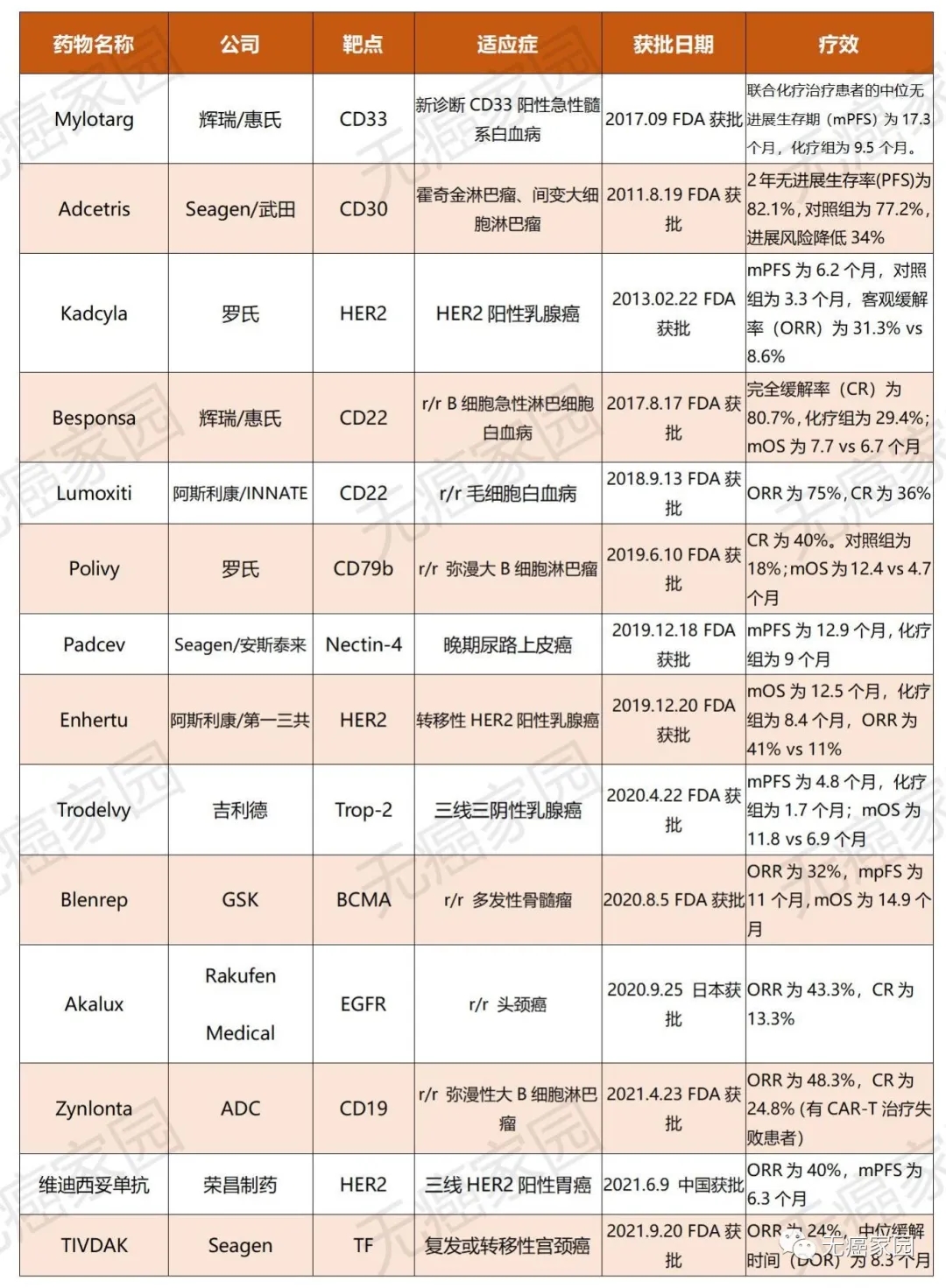
全球已获批14款ADC药物从疗效数据来看,ADC药物给后线患者带了更多的治疗选择和延长生存期的希望,有多款药物的客观缓解率或中位无进展生存期相比化疗提高了一倍。
近年来ADC药物发展迅猛,作为最早获批应用ADC药物的实体瘤,ADC药物在乳腺癌治疗上迅猛发展并占据乳腺癌治疗的半壁江山。
1、维迪西妥单抗纳入医保目录,新适应症获批又上市,中美双重突破性疗法!
维迪西妥单抗(爱地希,RC48)是首个国产靶向HER2的ADC药物,适用于至少接受过2种系统化疗的HER2过表达局部晚期或转移性胃(包括胃食管结合部腺癌)患者的治疗。
维迪西妥单抗展现出优异的疗效:
治疗后的客观缓解率(ORR)为24.4%,疾病控制率(DCR)为42%,中位生存期(OS)为7.6个月。
即治疗后有24.4%的患者病情得到缓解,有42%的患者病情得到控制(病情缓解+稳定),并且有一半的患者生存期都可达到7.6个月。患者生存状况几乎与二线治疗的疗效相当。
基于此研究数据,在今年的6月9日中国国家药监局(NMPA)批准维迪西妥单抗上市,7月2日正式面向全国各医院和DTP药房供药,12月3日便宣布进入2021年国家医保目录,这样的速度谁能不爱呢?
此外,维迪西妥单抗治疗尿路上皮癌的适应症已于2021年6月递交。就在1月5日,荣昌生物宣布,注射用维迪西妥单抗新适应症获得国家药品监督管理局(NMPA)批准上市,用于治疗既往接受过含铂化疗且HER2过表达即免疫组化检查结果为2+或3+的局部晚期或转移性尿路上皮癌患者。
这也标志着尿路上皮癌患者正式迎来首个获得中美两国突破性疗法双重认定的ADC药物,具有重大里程碑意义。
此外该品种还在开展HER2低表达乳腺癌,HER2阳性乳腺癌伴肝转移的注册性临床。
2、疾病控制率100%!FDA授予HER2+乳腺癌新药ARX788快速通道
2021年1月,FDA授予全新抗体偶联药物ARX788快速通道指定,旨在加速这一先进抗癌疗法的上市进程,为一线治疗后进展的晚期HER2阳性乳腺癌患者带来更好的治疗选择。
这项在中国 HER2 阳性乳腺癌1期试验中,客观缓解率高达 74%,其中19 名患者中有14名有响应,疾病控制率高达100%。
在美国和澳大利亚进行的1期HER2阳性泛肿瘤试验中,客观缓解率为67%,3 名患者中有2名有反应,疾病控制率为100%。
目前,全球已启动多项ARX788的临床研究,其中一项针对既往接受过赫赛汀等一线治疗方案失败的HER2阳性乳腺癌患者的临床研究正在招募患者,有意向参加的癌友可联系无癌家园医学部进行初步评估。
3、CD30靶点面面观,F0002-ADC新药一炮而红,挤入淋巴瘤赛道
CD30是肿瘤坏死因子(TNF)受体超家族成员之一,可通过激活不同的信号通路促进细胞增殖或凋亡,2020年,注射用维布妥昔单抗(Adcetris)国内获批上市,CD30声名大噪。
目前国内布局的关于CD30的ADC新药仅有F0002-ADC,这款新药由三部分组成,人鼠嵌合抗CD30单克隆抗体、硫醚连接子(MCC)和DM1,自2016年启动立项以来就身负众望!目前针对复发/难治性CD30阳性外周T细胞淋巴瘤患者正在临床招募中!这对于复发/难治性的外周T细胞淋巴瘤患者来说,又多了一条治疗的新选择!
若癌友们符合以下纳排标准,有意向参加ADC新药试验,可以咨询无癌家园医学部,提交病理报告及治疗经历,详细评估是否符合招募条件!
部分纳入标准:
1)18~70岁,性别不限;
2)经组织病理学确诊CD30阳性的外周T细胞淋巴瘤,包括以下亚型之一均可:
●外周T细胞淋巴瘤非特指型;
●ALK+系统性间变性大T细胞淋巴瘤;
●血管免疫母细胞性T细胞淋巴瘤;
●ALK-系统性间变性大T细胞淋巴瘤;
●结外鼻型NK/T细胞淋巴瘤;
●研究者认为可以入组的其他亚型的PTCL(不包含原发性皮肤T细胞淋巴瘤);
3)至少一次标准治疗失败或目前无有效标准治疗可用的复发/难治性外周T细胞淋巴瘤患者;
4)ECOG体力评分≤1分;
5)CT检查有可测量病灶
部分排除标准:
1)有临床症状的中枢神经系统转移或脑转移;
2)接受过同种异体干细胞移植的患者;
3)曾接受过任何抗CD30抗体药物治疗或CD30细胞免疫治疗者;
靶向药物
1、中国首款MET靶向药获批上市!国药之光赛沃替尼大放异彩!
MET 14外显子跳跃突变在非小细胞肺癌(NSCLC)的发生率为1%~3%,在肺肉瘤样癌(PSC)中的突变率却高达31.8%。MET 14外显子跳跃突变NSCLC对铂类为基础的化疗耐药率较高,因此患者预后也较差。赛沃替尼是中国自主原创的高度选择性口服MET抑制剂,一直有望成为我国首款MET靶向药。没想到这一天终于来临了!
就在6月22日晚间,中国国家药品监督管理局(NMPA)官网显示,和黄医药研发的小分子MET抑制剂赛沃替尼(savolitinib,曾用名:沃利替尼)已在中国获批,这意味着中国迎来了首款获批的选择性MET抑制剂,这也是全球获批的第3款MET抑制剂。
赛沃替尼的此次获批的适应症为间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性的非小细胞肺癌。

目前,包括伯瑞替尼、谷美替尼在内的多款MET抑制剂新药的临床试验均在招募国内患者。
由于药物种类较多,且部分药物尚未公开名称及具体数据,因此大家可以线联系无癌家园医学部进行咨询,由专业医学顾问指导大家进行选择。
2、缓解率高达100%,国产NTRK/ROS1抑制剂AB-106疗效喜人!
ROS1是继靶向药物研发最多的EGFR靶点与疗效惊人的“钻石突变”ALK之后,肺癌患者、尤其是非小细胞肺癌患者应当重点关注的又一重要突变位点。
针对ROS1靶点的已获批药物整体疗效较好,且在研药物种类繁多,患者生存希望比较乐观。目前,多种针对ROS1靶点的靶向药物已经获得FDA批准或NCCN指南推荐,另有多款药物在研,有望在未来投入临床,服务于患者。
一款由国内药企正大天晴药业集团自主研制的ROS1靶点新药TQ-B3101在Ⅰ期试验中展现出了卓越的疗效。在发布于2020 ASCO年会上的数据中,在接受350 mg bid治疗的8例患者中,整体缓解率达到了87.5%;此外,TQ-B3101同样具有通过血脑屏障的能力,在基线有脑转移的8例患者中,整体缓解率达到了62.5%。
基于这项卓越的一期数据,二期临床试验也顺利开展了,由由中国医学科学院肿瘤医院牵头,共28家临床机构参与,由由中国医学科学院肿瘤医院牵头,共28家临床机构参与,目前正在招募患患者。详细的入组标准请咨询无癌家园。
3、喜讯!国内首款RET抑制剂,RET靶向药普拉替尼(Pralsetinib)获批上市
2021年3月23日,中国国家药监局最新公示,由基石药业申报的RET抑制剂普拉替尼(pralsetinib)新药上市申请审评审批状态已更新为“审批完毕-待制证”,这意味着该药已在中国正式获批,适应症为既往接受过含铂化疗的RET基因融合阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。这是国内获批上市的首款RET抑制剂,意义重大!
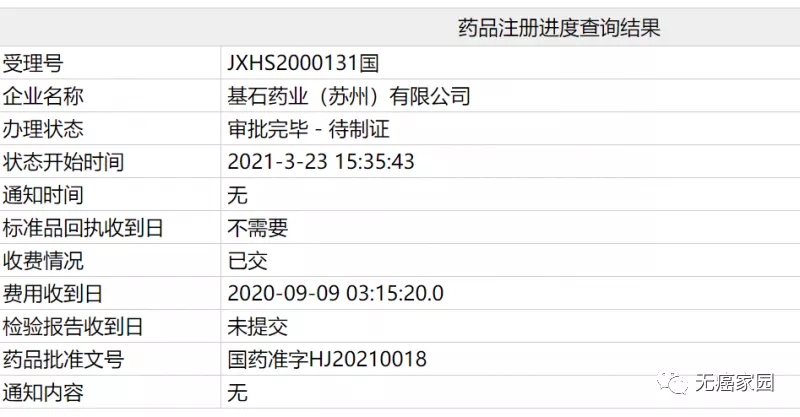
来源:国家药监局官网
目前有一款口服多靶点抑制剂药物HA121-28(对EGFR、RET等靶点均有抑制作用)、我国自主研发1类小分子创新药SY-5007(高活性RET抑制剂)正在临床招募中,适应症均是二线治疗RET融合阳性肺癌患者。想参加临床试验的癌友可以咨询无癌家园医学部,详细评估病情。
免疫治疗药物PD-1/L1
1、给力!信迪利单抗最高降62%!3款国产PD-1均再降!
2022年1月1日起,2021年国家医保药品目录正式开始执行。
根据此前国家医保局公布的消息,与往年相比,2020年医保目录调入药品数量最多,惠及领域最为广泛,其中就包括肿瘤免疫治疗药物PD-1单抗。
目前,国内有8款免疫检查点抑制剂上市。其中有4款是国产PD-1,对患者最直观的冲击就是将PD-1的价格从“用不起”的30万元/年,直接拉到了10万元/年左右。

2019年,具有国际品质的国产创新PD-1抑制剂信迪利单抗注射液率先纳入医保,也是目前价格最低的一款PD-1,降价后的医保价格仅为2843元/支。
2020国家医保目录则将其他三款国产PD-1单抗药物全部纳入。随着2021年3月1日新版医保目录的落地,三款PD-1抗癌药在经过“灵魂砍价”后的降价幅度均在70%以上。
去年入医保最令人震撼的和惊喜的当属,恒瑞医药的艾瑞卡(注射用卡瑞利珠单抗)200mg/支从每支19800降价到2928元/支,不计算慈善赠药的话,降幅达到85%!
卡瑞利珠单抗(Camrelizumab)是我国恒瑞医药自主研发的PD-1单抗隆抗体,且具有自主知识产权。其中有四个获批适应症进入医保,包括复发/难治性霍奇金淋巴瘤(3线)、肝细胞癌(2线)、非鳞状非小细胞肺癌(1线联合)、食管鳞癌(2线)。以上均属于中国高发癌种,可谓在适应症上占尽优势。
以淋巴瘤两周一次的治疗方案,其年治疗费用是7万元左右,稍低于百济神州的年治疗费用。
2022年1月1日开始执行国谈价格
4款PD-1的价格分别为:
●信迪利单抗:1080元(10ml/100mg/瓶);年治疗费用:3.74万/年
●特瑞普利单抗:1912.96元(6ml/240mg/瓶);年治疗费用:3.32万/年
●替雷利珠单抗:1450元(10ml/100mg/瓶);年治疗费用:5.03万/年
●卡瑞利珠单抗:2928元(200mg/瓶);年治疗费用:5.07万/年
非医保PD-(L1)免疫药物价格:
●帕博利珠单抗:17918元(4ml/0.1g/支);年治疗费用:14万/2年
●纳武利尤单抗:9260元/100mg;4591元/40mg;年治疗费用:11万/年
●度伐利尤单抗:18088元/500mg;6066元/120mg
●阿替利珠单抗:32800元/1200mg;年治疗费用:13.12万/年
此次信迪利单抗降价为1080元(10ml/100mg/瓶),之前的医保价格为2843元(10ml:100mg/瓶),降幅为62%!可谓是十分给力!
特瑞普利单抗在2021年特瑞普利单抗进医保后的价格为906.08元一支(规格:80mg);100mg(2.5ml)规格报价为1074.87元/支,240mg(6ml)规格报价为2100.97元/支。此次的1912.96元(6ml/240mg/瓶)以之前相比有小幅降价。
替雷利珠单抗在之前的价格为10688元每支(100mg),2021年进医保后的价格变为:2180元每支。此次定价为1450元(10ml/100mg/瓶),降价幅度为33%。
【无癌家园PD-1相关临床试验招募】
【针对实体瘤】
目前有关于派姆单抗(帕博利珠单抗)针对实体瘤的相关临床试验正在招募,想要参加的患者可以咨询无癌家园医学部了解详细入排标准。
【部分纳入标准】
晚期dMMR/MSI-H实体瘤;除结直肠外,无线数要求;
【部分排除标准】
接受过免疫治疗的(抗PD-1、抗PD-L1、抗PD-L2或任何其他免疫调节mAb)
小编有话说
除了上述比较出圈的抗癌新药外,2021年肺癌、胆管癌及其他实体瘤靶向治疗又引起新一波的关注,有钻石靶点NTRK,热门靶点EGFR、MET、RET、ROS1、ALK,罕见靶点KRAS、FGFR等,众多备受癌友们关注的靶向药如雨后春笋般不断涌现,让无数癌友重新点燃生的希望。
另外,无癌家园的小编告诫各位癌友:对于不同基因突变或不同类型的癌症,都有不同的规范化的治疗方案。如果早期治疗,可以达到很好的疗效。对于晚期的患者,也同样应该接受规范化的正规治疗,这样不仅可以延长生命,而且还可以达到提高生活质量的目的。
所以,当癌友们确诊为是恶性肿瘤后,一定要带上所有的检查结果,去肿瘤专科医院进行会诊,请肿瘤科专家给出适合自己的治疗方案,这样才不会耽误您的病情。最后祝愿每位患者都能够早日康复,重新拥抱健康!
如果您对于目前的治疗方案有疑问,或者想要咨询更合适的治疗方案,请联系无癌家园医学部申请国际会诊。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




