2020最新获批的PD-1/L1疗法汇总(囊括13类癌症)
肿瘤免疫治疗法,2020年最新获批的癌症肿瘤免疫治疗药物(PD-1/PD-L1)疗法汇总(囊括13类癌症)
免疫疗法是攻克癌症的希望,通过激活人体自身的免疫系统攻击癌症的方式已被证实可以用于所有的实体肿瘤,其中,PD-1/PD-L1免疫疗法(immunotherapy)无疑是最大赢家,这种旨在充分利用人体自身的免疫系统抵御、抗击癌症,通过阻断PD-1/PD-L1信号通路使癌细胞死亡的抗癌新方式,已经先后斩获了包括肺癌,胃肠道肿瘤,乳腺癌,泌尿系统肿瘤,皮肤癌,淋巴瘤等在内的近20大实体肿瘤,实质性的改善了晚期肿瘤患者的生存期,成为肿瘤患者的“特效”药物,让医学界和病友们都切切实实的看到了免疫治疗时代给晚期肿瘤治疗带来的彻底变革!
在即将过去的2020年,PD-1/L1疗法又获批了众多适应症,涉及到13类癌症,全球肿瘤医生网医学部为大家整理了截至2020年12月最新获批的PD-1/L1疗法,同时附上各类癌症2020版CSCO免疫检查点抑制剂临床应用指南供大家参考。
膀胱癌免疫治疗药物
2020年1月8日,美国食品药品监督管理局(FDA)批准pembrolizumab(KEYTRUDA,Merck&Co. Inc.)用于治疗特定高风险非肌肉浸润性膀胱癌(NMIBC)患者。这些患者携带原位癌(CIS),对卡介苗(BCG)疗法没有响应,不愿或不能接受膀胱切除术。这是获批治疗这类患者的首款PD-1抑制剂。

试验结果表明,在96名对BCG无响应的高危患者中,Keytruda达到41%的完全缓解率(95% CI:31,51),达到完全缓解的患者中,中位缓解持续时间为16.2个月。46%的患者完全缓解时间超过12个月。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 一线治疗 | 帕博利珠单抗、阿替利珠单抗 | ||
| 二线或三线以后的治疗 | 帕博利珠单抗 | 阿替利珠单抗、纳武利尤单抗、度伐利尤单抗、阿维鲁单抗 |
肝癌免疫治疗药物
1、O+Y获批肝细胞癌
2020年3月10日,FDA批准将nivolumab与ipilimumab联合使用来治疗肝细胞癌患者,在I / II期临床试验中显示该药物可使33%的标准治疗失败的患者肿瘤缩小。
2、阿特珠单抗联合贝伐单抗获批肝细胞癌
2020年5月,FDA批准atezolizumab联合贝伐单抗(Avastin)治疗无法通过手术的转移性肝细胞癌初始治疗方法。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 分型 | 一级推荐 | 二级推荐 | 三级推荐 |
| 一线治疗 | 肝功能良好 | 阿替利珠单抗联合贝伐单抗 | 伦伐替尼联合帕博利珠单抗或纳武利尤单抗 | |
| 一线治疗 | HBV DNA<500IU/ml | 阿替利珠单抗联合贝伐单抗 | 奥沙利铂为主的化疗联合卡瑞丽珠单抗 | |
| 一线治疗 | ECOG PS 0-1 | 阿替利珠单抗联合贝伐单抗 | 阿帕替尼联合卡瑞丽珠单抗 | |
| 二线治疗 | 肝功能良好 | 纳武利尤单抗 | 既往使用过索拉菲尼:卡瑞丽珠单抗联合FOLFOX4 | 纳武利尤单抗联合伊匹单抗 |
| 二线治疗 | HBV DNA<500IU/ml | 帕博利珠单抗 | 既往使用过FOLFOX4:卡瑞丽珠单抗联合阿帕替尼 | 纳武利尤单抗联合伊匹单抗 |
| 二线治疗 | ECOG PS 0-1 | 卡瑞丽珠单抗 | 既往使用过FOLFOX4:卡瑞丽珠单抗联合阿帕替尼 | 纳武利尤单抗联合伊匹单抗 |
小细胞肺癌免疫治疗药物
2020年3月,FDA批准durvalumab联合依托泊苷和卡铂/顺铂联合用于某些晚期SCLC患者的初始治疗。该批准基于III期临床试验的结果,该结果表明在标准细胞毒性化学疗法中添加durvalumab可以改善总体生存率。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 一线治疗 | 阿替利珠单抗+依托泊苷/卡铂 | 度伐利尤单抗+依托泊苷/卡铂 | |
| 二线或三线后的治疗 | 纳武利尤单抗、帕博利珠单抗 |
非小细胞肺癌免疫治疗药物
2020年5月15日,FDA批准将nivolumab与ipilimumab联合使用治疗PD-L1阳性(≥1%)的非小细胞肺癌。
2020版CSCO免疫检查点抑制剂临床应用指南:
无基因突变的非鳞状非小细胞肺癌
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 四期一线治疗 | 帕博利珠单抗(TPS≥1%) | 阿替利珠单抗联合紫杉醇+卡铂+贝伐单抗 | |
| 四期一线治疗 | 帕博利珠单抗+培美曲塞+铂类 | 阿替利珠单抗+白蛋白紫杉醇+卡铂 | |
| 四期一线治疗 | 卡瑞丽珠单抗联合培美曲塞和卡铂 | ||
| 晚期二线治疗 | 纳武利尤单抗 | 帕博利珠单抗(TPS≥1%)、阿替利珠单抗 | |
| 局部晚期巩固治疗 | 同步放化疗后使用度伐利尤单抗 |
鳞状非小细胞肺癌
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 晚期一线治疗 | 帕博利珠单抗(TPS≥1%) | ||
| 晚期一线治疗 | 帕博利珠单抗联合紫杉醇/白蛋白紫杉醇和铂类 | ||
| 晚期二线治疗 | 纳武利尤单抗 | 帕博利珠单抗(TPS≥1%)、阿替利珠单抗 | |
| 局部晚期巩固治疗 | 同步放化疗后使用度伐利尤单抗 |
食管癌免疫治疗药物
2020年6月10日,FDA批准nivolumab治疗化疗后进展的食管鳞状细胞癌的晚期复发性或转移性成人患者。该批准基于III期临床试验的结果,其中表明与标准化疗相比,nivolumab改善了总生存期。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 一线推荐 | 二线推荐 | 三级推荐 |
| 一线治疗 | |||
| 二线治疗 | 卡瑞丽珠单抗、帕博利珠单抗 | 纳武利尤单抗 | |
| 后线治疗 |
TMB-H实体瘤免疫治疗药物
2020年6月16日,FDA批准pembrolizumab治疗具有高组织肿瘤突变负荷(TMB-H)≥10个突变/兆碱基(使用FDA指定的检测)的无法切除或转移性实体瘤的成年和儿科患者。批准是基于来自II期临床试验的数据,使用pembrolizumab治疗可使30%的具有不可切除或转移性肿瘤缩小。
皮肤癌免疫治疗药物
2020年6月24日,FDA批准pembrolizumab用于皮肤鳞状细胞癌治疗,此次批准是基于一项II期临床试验的结果,该研究表明,接受免疫治疗的患者中有34%的患者肿瘤完全或部分缩小。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 类别 | 一级推荐 | 二级推荐 | 三级推荐 |
| 转移性或复发性默克尔细胞癌 | 阿维鲁单抗(Avelumab) | 帕博利珠单抗、纳武利尤单抗 | |
| 皮肤鳞癌 | 西米单抗(Cemiplimab) | 帕博利珠单抗、纳武利尤单抗 |
MSI-H结直肠癌免疫治疗药物
2020年6月29日,FDA批准使用派姆单抗(KEYTRUDA,Merck&Co.)作为一线治疗不可切除或转移性微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)大肠癌的患者,该批准基于II期临床试验的结果,该结果表明,与接受标准治疗的患者相比,接受pembrolizumab的患者疾病进展之前的时间几乎翻了一番。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 一线治疗(无论RAS或BRAF状态,无法化疗的晚期患者) | 帕博利珠单抗或纳武利尤单抗(限MSI-H或dMMR患者) | ||
| 二线姑息治疗(无论RAS或BRAF状态和一线治疗放哪) | 帕博利珠单抗或纳武利尤单抗(限MSI-H或dMMR患者) | ||
| 三线姑息治疗(无论RAS或BRAF状态和一、二线治疗方案) | 帕博利珠单抗或纳武利尤单抗(限MSI-H或dMMR患者) |
尿路上皮癌免疫治疗药物
2020年6月30日,FDA批准avelumab(BAVENCIO)用于接受一线含铂化疗,病情尚未进展的局部晚期或转移性尿路上皮癌(UC)维持治疗。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 一线治疗 | 帕博利珠单抗、阿替利珠单抗 | ||
| 二线或三线以后的治疗 | 帕博利珠单抗 | 阿替利珠单抗、纳武利尤单抗、度伐利尤单抗、阿维鲁单抗 |
黑色素瘤免疫治疗药物
2020年7月30日,FDA批准atezolizumab联合cobimetinib(Cotellic)和vemurafenib(Zelboraf)治疗BRAF V600阳性的黑色素瘤。批准是基于一项III期临床试验的结果,该研究表明,将atezolizumab添加到cobimetinib和vemurafenib中会显着增加疾病进展的时间。
2020版CSCO免疫检查点抑制剂临床应用指南:
皮肤/肢端黑色素瘤
| 分型 | 一级推荐 | 二级推荐 | 三级推荐 |
| 三期可切除黑色素瘤术后辅助治疗 | 帕博利珠单抗1年 | 特瑞普利单抗1年 | 纳武利尤单抗1年 |
| 四期单个转移病灶或多个转移病灶可完全切除 | 帕博利珠单抗1年 | 特瑞普利单抗1年 | 纳武利尤单抗1年 |
| 晚期一线 | 帕博利珠单抗 | 特瑞普利单抗 | 纳武利尤单抗 |
| 晚期二线 | 一线未接受PD-1治疗,二线推荐帕博利珠单抗 | 纳武利尤单抗 |
粘膜黑色素瘤
| 分型 | 一级推荐 | 二级推荐 | 三级推荐 |
| 晚期 | 特瑞普利单抗+阿西替尼 | 帕博利珠单抗、特瑞普利单抗 |
间皮瘤免疫治疗药物
2020年10月2日,FDA批准了将nivolumab(OPDIVO,Bristol-Myers Squibb Co.)与ipilimumab(YERVOY,Bristol-Myers Squibb Co.)联合用于成人不可切除的恶性胸膜间皮瘤患者。
淋巴瘤免疫治疗药物
2020年10月14日,FDA扩大了派姆单抗(KEYTRUDA®,Merck Sharp&Dohme Corp.)的批准,用于以下适应症:
成人复发或难治性经典霍奇金淋巴瘤(cHL)和患有难治性cHL的儿童患者,或在2线或以上治疗后复发的cHL。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 疾病名称 | 一级推荐 | 二级推荐 | 三级推荐 |
| 经典型霍奇金淋巴瘤 | 信迪力单抗 | 纳武利尤单抗 | 卡瑞丽珠单抗+地西他滨 |
| 经典型霍奇金淋巴瘤 | 卡瑞丽珠单抗、替雷利珠单抗 | 帕博利珠单抗 | |
| 原发性纵膈大B细胞瘤 | 帕博利珠单抗 |
三阴乳腺癌免疫治疗药物
2020年11月13日,FDA加快批准pembrolizumab(KEYTRUDA,Merck&Co.)联合化疗,用于治疗肿瘤表达PD-L1(CPS≥10)的局部复发性不可切除或转移性三阴性乳腺癌(TNBC)患者)。
2020版CSCO免疫检查点抑制剂临床应用指南:
| 治疗线数 | 一级推荐 | 二级推荐 | 三级推荐 |
| 一线治疗 | PS 0-1分,PD-L1阳性的晚期三阴性乳腺癌:阿替利珠单抗+白蛋白紫杉醇 | ||
| 二线或三线以后治疗 | |||
| 新辅助治疗,辅助治疗 | PS 0-1分的三阴性乳腺癌,手术前4个周期紫杉醇+卡铂+帕博利珠单抗序贯4个周期,多柔比星/表柔比星+环磷酰胺+帕博利珠单抗新辅助治疗,手术后9个周期帕博利珠单抗辅助治疗 |
免疫治疗崛起!全球新一代PD-1/L1药物百花齐放
目前全球已经获批上市了十款PD-1/L1,除此之外,针对PD-1 / PD-L1途径的几十种新一代免疫检查点抑制剂正在火热开发中,见表一。

根据最近的一项分析,截至2019年9月,全球近3000项PD-1 / PD-L1抑制剂临床试验正在招募,超过50万患者登记。值得振奋的是,近两年,我国的生物技术公司在该领域也非常活跃。除了来自国际制药公司的药物外,中国监管机构还批准了4种在国内开发的PD-1抑制剂,还有4-8种和其他几种新疗法正在后期临床测试中。
希望免疫治疗能够取得更加辉煌的战绩,也希望我们国产的抗癌药能尽快赶超美国,有更多价格亲民的抗癌好药造福更多的患者。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
253例真实世界研究证实:益生菌联合IC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
打一针激活抗癌免疫!肝癌治疗性疫苗大盘点
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
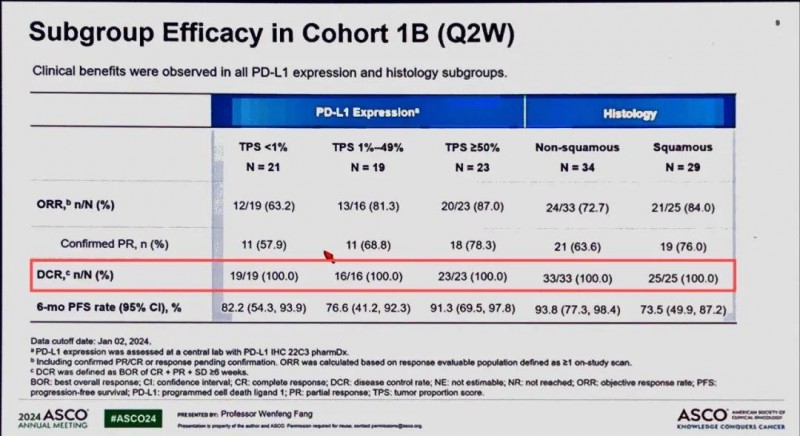
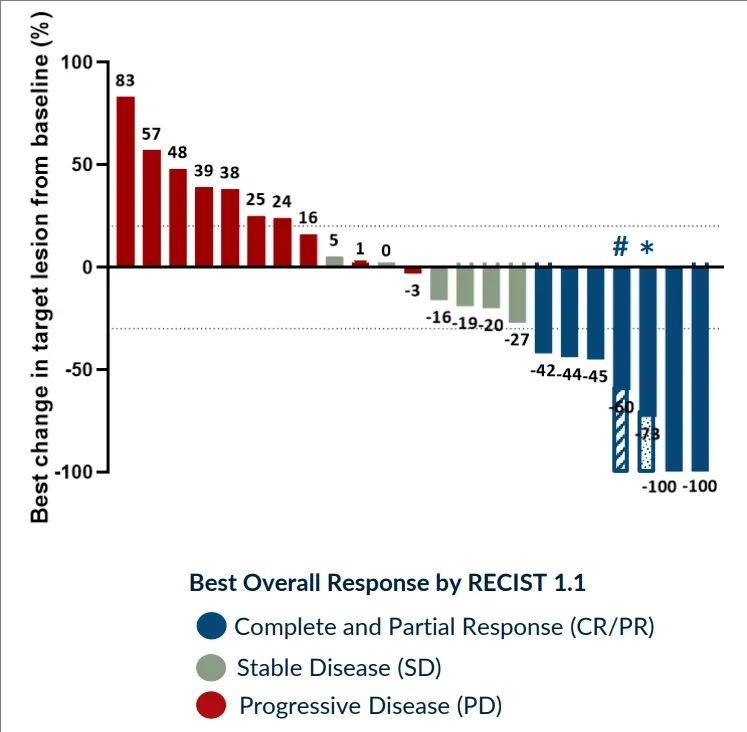
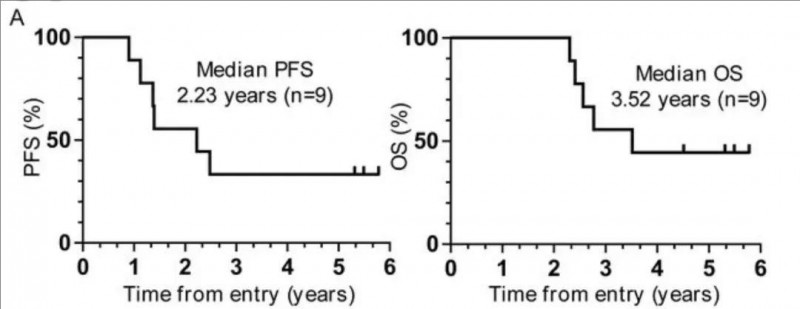
疾病控制率高达100%!2025奥希耐药
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【mRNA癌症疫苗免费招募】Vx-001
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

肝癌"黄金拍档"再发
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
胰腺癌治疗性疫苗大盘点!最长OS超3年,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




