2021展望,肺癌重磅新药抢先看!
展望2021年肺癌新药,小细胞肺癌新药,非小细胞肺癌新药抢先看
2020年将尽,在崭新的2021年即将开启之际,全球肿瘤医生网-基因药物汇为大家盘点了在过去一年当中,肺癌(包括非小细胞肺癌和小细胞肺癌)领域获得快速审批或快速审核资格、并有望在2021年正式走入临床的几款重点药物。希望病友们能够带着更多的希望和期待,迈入全新的一年。
非小细胞肺癌新药
非小细胞肺癌的各类药物更新都非常迅速,靶向和免疫治疗的新方案显著提升了晚期非小细胞肺癌患者的生存时间,使晚期转移性肺癌患者的中位生存期提升至23~27个月,5年生存率可达14.6%以上。
仅仅在2020年底进入优先审批、预计将在2021年初获批的药物中,就有两款值得重视的重磅新药。
01、MET:特普替尼进入优先审查,疾病控制率65.7%
特普替尼(Tepmetko®,Tepotinib)是全球首款获批的MET抑制剂,最早于2020年3月25日获得日本厚生劳动省批准,并在日本上市。2020年8月26日,FDA授予特普替尼优先审查资格,用于治疗MET 14外显子跳跃突变(MET ex14)的转移性非小细胞肺癌患者。
作为一款MET ex14的靶向药物,特普替尼在临床试验中展现出了非常出色的疗效,客观缓解率46.5%,疾病控制率65.7%,中位缓解持续时间11.1个月。
在此前,特普替尼曾被FDA授予突破性疗法称号,并获日本厚生劳动省授予的创新药物资格与孤儿药称号,可以说是备受赞誉。
02、免疫治疗:西米普利单抗进入优先审查,总生存期延长一半
2020年10月30日,FDA授予西米普利单抗(Cemiplimab,Libtayo)优先审批资格,用于一线治疗PD-L1表达≥50%的局部晚期或转移性非小细胞肺癌患者。根据优先审查的要求,预计FDA将于2021年2月28日前公开本次审批的结果。
接受西米普利单抗治疗的患者中位总生存期为22个月,中位无进展生存期6.2个月;接受化疗的患者,中位总生存期为14个月,中位无进展生存期5.6个月。在总生存期方面,西米普利单抗将患者的生存期延长了一半以上,患者疾病进展的风险降低了41%。
在缓解率方面,西米普利单抗治疗的客观缓解率为37%,其中完全缓解率为3%,部分缓解率为33%;接受化疗的患者整体缓解率为21%,其中完全缓解率为1%,部分缓解率为20%。
在PD-L1表达水平≥50%的患者亚组分析中,接受西米普利单抗治疗时总生存期优势更加显著,中位无进展生存期达到8个月,整体缓解率为39%;接受化疗的患者,中位无进展生存期为6个月,整体缓解率为20%。
在PD-L1表达水平≥90%的患者亚组中,整体缓解率更是达到了46%。
在所有患者中,接受西米普利单抗治疗的患者中位缓解持续时间为27周,而接受化疗的患者,中位缓解持续时间为18周;西米普利单抗治疗将患者的缓解持续时间延长了一半!
2018年时,FDA曾经批准了西米普利单抗的皮肤鳞状细胞癌适应症。
小细胞肺癌新药
与非小细胞肺癌相比,小细胞肺癌的治疗难度更大,靶向治疗发展缓慢。小细胞肺癌是一类与吸烟史密切相关的肺癌,几乎所有的小细胞肺癌都存在吸烟史,且各类靶点检出率非常低,长期依赖放化疗。
针对化疗方案,有两款药物在2020年进入了快速审批或快速通道。
01、CDK4/6抑制剂:使化疗患者免受骨髓抑制困扰
小细胞肺癌是一类对于化疗比较敏感的癌症,但严重的不良反应一直是限制化疗使用、并导致患者中止治疗的主要原因。骨髓抑制是化疗最常见的不良反应,大多数化疗药物都可能引起不同程度的骨髓抑制,常见的包括阿霉素、卡铂、长春碱、异环磷酰胺等。
2020年8月17日,FDA授予Trilaciclib优先审批资格,用于降低小细胞肺癌化疗患者发生骨髓抑制的风险。此审批预计于2021年2月15日前公开结果。
02、化疗:新二线治疗方案获得快速通道资格,整体缓解率44%
伊立替康脂质体注射液(Irinotecan Liposome Injection,Onivyde,MM-398)属于化疗药物,曾被获批用于治疗胰腺癌患者。2020年12月2日,FDA授予伊立替康脂质体注射液快速通道资格,用于含铂化疗方案后疾病进展的小细胞肺癌患者二线治疗。
2019年世界肺癌大会上曾经公开过伊立替康脂质体注射液治疗经治小细胞肺癌患者的疗效数据,整体客观缓解率44%,最佳总缓解率72%,68%的患者经历了不同程度的肿瘤缩小。
进入快速通道,意味着伊立替康脂质体注射液将获得FDA更多的直接指导,并有资格获得快速审批。
小汇的抗癌小讲堂:什么是FDA的特别审批程序
相信关注小汇的各位病友,经常会在文章中看到“快速审批”、“突破性治疗指定”这样的特殊名词。但是这些审批程序究竟有什么含义、有怎样的代表意义呢?
01、优先审批(Priority Review)
标准的审批周期为10个月,获得优先审批资格的项目,周期仅为6个月,甚至可能更短,提前得到批准。
获得优先审批资格的药物或疗法,通常在疗效、安全性方面取得显著的突破,或能够在一个新的患者亚群中展现出良好的安全性与有效性,为现有方案做出补充。
02、快速通道(Fast Track)
快速通道的设立旨在促进治疗重大疾病或尚未满足临床需求的药物的开发,通过快速审批通道,使这些药物能够更快地上市。癌症属于重大疾病的一种,因此许多重磅的抗癌药物都曾经进入过快速通道,比如AMG-510。
进入了快速通道的药物,其取得的“特权”包括:更多与FDA交流的机会,更多FDA的直接指导,纳入优先审批或加速批准的权利等。
03、突破性疗法(Breakthrough Therapy)
突破性疗法比快速通道更进一步,主要授予那些在初步临床试验证据中显示,能够在一个或多个重点中证明药物的疗效较现有治疗方案的疗效具备突破性的进展的药物。突破性治疗指定的审核标准更加严格,同时,一旦药物在后期的试验中未能达到早期的期望值,FDA有可能会撤销其资格。
获得突破性疗法称号的药物,可以获得快速通道的所有“特权”,同时从Ⅰ期临床阶段开始就能够获得FDA的指导。
04、加速批准(Accelerated Approval)
加速批准允许FDA使用替代重点代替临床终点指标,评价一款药物的疗效并对其进行批准,以降低药物的研发成本和试验难度。
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期膀胱癌术后五年生存率高达90%,这五
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

警惕!乳腺癌复发偏爱这3大人群!术后一定
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【实体瘤溶溜病毒免费招募】溶瘤病毒Ml(
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
从多处转移到完全缓解!新型CAR-T细胞
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
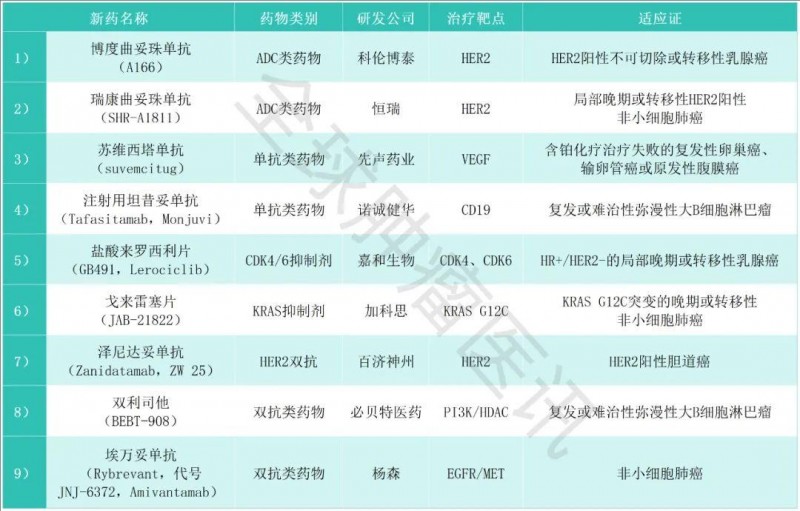
救命药加速入场!2025第二季度9款抗癌
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

抗癌月报(3月)|上市新药,CAR-T,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




