里程碑!上海完成全球首例鳞状肺癌GPC3 CAR-T给药!打破肝癌、胃癌、肠癌等实体瘤壁垒,DCR超90%!
里程碑!上海完成全球首例鳞状肺癌GPC3 CAR-T给药!CAR-T细胞疗法打破肝癌、胃癌、肠癌等实体瘤壁垒,DCR超90%
据搜狐网2025年4月13日报道,上海交通大学医学院附属胸科医院宣布,由上海市肺部肿瘤临床医学中心发起的全球首个靶向GPC3的自体CAR-T疗法C-CAR031,已顺利完成晚期鳞状细胞肺癌临床研究首例患者回输。这一突破性进展,如破晓曙光,为肺癌治疗领域点燃全新希望!
▲截图源自“sohu”
上海胸科医院完成全球首例GPC3 CAR-T,治疗鳞状肺癌患者给药
据GLOBOCAN数据显示,2022年中国新确诊肺癌病例约1,060,600例。其中,非小细胞肺癌(NSCLC)占比达80%,而鳞癌亚型在NSCLC中占20%-30%。尽管靶向治疗与免疫治疗改善了部分患者的预后,但对于那些无驱动基因突变,且对PD-(L)1抑制剂及含铂化疗耐药的晚期患者而言,临床治疗手段依旧捉襟见肘,五年生存率仅有6%。在这艰难的困境下,迫切需要开拓全新的治疗方案。
而C-CAR031的诞生可谓是一场及时雨。它通过靶向GPC3,并结合装甲技术改造,极大地提升了CAR-T在实体瘤中的存活与扩增能力。首例患者回输的成功,不仅验证了技术可行性,更为那些被PD-1耐药、驱动基因阴性困扰的患者开辟了一条全新的治疗路径,有望成为改写命运的"第三种武器"。尤为值得振奋的是,这是GPC3靶向CAR-T疗法首次进军肺癌领域,堪称里程碑式跨越!随着研究持续推进,这一创新疗法必将绽放更多光芒,为万千患者驱散病痛阴霾,重塑实体瘤治疗格局!让我们拭目以待!

▲图源“上海交通大学官网”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
C-CAR031首战肝癌告捷,疾病控制率超90%
C-CAR031是一款靶向GPC3(肝癌黄金靶标)的CAR-T细胞疗法,由阿斯利康基于TGFβRII(转化生长因子-β受体II)显性负装甲发现平台设计,并由西比曼生物在中国生产并联合开发。其核心优势在于双重靶向机制:一方面,特异性结合肝癌、肺癌等实体瘤中高表达的GPC3;另一方面,搭载TGFβ信号通路阻断“分子盾”,突破肿瘤微环境的免疫抑制。
早在2024美国临床肿瘤学会 (ASCO)年会上,西比曼生物就公布了的C-CAR031首次人体临床研究(IIT)的惊艳数据,针对多线治疗失败的晚期肝癌(HCC)患者(先前接受1-6线治疗),该疗法展现出可控安全性与显著抗肿瘤活性。
本次研究共入组24例晚期(BCLCC期)肝细胞癌(HCC)患者,其中83.3%(20/24)的患者伴肝外转移,既往治疗中位线数3.5(1-6线),95.8%(23例)接受过免疫检查点抑制剂(ICI)及酪氨酸激酶抑制剂(TKI)。入组接受4个剂量水平(DL)的C-CAR031输注。
结果显示:全部入组患者的疾病控制率(DCR)高达90.9%,客观缓解率(ORR)达50.0%(详见下图)。在22例可评估疗效的患者中,90.9%的患者出现肿瘤缩小,肝内及肝外病灶中位缩小率高达44.0%(范围为3.4%-94.4%)。中位随访5.82个月,Kaplan-Meier 估计的中位无进展生存期(PFS)为4.27个月(95%CI,2.86-8.90)(详见下图)。
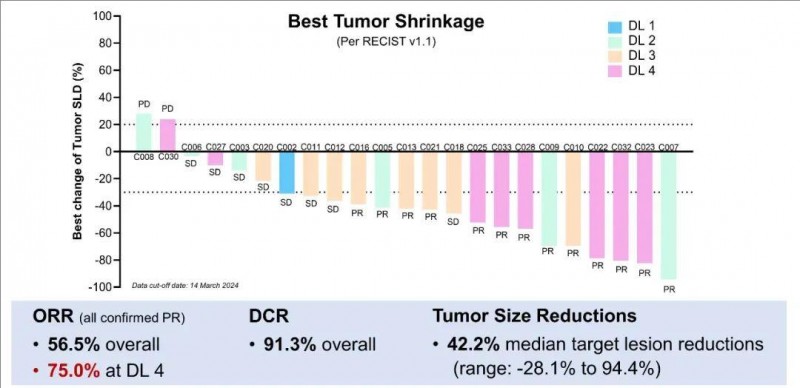
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得注意的是,C023与C010两位患者在接受C-CAR031治疗后,均展现出令人振奋的疗效——肿瘤持续退缩。
其中,C010号患者(DL3),疗效更为持久,持续12个月以上的跟踪显示,肿瘤始终处于稳定缩小状态。
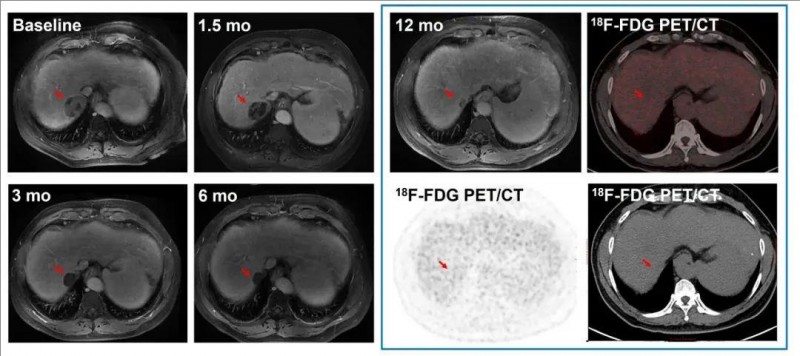
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
另一例C023号患者(DL=4),治疗1.5个月时,肺转移病灶即出现深度应答,影像学可见肿瘤显著缩小。

▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
CAR-T疗法在实体瘤战场的"屠榜"时刻,横扫胃癌、肠癌、肺癌、前列腺癌等四大癌种
CAR-T 细胞疗法在血液系统恶性肿瘤领域已取得显著成果,获批用于治疗 B 细胞白血病、淋巴瘤及多发性骨髓瘤。然而,实体瘤治疗仍面临重大挑战 ——至今尚无 CAR-T 疗法获批上市。肿瘤微环境的免疫抑制特性,以及 CAR-T 细胞难以有效浸润实体瘤组织,是导致 III 期临床试验稀缺及获批疗法空白的核心障碍。值得振奋的是,科研界正积极探索破局之道:众多创新策略已进入实验或临床阶段,为实体瘤 CAR-T 疗法带来曙光。
▼CAR-T治疗实体瘤热门靶点
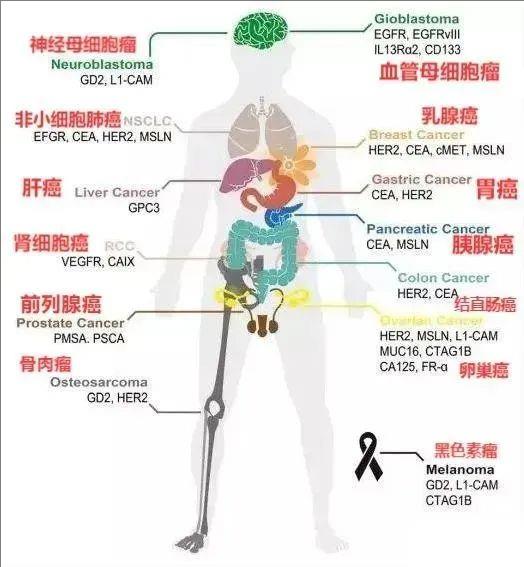
01、中国自研CLDN18.2 CAR-T疗法,亮剑胃癌和前列腺癌,客观缓解率可达42.9%
satri-cel(satricabtageneautoleucel,研发编号CT041)是我国自主研发的一款靶向CLDN18.2的CAR-T细胞疗法,主攻胃癌治疗领域。2024年美国临床肿瘤学会(ASCO)大会披露的1b/2期研究(NCT04404595)数据令人瞩目——该研究聚焦CLDN18.2阳性晚期胃癌/胃食管结合部癌(GC/GEJ)及前列腺癌(PC)患者,旨在评估satri-cel的安全性与疗效。
截至2023年5月14日,A组共有24名患者接受了白细胞分离术。其中19例患者[包括7例胃癌/胃食管结合部癌(GC/GEJ)、12例前列腺癌(PC)患者],既往治疗线数中位数为3(范围:1-8)。
结果显示:对于所有患者,最佳客观缓解率(ORR)为26.3%,中位缓解持续时间(DOR)为3.7个月,临床获益率(CBR)为42.1%。其中在胃癌/胃食管结合部癌(GC/GEJ)组中,客观缓解率(ORR)为42.9%(3/7),中位缓解持续时间(DOR)为6.9个月,临床获益率(CBR)为57.1%。前列腺癌(PC)组的ORR为16.7%(2/12),中位DOR为3.4个月,CBR为33.3%。
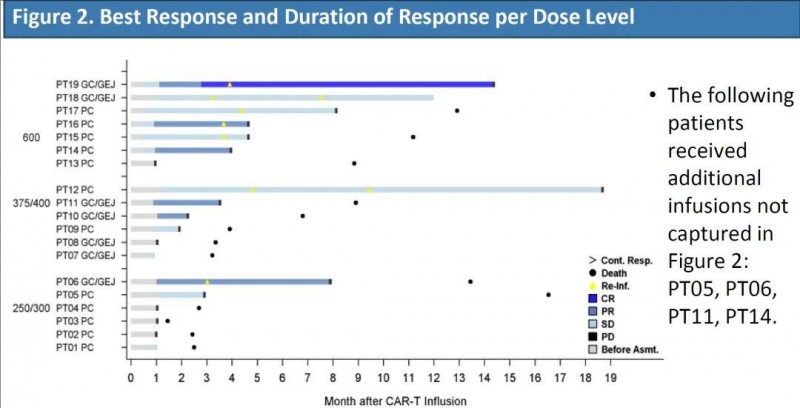
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,Satri-cel的安全性和疗效已被证明对接受过大量治疗的CLDN18.2阳性晚期胃癌/胃食管交界处癌和前列腺癌(PC)患者有良好的前景。
02、70%病情稳定!国产CEA CAR-T疗法暴击转移性结直肠癌
癌胚抗原(CEA)是胃肠道癌症的高敏标志物,在结直肠癌(CRC)组织及血清中广泛表达。值得注意的是,除胃肠道外,CEA仅低水平表达于上皮细胞面向管腔的顶端膜面,而该区域难以被免疫细胞触及——这一特性使其成为CAR-T疗法的理想靶点。
我国曾开展过一项针对CEA阳性结直肠癌(CRC)患者的I期临床试验(NCT02349724),入组10例伴肝、肺转移的难治性病例:80%(8/10)合并肝转移,50%(5/10)合并肺转移;8例曾行原发病灶肠切除术,化疗中位线数2.5(1.25-3线)。所有患者的中位年龄为58岁(48.8-67岁),入组接受静脉输注CEACAR-T细胞治疗。
结果显示:10例在既往治疗中,出现疾病进展(PD)的患者中,有7例在CAR-T治疗后病情稳定(SD),肿瘤直径略有变化。其中Ps3和Ps5患者持续稳定超30周。
值得一提的是,两例典型病例尤为瞩目。
其中P9-2患者PET/CT显示,肿瘤活动明显减弱,肿瘤代谢活性显著降低(详见下图)。
▼接受DL5治疗的P9-2在CAR-T输注前(左图)和4周后(右图)的PET/CT评估

▲图源“Molecular Therapy”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
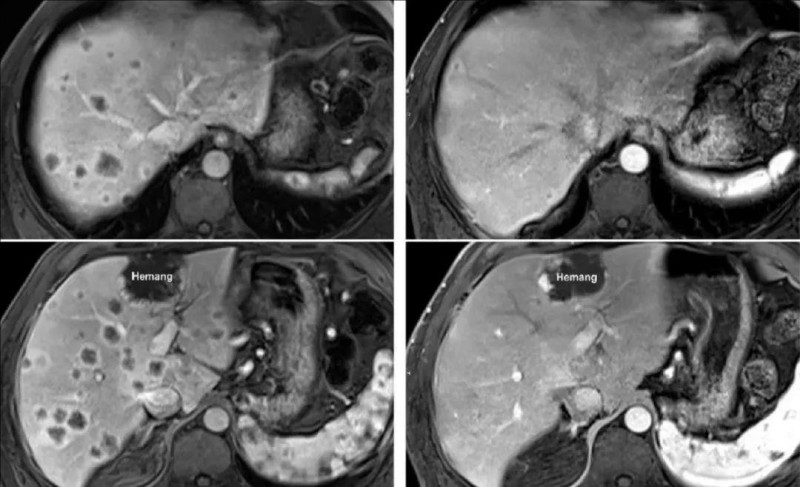
另一例P10患者经DL4剂量治疗后,MRI证实一个肝内病灶缩小(详见下图)。
▼接受DL4治疗的P10在CAR-T输注前(左图)和4周后(右图)的MRI评估
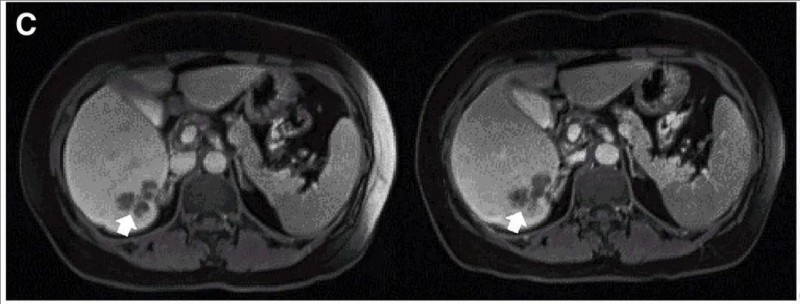
▲图源“Molecular Therapy”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
03、全球首款DLL3靶向CAR-T疗法—AMG119,突破小细胞肺癌治疗瓶颈,1.1个月快速显效,中位OS达7.4个月
DLL3作为抑制性Notch配体,在多数小细胞肺癌(SCLC)细胞表面高表达。而AMG119正是一种靶向δ样配体3(DLL3)的CAR-T细胞疗法,同时也是首个治疗小细胞肺癌(SCLC)的CAR-T细胞疗法。临床前研究证实,其能特异性杀伤DLL3阳性SCLC细胞系,并显著抑制异种移植瘤生长。
《临床肿瘤学杂志》公布的1期临床试验(NCT03392064)数据令人振奋,该研究纳入5例复发/难治性SCLC患者(中位年龄为59岁,范围33-64岁),均接受过≥1种铂类化疗后病情进展。

▲截图源自“BMJ”
结果显示:在4例可评估疗效的患者中,1例患者(队列2)在首次给药后1.1个月达到确认的部分缓解(PR)。2例患者病情稳定(SD),其中1例患者的靶病灶总数较基线(治疗前)缩小了16%。中位无进展生存期(PFS)为3.7个月(范围:1.1-6.7个月),中位总生存期(OS)为7.4个月(范围:4.6-18.9个月)。
总之,上述研究证实AMG119安全性可控,且展现出显著抗肿瘤活性,为小细胞肺癌(SCLC)的治疗开辟了新路径。
小编寄语
CAR-T细胞疗法经过数十年的发展,已成为肿瘤治疗领域的新兴支柱,作为肿瘤免疫细胞疗法中的佼佼者,在治疗血液肿瘤方面的成绩有目共睹。如今CAR-T技术也已发展到了第五代,国内外相继有13款产品获批上市。CAR-T疗法的出现打破了传统的肿瘤治疗模式,肿瘤免疫疗法也成为了继手术、放化疗后的第四类肿瘤治疗方法。
好消息是,中国已成功研发出多款针对多款血液肿瘤及实体瘤的CAR-T疗法,并在国内多家知名癌症中心启动临床,想明确自身靶点或寻求CAR-T等新型疗法帮助的患者,可将完整的病理报告、治疗经历等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Zhang Q,et al.Phase I study of C-CAR031, a GPC3-specific TGFβRIIDN armored autologous CAR-T, in patients with advanced hepatocellular carcinoma (HCC)[J]. 2024.
https://meetings.asco.org/abstracts-presentations/234377
[2]Botta G P,et al.CLDN18. 2 chimeric antigen receptor T cell therapy for patients with advanced gastric and pancreatic adenocarcinoma: Results of ELIMYN18. 2 phase 1b clinical trial[J]. 2024.
https://ascopubs.org/doi/10.1200/JCO.2024.42.3_suppl.356
[3]Zhang C,et al.Phase I escalating-dose trial of CAR-T therapy targeting CEA+ linkstatic colorectal cancers[J]. Molecular Therapy, 2017, 25(5): 1248-1258.
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(17)30108-9?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001617301089%3Fshowall%3Dtrue
[4]Byers L,et al.697 A phase 1 study of AMG 119, a DLL3-targeting, chimeric antigen receptor (CAR) T cell therapy, in relapsed/refractory small cell lung cancer (SCLC)[J]. 2022.
https://jitc.bmj.com/content/10/Suppl_2/A728
[5]https://www.sohu.com/a/883427302_120088173
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐
早期前列腺癌术后五年生存率超99%,术后
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

4.22 全国肿瘤防治宣传周第六弹!CA
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

"现货抗癌利剑"出鞘
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
5年生存率翻倍机会来了!多款疫苗火力全开
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
早期前列腺癌术后五年生存率超99%,但是
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
重磅!"O+Y"双免
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05







![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




