重大进展!浙大破解癌症转移谜团,创新mRNA疫苗攻克转移壁垒!现惠及肺癌、胰腺癌、黑色素瘤等
重大进展!浙大破解癌症转移谜团,创新mRNA肿瘤疫苗攻克转移壁垒!现惠及肺癌、胰腺癌、黑色素瘤等
近日,浙江大学医学院附属第二医院的研究团队于全球知名期刊《Cell Reports Medicine》发表了突破性研究成果。团队深入剖析了肿瘤免疫逃逸的新机制,并以此为基石,成功研发出表位定向mRNA-LNP疫苗(mCM10-L)。该疫苗能够通过阻断MICA/Bα1/2脱落这一关键路径,有效抑制肿瘤转移,在相关研究中展现出了巨大的应用潜力,为攻克癌症指明全新方向,带来新的希望曙光!
▲截图源自“Cell Reports Medicine”
浙大二院团队破解肿瘤免疫逃逸新机制,研发新型mRNA肿瘤疫苗,降低癌症转移风险
浙大发表的这项研究聚焦于肿瘤转移问题,通过收集结直肠癌(CRC)患者的新鲜肿瘤组织、血清及外周血等样本,深入探究一种基于MICAa3保守B细胞表位的mRNA-LNP疫苗(mCM10-L)对肿瘤转移的抑制作用。
破解肿瘤免疫逃逸新机制
肿瘤转移是导致癌症患者预后不良的核心因素,而免疫治疗通过增强免疫监视机制成为预防全身转移的重要策略,主要通过增强免疫监视来控制和清除播散的肿瘤细胞。
研究团队通过对结直肠癌(CRC)患者样本的系统分析,揭示了MICA/B蛋白异常水解在肿瘤转移中的关键作用:MICA/B作为一种应激诱导蛋白,在多种实体肿瘤和血液系统恶性肿瘤中高表达,MICA/B的胞外区包含3个结构域:α1/2结构域(远端膜区):与NKG2D受体结合,激活T细胞毒性反应;α3结构域(近端膜区):含多个蛋白酶切割位点,异常水解导致α1/2结构域脱落,脱落的α1/2结构域形成可溶性MICA/B(sMICA/B)蛋白,其具有免疫抑制性,通过竞争性结合NKG2D受体、诱导受体内化等机制,显著抑制CD8⁺T细胞和NK细胞的杀伤功能,最终促进肿瘤免疫逃逸。加之肿瘤在体内转移过程极为隐匿,MICA/Bα1/2脱落现象难以捕捉,用于对抗的抗MICA/Bα3抗体不仅需要规律使用,还常出现耐药问题,使得肿瘤免疫逃逸的难题愈发棘手。
因此,利用肿瘤疫苗对MICA/Bα1/2的随机脱落开展长期且具预防性的免疫监测,是及时清除潜伏期癌细胞(LCC)、防范肿瘤转移的可行举措,对改善癌症患者的预后具有至关重要的意义。值得一提的是,浙江大学研发的新型疫苗,恰恰是从这一作用机制出发,开展抗癌研究与实践。
创新疫苗设计突破治疗瓶颈
mRNA作为新兴的遗传信息传递治疗分子,备受关注,与传统蛋白质和多肽抗原相比,mRNA无需大剂量即可实现持续翻译。在此背景下,浙大团队开发了一款针对多种肿瘤的mRNA-脂质纳米颗粒(LNP)疫苗——mCM10-L,它能够触发特定B细胞介导的抗转移活性,并探究其对肿瘤转移的抑制效果。
研究过程中,团队确定了位于MICAα3蛋白水解区的线性B细胞表位,进而设计出保守抗原肽Ma3P。研究证实,Ma3P能够诱导产生阻断MICA/Bα1/2脱落的特异性抗体,以此激活体内CD8+T细胞介导的抗肿瘤反应,展现出强大的抑制MICA/B+肿瘤细胞转移的能力。
为评估mCM10-L在人体内的免疫原性,团队利用新鲜人扁桃体样本在体外构建免疫类器官。结果显示,mRNA抗原主要在B细胞、CD4+T细胞、CD8+T细胞和浆细胞中吸收与表达(详见下图)。经mCM10-L刺激后,B细胞分化增强,持续分泌抗MICA huIgG抗体。研究还发现,mCM10-L能够诱导特异性抗体生成,阻断MICA/Bα1/2脱落,激活NK细胞和CD8+T细胞,抑制MICA/B+肿瘤细胞转移,促进MICA/B介导的免疫杀伤,凸显出该mRNA肿瘤疫苗的潜在应用前景。

▲图源“Cell Reports Medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
研究团队进一步评估了mCM10-L对其他类型肿瘤转移的疗效,将EGFP+MICA+MC38细胞通过尾静脉注射至小鼠体内,并在肿瘤形成5天内两次接种mCM10-L,结果显示小鼠肺转移形成数量减少。综上所述,相关数据表明mCM10-L在抗肿瘤进程中显著重塑了免疫微环境,实现了对NK细胞和CD8+T细胞的有效动员。
值得一提的是,该研究创新性建立"机制解析-疫苗设计-多维验证"研发闭环,不仅证实mCM10-L通过重塑免疫微环境(NK/CD8⁺T细胞活化率提升4.5倍)发挥抗转移作用,更为mRNA肿瘤疫苗研发提供了可推广的范式体系。目前研究成果已进入临床转化阶段,有望为实体瘤转移防治提供突破性解决方案,让我们拭目以待!
BI1361849-mRNA疫苗联合局部放疗,近半数晚期非小细胞肺癌患者病情稳定,中位总生存超1年
BI1361849(CV9202)是一种活性癌症免疫治疗药物,包含鱼精蛋白配制的、序列优化的mRNA,可编码6种非小细胞肺癌的相关抗原(包括MUC-1、MAGE-C1、MAGE-C2、NY-ESO-1、5T4、survivin),旨在诱导靶向免疫反应。
《癌症免疫治疗杂志》报道了“BI1361849联合局部放疗,治疗非小细胞肺癌Ib期临床试验(NCT01915524)的惊艳数据”。本次研究共入组的26例年龄≥18岁的IV期非小细胞肺癌(NSCLC)患者。
结果显示:46.2%(12/26)的患者达到病情稳定(SD)状态。截至最后1次随访,1例患者已确认达到部分缓解(PR),且肿瘤缩小范围可测量。6例未接受放射治疗患者的病变缩小>15%。

▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
此外,入组患者的中位无进展生存期(PFS)为2.87个月(详见下图a);从第一次BI1361849治疗开始的中位总生存期(OS)为13.95个月(详见下图b)。
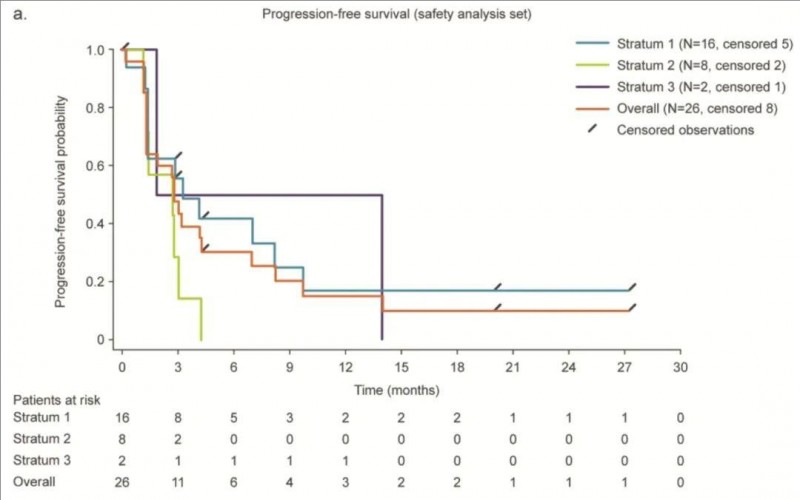
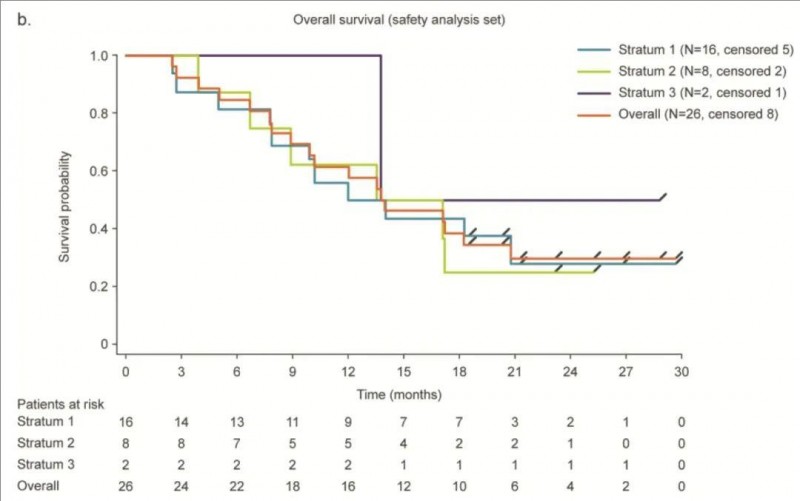
▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,BI1361849联合局部放射治疗(联合或不联合培美曲塞)耐受性良好,且检测到抗原特异性免疫反应。
中国患者如何寻求mRNA或其他癌症疫苗帮助
目前有两款mRNA癌症疫苗(JCXH-211注射液、ABO2011注射液)的临床试验,正在招募肺鳞癌、肝癌、结直肠癌、黑色素瘤、食道癌、三阴性乳腺癌、头颈部肿瘤等多款恶性实体瘤患者。
想参加上述临床试验的病友,可将近期病理报告、影像学或血液检查、治疗经历等相关资料,提交至医学部,进行初步评估或了解详细的入排标准。
mRNA-4157联合派姆单抗,黑色素瘤远处转移/死亡风险降62%,生存期显著延长
mRNA-4157(V940)是一种新型mRNA个体化新抗原疗法(INT),根据患者肿瘤DNA序列的独特突变特征设计并生产的,由合成mRNA(编码34种新抗原)组成。注射到体内后,会产生特定的T细胞反应,使其训练和激活抗肿瘤免疫反应,从而识别和攻击特定的癌细胞,最终达到防治黑色素瘤的目的。目前该疫苗已被美国FDA授予“突破性认定”。
在2023年ASCO(美国临床肿瘤学会)大会上,公布了“mRNA-4157(V940)联合派姆单抗(Keytruda),治疗高危III/IV期黑色素瘤”的IIb期临床试验结果显示,这款疫苗具有强大的预防肿瘤复发的效果,并引起了轰动。
本次研究共纳入157例完全切除的高风险皮肤黑色素瘤(Ⅲ B/C/D和Ⅳ期)患者,并将其分为两组,即派姆单抗单药治疗组(n=50)、mRNA-4157疫苗+派姆单抗联合治疗组(n=107)。
治疗18个月后结果显示:mRNA-4157疫苗与派姆单抗联用,将高危III/IV期黑色素瘤患者的远处转移或死亡风险降低了62%,复发或死亡风险降低了49%,并显著改善了患者的生存期!与派姆单抗单药治疗组相比,mRNA-4157联合治疗组患者的无复发生存期(RFS)及无远处转移生存期明显延长,18个月无复发生存(RFS)率分别为62.2%(单药治疗组) vs 78.6%(联合治疗组);18个月无远处转移生存期(DMFS)率分别为76.8%(单药治疗组) vs 91.8%(联合治疗组)。
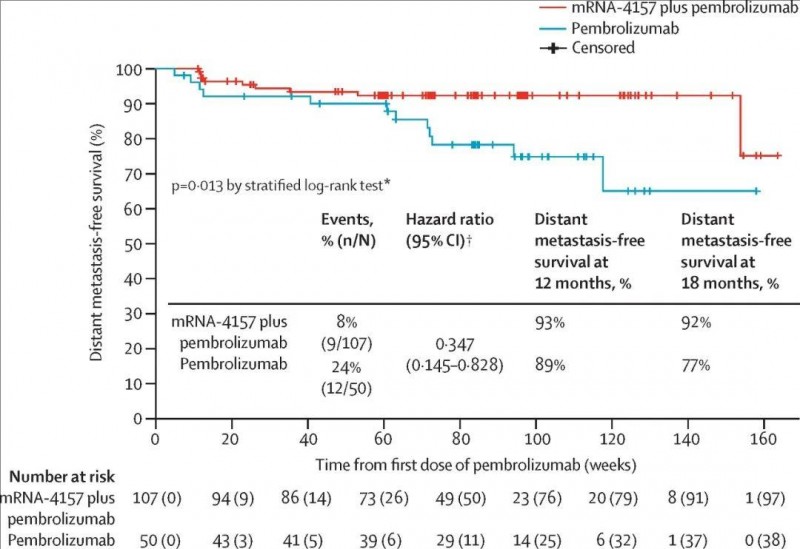
▲图源“Lancet”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
mRNA疫苗BNT122重拳出击胰腺癌,中位无复发生存时间超1年
BNT122(自体cevumeran、RO7198457)是一款个体化新抗原mRNA疫苗,可编码超过20种的特异性新抗原,从而用于治疗胰腺导管腺癌(PDAC),以降低胰腺癌的复发风险、延长患者的生存时间。
全球知名期刊《Nature》报道了“BNT122治疗胰腺导管腺癌的Ⅰ期临床研究的振奋数据”!本次研究共入组28例既往接受过手术治疗的胰腺导管腺癌患者,除了接种BNT122疫苗外,部分患者还接受了阿替利珠单抗(Atezolizumab)、改良版四药化疗方案(mFOLFIRINOX,包括亚叶酸、奥沙利铂、伊立替康、氟尿嘧啶)治疗。
结果显示:8例无应答患者的中位无复发生存时间(RFS)达到13.4个月。
值得一提的是,其中1例患者(29号患者)的血清CA19-9水平有所升高,虽出现新的肝脏病变(7mm),但该病灶在后续的成像中消失不见。这意味着,BNT122疫苗可能具有清除肿瘤微转移的能力(详见下图)。
▼29号患者回输BNT122疫苗前后,腹部MRI对比

▲图源“nature”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,BNT122疫苗与阿替利珠单抗+mFOLFIRINOX联合治疗是安全可行的,且该疫苗扩增的T细胞具有持久性,有助于降低癌症的复发风险。
小编寄语
癌症疫苗经过数十载的发展,逐渐从实验室转向临床研究。迄今为止,美国国立卫生研究院(NIH)临床试验网站上,收录的处于研发阶段的肿瘤疫苗项目多达7000余项,其中包含mRNA疫苗、树突细胞(DC)疫苗、个性化新抗原疫苗等诸多类型。小编也期望随着越来越多的癌症疫苗相继问世,未来能创造出更多的抗癌奇迹!
如果您也想寻求癌症疫苗或国内外其他抗癌新技术的帮助,可将治疗经历、出院小结、近期病理检查、影像学检查报告等资料,提交至全球肿瘤医生网医学部,初步评估病情或申请国内外抗癌专家会诊。
参考资料
[1]Wang R,et al.An epitope-directed mRNA vaccine inhibits tumor linkstasis through the blockade of MICA/B α1/2 shedding[J]. Cell Reports Medicine, 2025.
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(25)00054-0
[2]Papachristofilou A,et al.Phase Ib textareauation of a self-adjuvanted protamine formulated mRNA-based active cancer immunotherapy, BI1361849 (CV9202), combined with local radiation treatment in patients with stage IV non-small cell lung cancer. J Immunother Cancer. 2019 Feb 8;7(1):38.
https://pmc.ncbi.nlm.nih.gov/articles/PMC6368815/
[3]Weber J S,et al.Individualised neoantigen therapy mRNA-4157 (V940) plus pembrolizumab versus pembrolizumab monotherapy in resected melanoma (KEYNOTE-942): a randomised, phase 2b study[J]. The Lancet, 2024, 403(10427): 632-644.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(23)02268-7/abstract
[4]Rojas L A,et al.Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer[J].Nature,2023,618(7963):144-150.
https://www.nature.com/articles/s41586-023-06063-y
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

早期肾癌术后五年生存率超95%,五大防复
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

早期肾癌术后生存率超95%!预防复发的关
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

2025国际骨髓瘤关爱月|王鲁群教授团队
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

愈见大"CAR"|C
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

2025国际骨髓瘤关爱月|路瑾教授团队:
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
惊喜疗效!自体TIL细胞回输仅10周,复
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05






![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




