《Nature》头版惊爆:CAR-T创造19年无癌生存奇迹,强势打破实体瘤缓解记录
《Nature》头版报道:CAR-T细胞疗法创造19年无癌生存奇迹,强势打破实体瘤缓解记录
十二年前,年仅5岁的白血病患儿艾米莉(Emily),在接受CAR-T治疗仅仅23天后,成功实现了“临床治愈”,此后更是创造了无癌生存长达12年的生命奇迹,至此让CAR-T疗法一战成名!自那以后,CAR-T细胞在治疗血液系统恶性肿瘤方面,展现出了出色的疗效。相关报告显示,患者的生存数据在5~10年不等。随着研究的推进,多款CAR-T细胞疗法相继获批上市,为无数患者带来了生的希望。
然而,在实体瘤治疗领域,CAR-T却长期面临着困境。由于实体瘤特殊的生物学特性,CAR-T疗法一直难以突破,关于实体瘤治疗的中期临床和生物学结果的报道也十分匮乏。
但就在近日,全球知名期刊《Nature》的头版,给整个医疗界带来了一个重磅惊喜。其报道称,一位神经母细胞瘤患儿在接受CAR-T细胞治疗后,已持续处于缓解状态超18年(将近19年),并且这期间不需要额外治疗。据悉,这是目前所有接受CAR-T细胞疗法的患者中,持续时间最长的完全缓解病例,该研究成果同时也在《NatureMedicine(自然医学)》杂志上发表。这一重大突破,毫无疑问将为未来接受该疗法的实体瘤患者点亮了希望之光,让他们在与病魔艰苦斗争的漫漫长路上,看到了更多治愈的曙光,具有里程碑式的非凡意义!
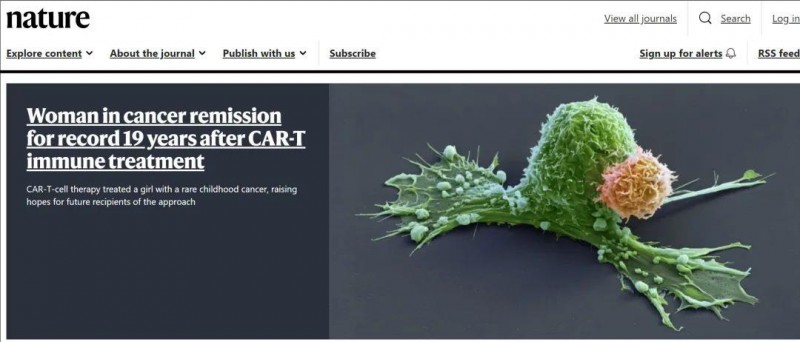
▲截图源自“Nature”
破纪录:CAR-T细胞疗法助神经母细胞瘤患儿完全缓解超18年
《NatureMedicine》发表的这项“GD2靶向CAR-T细胞疗法,对神经母细胞瘤(NB)I期临床试验(NCT00085930)的长期疗效”评估,显然弥补了CAR-T在治疗实体瘤方面的缺乏长期结果报告的缺憾。神经母细胞瘤是一种儿童神经细胞癌变性疾病,癌变通常发生在5岁之前。这类肿瘤对免疫系统的攻击有着很强的抵抗性,导致改良T细胞难以充分发挥功效。
本次1期临床研究时间跨度为2004年至2009年,共纳入19例神经母细胞瘤患儿。其中,11例(占比57.9%)患儿患有活动性复发疾病(详见扩展数据表1);另外8例(占比42.1%)患者无活动性疾病(NED)迹象,在这8例患者中,5例有复发病史,3例则是在完成高危疾病治疗后接受输注。在该试验过程中,研究团队注入了两种免疫效应细胞产品,分别是Epstein–Barr病毒(EBV)特异性T淋巴细胞、CD3活化T细胞。这两种细胞均表达靶向GD2的嵌合抗原受体(CAR),但不包含嵌入的共刺激序列(第一代CAR),(详见下图)。治疗满一年后,后续每年都会对患者展开随访。结果显示如下:
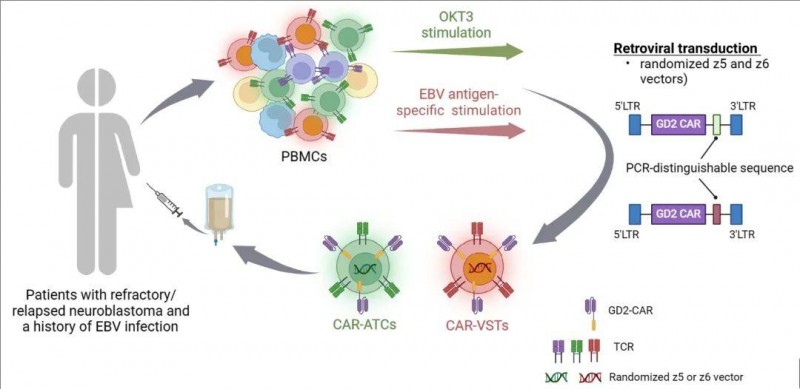
▲图源“Nature Medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
1、总体缓解情况:在11名输注时患有活动性疾病的患者中,1例达到部分缓解(PR),3例幸运地实现了完全缓解(CR)。在这3例完全缓解的患者中,2例患者的完全缓解(CR)状态持续了8年,1例患者的完全缓解(CR)状态更是奇迹般地持续了18年以上。
另外,在8名注射CAR-T时无疾病证据(NED)的患者中,5名患者在输注后的最后一次随访(时间为输注后10-15年)时依然无疾病症状。鉴于这些患者在输注时处于NED状态,他们很可能已经被治愈。
2、无事件生存率(EFS):15年无事件生存率(EFS)为31.6%,其中活动性疾病患者为18.2%,NED患者为50%(P=0.044,详见下图)。
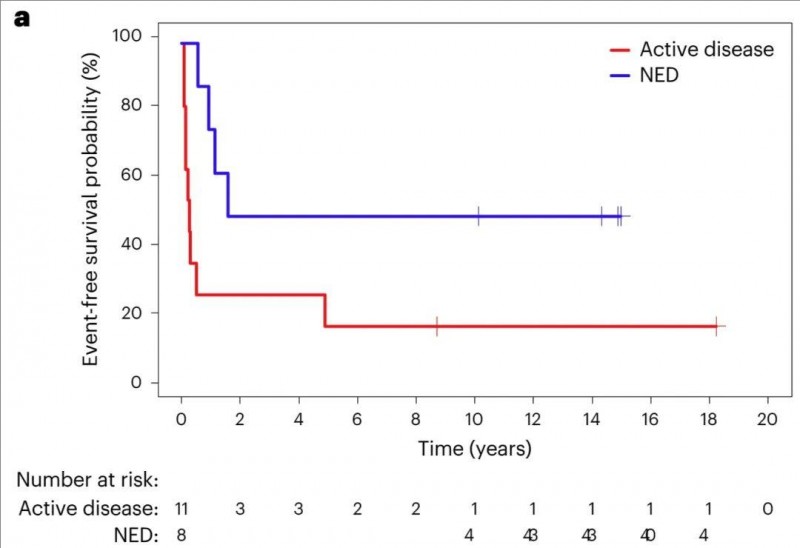
▲图源“Nature Medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、总生存率(OS):15年总生存率(OS)为36.8%,其中活动性疾病患者为18.2%,NED患者为62.5%(P=0.019,详见下图)。
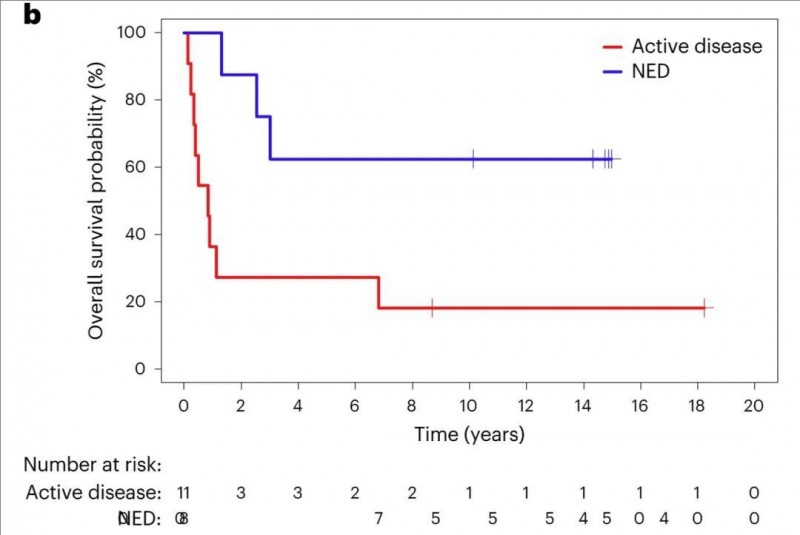
▲图源“Nature Medicine”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
特别值得关注的是患者1144,在接受CAR-T治疗前存在骨病变,输注后不仅获得了完全缓解(CR),还奇迹般存活超过了18年。据悉,在这漫长的18年里,她未接受过其他针对癌症的治疗。从目前已知的情况来看,她很可能是接受CAR-T治疗的癌症患者中,存活时间最长的一位!更令人振奋的是,她之后两次成功足月怀孕,并且都生下了正常的婴儿。
总之,上述研究有力地证明了,CAR-T细胞疗法(GD2CAR-atc/VST)应用于难治性/复发性神经母细胞瘤儿童患者时,兼具安全性与有效性。接受该疗法的患儿,不仅能实现了长达18年以上的完全缓解,且整个治疗过程中,未出现任何因CAR治疗引发恶性肿瘤,或导致其他长期不良影响的情况。尤其值得关注的是,这项研究记录下了CAR-T治疗活动性恶性肿瘤后的最长生存期,这一成果,为正在接受CAR-T治疗的实体瘤患者带来了曙光,让他们在与病魔的斗争中,看到了更多治愈的可能!
深度盘点:CAR-T细胞疗法攻克实体瘤的热门靶点
CAR-T细胞疗法,全称是“嵌合抗原受体T细胞疗法”。它的原理是利用基因工程技术,将CAR(嵌合抗原受体)插入患者的T细胞,从而对其进行基因改造。经过改造后的免疫细胞,能够产生一种名为嵌合抗原受体(CAR)的蛋白质。这种蛋白质就像一个精准的“导航仪”,专门识别并锁定癌细胞上的特定靶标,进而触发免疫细胞对癌细胞展开攻击,将其摧毁。
▼CAR-T细胞(橙色)正在攻击开始收缩的癌细胞(绿色)
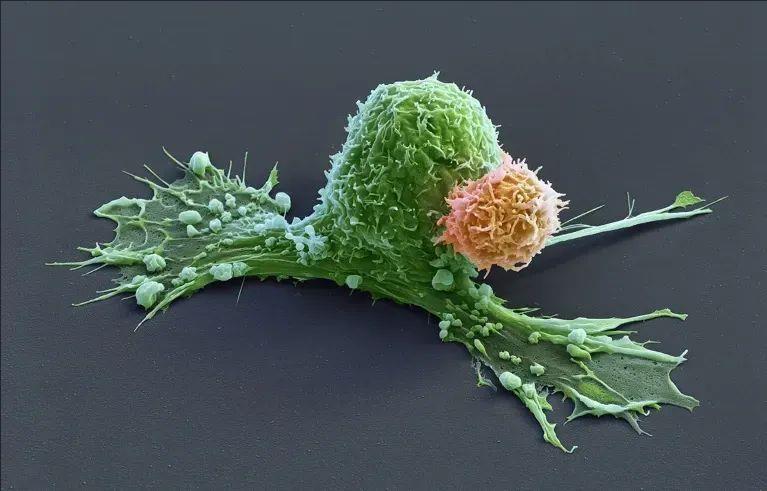
▲图源“Eye Of Science”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
CAR-T细胞疗法治疗实体瘤的热门靶点
目前,CAR-T细胞治疗在各类实体肿瘤领域的应用研究正如火如荼地开展,临床试验也在稳步推进。同时,多款热门的CAR-T靶点处于研发阶段,它们向多种实体瘤发起了强有力的冲击。CAR-T细胞针对的实体瘤及其热门靶点如下:
1、肺癌
在肺癌的CAR-T疗法研究中,EGFR、MSLN、MUC1、CEA、PD-L1、ROR1、HHLA2(也称为B7H7)、HER2以及其他多种靶抗原成为研究对象。这些抗原已在临床前和临床试验中接受了严格的评估,旨在明确它们是否适用于肺癌的CAR-T治疗。
2、乳腺癌
乳腺癌的CAR-T细胞疗法主要聚焦于受体酪氨酸激酶(RTK)家族的特定成员,以及细胞表面的某些蛋白质。主要包括HER2、EGFR、c-间充质上皮转化因子(c-MET)、ROR1、AXL这五种主要的RTK,作为乳腺癌临床前模型中CAR-T细胞疗法的靶点,已展现出令人满意的效果。
3、胃癌
研究表明,HER2、CEA、MUC1、Claudin18.2(CLDN18.2)、EpCAM、B7H3、MSLN、NKG2D等抗原是胃癌CAR-T细胞治疗的有效靶点。
4、胰腺癌
在胰腺癌的研究中,MSLN、HER2、EGFR、CEA、CD133等靶点被广泛关注。其中,CD133是胰腺导管腺癌(PDAC)免疫治疗领域研究较为深入的抗原,对它的研究有助于深入了解胰腺癌的发病机制,为开发新的治疗策略提供依据。
5、肝细胞癌(HCC)
GPC3在超过75%的HCC患者中表达,而在正常肝细胞中却不表达,这一特性使其成为HCCCAR-T细胞治疗中最常用的靶抗原。以GPC3为靶点的CAR-T细胞治疗,为肝细胞癌患者带来了新的治疗希望。
6、结直肠癌(CRC)
CAR-T细胞治疗结直肠癌的主要靶点包括CEA、MSLN、鸟苷酸环化酶C(GUCY2C)、EpCAM、HER2、双皮质素样激酶1(DCLK1)等(详见下图)。针对这些靶点的研究,将有助于推动结直肠癌治疗技术的进步,改善患者的生存状况。
▼常见实体肿瘤的CAR-T治疗靶点
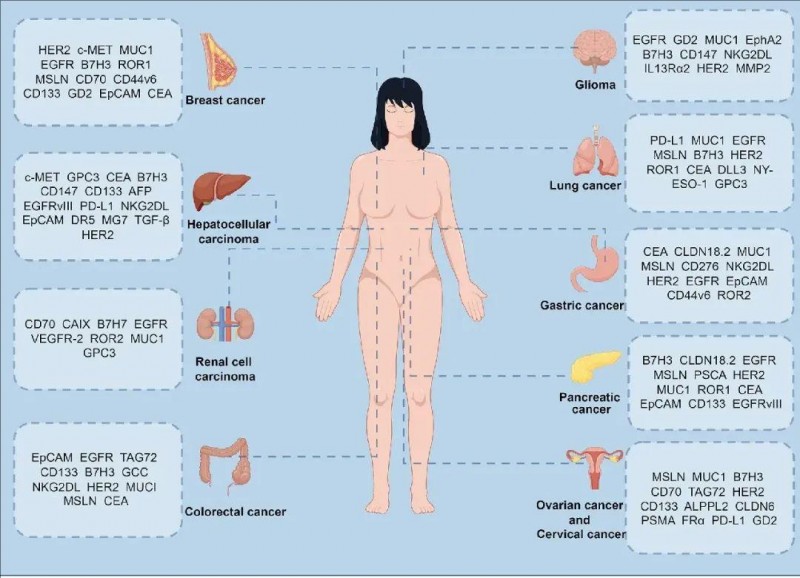
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
打破僵局!CAR-T细胞疗法:重塑实体瘤治疗新格局
C-CAR031 CAR-T细胞重拳出击肝细胞癌,近半数患者病情缓解
2024年美国临床肿瘤学会(ASCO)大会上,公布了一款我国自研的C-CAR031(一款针对肝癌细胞“黄金”靶标——GPC3的CAR-T细胞疗法),治疗晚期不可切除的肝细胞癌(HCC)的1期惊艳临床数据(NCT05155189)!
本次研究共入组24例晚期(BCLCC期)肝细胞癌(HCC)患者,几乎所有患者(95.8%,23名)都接受了免疫检查点抑制剂(ICI)和酪氨酸激酶抑制剂(TKI)治疗。其中83.3%(20/24)的患者伴肝外转移,他们先前接受治疗的次数中位数为3.5次(范围在1-6次)。入组患者接受了4个剂量水平(DL)的C-CAR031输注。
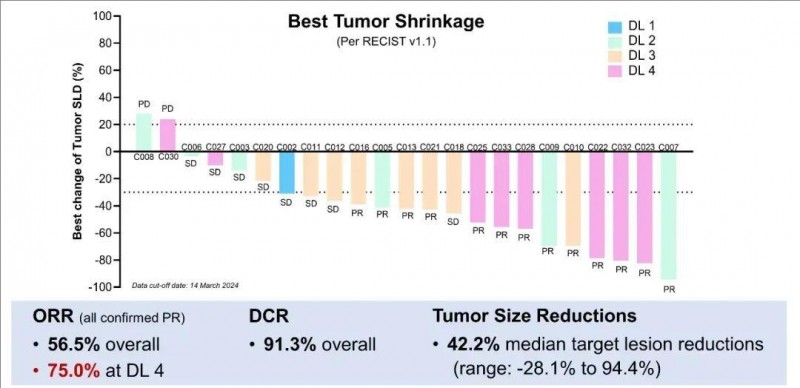
结果显示:经过5.82个月的中位随访,全部入组患者的疾病控制率(DCR)高达90.9%,客观缓解率(ORR)达50.0%(详见下表)。在22例可评估疗效的患者中,90.9%的患者出现肿瘤缩小,且缩小范围不仅局限于肝内病变,肝外病变同样有缩小表现,中位缩小率高达44.0%(范围:3.4%-94.4%)。
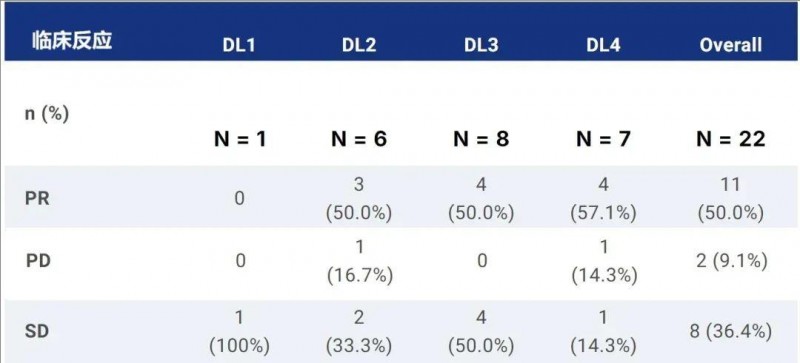
▲数据源自“ASCO”,医学部整理汇总
此外,Kaplan-Meier估计的中位无进展生存期(PFS)为4.27个月(95%CI,2.86-8.90)(详见下图)。
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
在本次研究中,有两位患者的治疗情况格外引人关注,分别为C010号患者与C023号患者。
先来看C010号患者,在接受剂量水平3(DL3)的C-CAR031输注后,治疗效果十分显著且持久,呈现出长达12个月甚至更久的持久反应,具体反应情况详见下图。
▼C010号患者CAR-T治疗前后的影像学对比
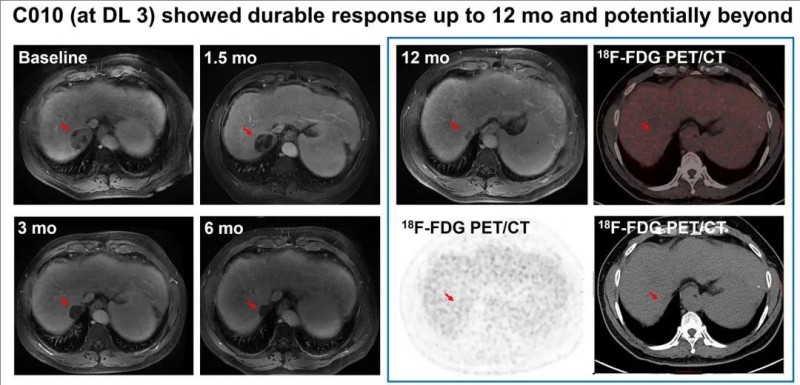
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
而C023号患者在接受C-CAR031治疗后,也出现了积极反应,肿瘤呈现出持续缩小的态势。自C-CAR031治疗1.5个月起,患者肺部转移病灶出现深度反应,肿瘤体积明显缩小,且数量也明显减少,治疗效果肉眼可见(详见下图)。
▼C023号患者CAR-T治疗前后的影像学对比
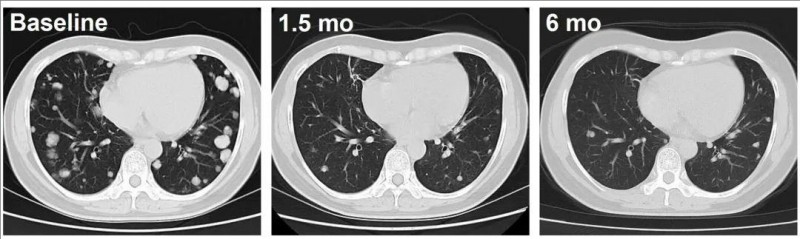
▲图源“ASCO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
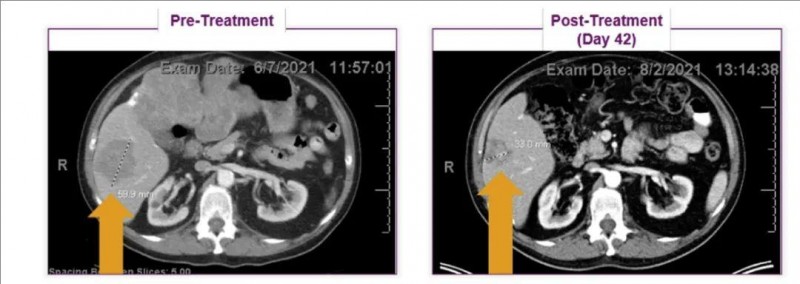
CTX130CAR-T细胞助透明细胞肾细胞癌患者,完全缓解持续18个月
在2022年第37届癌症免疫治疗学会年会(SITC)上,一则令人瞩目的案例被公之于众:新型CAR-T细胞——CTX130应用于透明细胞肾细胞癌(RCC)治疗,竟使患者获得了完全缓解(CR),惊艳了整个学界。
案例主角是一名64岁男性,被诊断为透明细胞肾细胞癌。此前,他接受过阿替珠单抗和卡博替尼治疗,然而病情还是复发了,肺部和胸膜均出现转移病灶。鉴于他的病情符合相关标准,随后便入组了CTX130治疗肾细胞癌的1期临床试验(NCT04438083)。
结果显示:该患者经CTX130治疗后,起初达到了部分缓解(PR)。更令人惊喜的是,在治疗的第3个月,他成功实现了完全缓解(CR)。并且在第18个月复查时,依旧维持着完全缓解(CR)状态!值得一提的是,这是异基因CAR-T细胞首次达成如此持久的完全缓解(CR),无疑为肾细胞癌的治疗开辟了新的方向。
▼该患者在CTX130治疗前、治疗第42天、治疗第18个月时的影像学对比
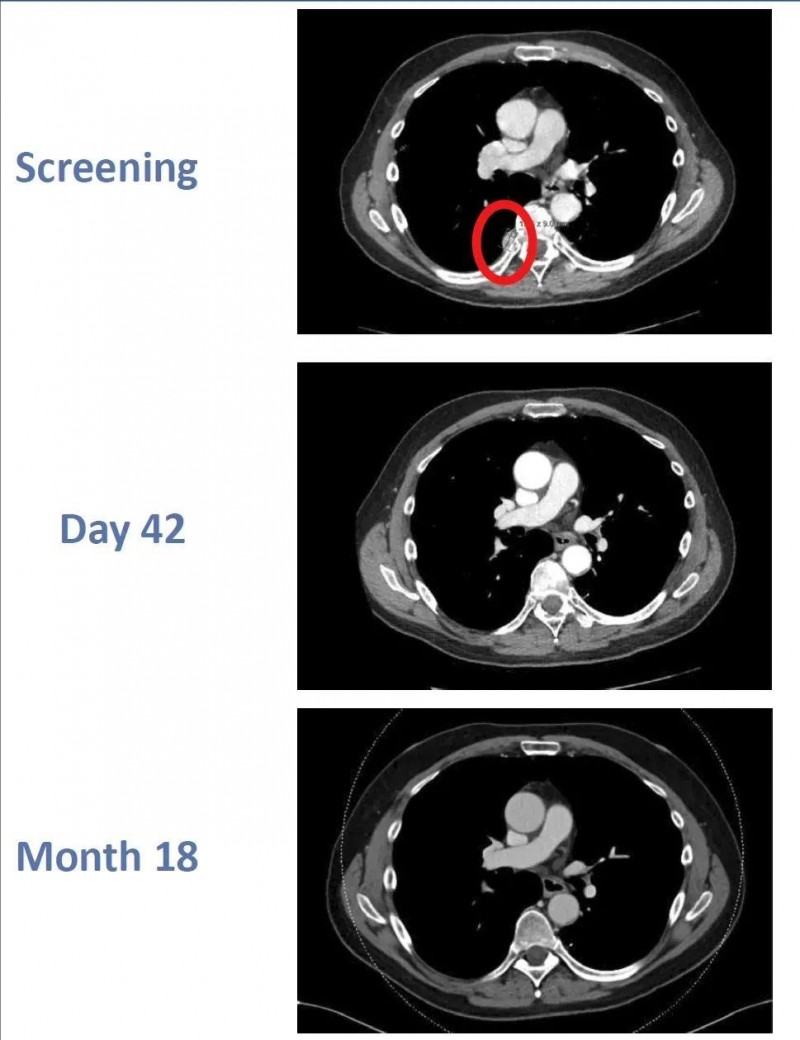
▲图源“BMJ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
BPX-601 CAR-T细胞,暴击胰腺癌、前列腺癌,6个月内病情稳定改善
《Nature Communications(自然通讯)》杂志报道了“BPX-601CAR-T细胞的1期临床研究(NCT02744287)”。该研究共纳入24例转移性胰腺癌(mPDAC)患者、9例去势抵抗性前列腺癌(mCRPC)患者,所有入组患者均接受BPX-601CAR-T细胞治疗。在这些患者中,29名(占比88%)以不同方式接受了rimiducid治疗,其中19名患者接受单剂量治疗,10名患者接受每周剂量治疗(剂量数范围在2-48之间)。
结果显示:BPX-601与rimiducid在接受过大量治疗的mCRPC患者中,表现出令人振奋的抗肿瘤活性。在9例mCRPC患者里,有5例(占比55.6%)出现血清前列腺特异性抗原(PSA)下降幅度≥50%(即出现PSA50反应);其中更有4例出现PSA90反应(也就是PSA水平下降≥90%)(详见下图)。在6例可评估疗效的患者(占比33.3%)中,2例出现部分反应(PR),1例患者的淋巴结病变稳定状态持续超过1年。
▼蜘蛛图显示BPX-601细胞输注后第1个月内,每个患者的血清前列腺特异性抗原(PSA)反应动力学
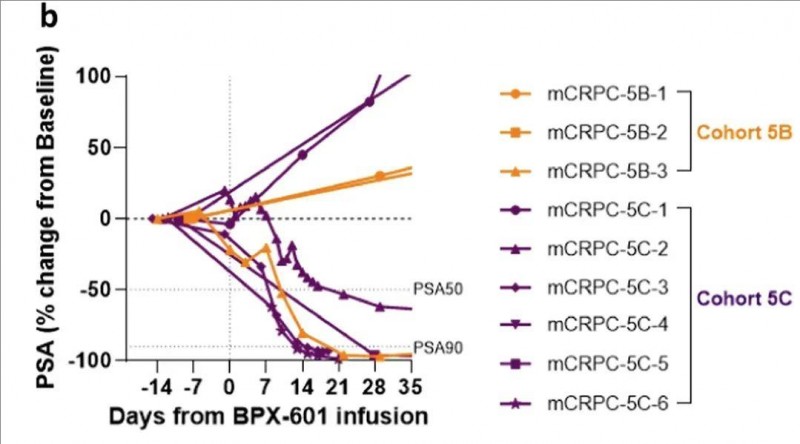
▲图源“nature communications”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
值得一提的是,在两例仅有骨病变的去势抵抗性前列腺癌(mCRPC)患者中,有1例出现了PSA90反应,并且其骨扫描结果在6个月内保持稳定甚至有所改善(详见下图)。下图展示了这名去势抵抗性前列腺癌(mCRPC)患者(mCRPC-5B-3)在输注BPX-601细胞+单次输注rimiducid后,肿瘤出现缩小的情况。
▼该患者在治疗前、BPX-601细胞输注后第42天的计算机断层扫描对比
▲图源“nature communications”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:肿瘤部位用橙色箭头指示。
小编寄语
CAR-T细胞疗法作为肿瘤免疫细胞疗法中的佼佼者,在血液肿瘤治疗领域的卓越成就有目共睹。近年来,它更是向实体瘤领域进军,并在胃癌、肺癌、胰腺癌、结直肠癌、脑瘤、前列腺癌等多种实体瘤的治疗中,取得了令人瞩目的成果。
相信上述介绍,已为晚期癌症患者点燃了新的希望之火。我们也热切期盼,CAR-T治疗实体瘤能早日获批上市,并尽快被纳入医保体系,让这一承载着无数患者希望的“天价“疗法,能够帮助到更多的癌症患者。想明确自身靶点或寻求CAR-T等新型疗法帮助的患者,可将完整的病理报告、近期影像学检查、治疗经历等资料,提交至医学部,进行初步评估,或申请国外内抗癌专家会诊。
参考资料
[1]Li, CH,et al.Long-term outcomes of GD2-directed CAR-T cell therapy in patients with neuroblastoma.Nat Med(2025).
https://www.nature.com/articles/s41591-025-03513-0
[2]Chen T,et al.Current challenges and therapeutic advances of CAR-T cell therapy for solid tumors[J]. Cancer Cell International, 2024, 24(1): 133.
https://cancerci.biomedcentral.com/articles/10.1186/s12935-024-03315-3
[3]Zhang Q,et al.Phase I study of C-CAR031, a GPC3-specific TGFβRIIDN armored autologous CAR-T, in patients with advanced hepatocellular carcinoma (HCC)[J]. 2024.
https://meetings.asco.org/abstracts-presentations/234377
[4]Pal S,et al.558 CTX130 allogeneic CRISPR-Cas9–engineered chimeric antigen receptor (CAR) T cells in patients with advanced clear cell renal cell carcinoma: results from the phase 1 COBALT-RCC study[J]. 2022.
https://jitc.bmj.com/content/10/Suppl_2/A584
[5]Stein M N,et al.PSCA-targeted BPX-601 CAR T cells with pharmacological activation by rimiducid in linkstatic pancreatic and prostate cancer: a phase 1 dose escalation trial[J]. Nature communications, 2024, 15(1): 10743.
https://www.nature.com/articles/s41467-024-53220-6
[6]https://www.nature.com/articles/d41586-025-00507-3
扫描进患者病友群

肺癌|胃癌|肝癌|结直肠癌|胰腺癌
乳腺癌|脑瘤|淋巴瘤|儿童肿瘤等

相关推荐

【HER2药物】新一代靶向药KN026终
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

从"无法切除"到&q
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
疾病控制率高达83.3%!中国首创非病毒
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

【ADC药物】新一代靶向药SYS6010
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05

2年无癌奇迹!γδT 细胞疗法力挽狂澜,
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05
无病生存从9个月飙升至2年!免疫王炸DC
EGFR突变型患者在非小细胞肺癌中约占30%,在欧美患者中约占10%~20%,在亚洲患者中占比超过50%,是非小细胞肺癌的第二大致癌驱动因素。...
全球肿瘤医生网 2020-08-05



 Qzone
Qzone



![[field:title/]](/uploads/allimg/20200224/1-2002241I5262J.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241I3461D.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H94LK.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241HKW34.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H619327.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H34H52.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241H22IH.jpg)
![[field:title/]](/uploads/allimg/20200224/1-2002241G93O18.jpg)




